技术分享:基于脱毒单链细菌毒素的蛋白质递送系统
Tips:在之前的“心房特异性的AAV9递送系统”和“精准靶向肺部的新型脂质纳米颗粒”两篇技术分享中,我们分别介绍了利用AAV9病毒递送系统以及LNPs非病毒递送系统完成基因递送。本期将详细介绍一种基于脱毒单链细菌毒素的蛋白质递送系统。
蛋白质生物疗法的发展已经彻底改变了许多人类疾病的治疗方式。但由于细胞膜这一强大的生物屏障,这些疗法大多开发用于细胞表面靶点。将治疗性蛋白质跨越细胞膜屏障递送进特定细胞内仍然是个重大挑战。CRISPR-Cas系统是一类深具潜力的治疗工具,通常利用病毒载体递送进细胞内,促使Cas蛋白持续性表达。然而,病毒递送系统存在宿主基因组随机整合、病毒载体免疫原性和装载容量限制等问题,而且CRISPR-Cas系统的持续表达使得脱靶效应不断累积[1, 2]。另外,还可以采用脂质体、纳米颗粒、细胞穿膜肽和电穿孔等非病毒递送方式,它们虽然可使进入细胞的Cas瞬时表达,减少了脱靶效应和免疫反应,但是整体效率较低[3, 4]。因此,开发有效介导生物大分子穿透细胞膜的递送方式,将解锁蛋白质生物疗法用于治疗细胞内靶点的巨大潜力。
2022年3月,Cell Reports上报道了一种利用脱毒单链细菌毒素作为载体的蛋白质递送系统,可将Cas13和Cas9等多种大蛋白以受体依赖方式递送到细胞系以及诱导多能干细胞(iPSC)分化来的人类神经元内,使其发挥功能[5]。
研究者选择脱毒的白喉毒素(DT)和肉毒杆菌神经毒素样毒素(BoNT/X)来作为递送载体。DT为单链蛋白,全长58 kDa,包含DTA、DTT和DTR三个部分,分别为21、20和17 kDa。其中,DTR是受体结合结构域,DTT是膜易位结构域,而DTA可使延长因子(EF-2)蛋白失活,从而阻断细胞蛋白质合成,导致细胞死亡。DT的受体是广谱表达的肝素结合表皮生长因子前体(HBEGF)。当DT与受体HBEGF结合后,可通过内吞作用进入细胞,在核内体的酸化作用下DT构象改变,发生膜易位使得DTA区域暴露到细胞质中,并在furin的作用下DTA被释放到细胞质中,进而造成细胞毒性。利用上述机制,结合脱毒形式的DTA(K51E,G52E和E138K),可将脱毒的DT(dDT)改造成蛋白质递送系统。研究者利用连接序列GSGSGSGSGS将靶蛋白融合到dDT的N端,产生嵌合体蛋白进行递送测试。BoNT/X作用机制与DT相似,研究者同样进行平行测试(图一)。
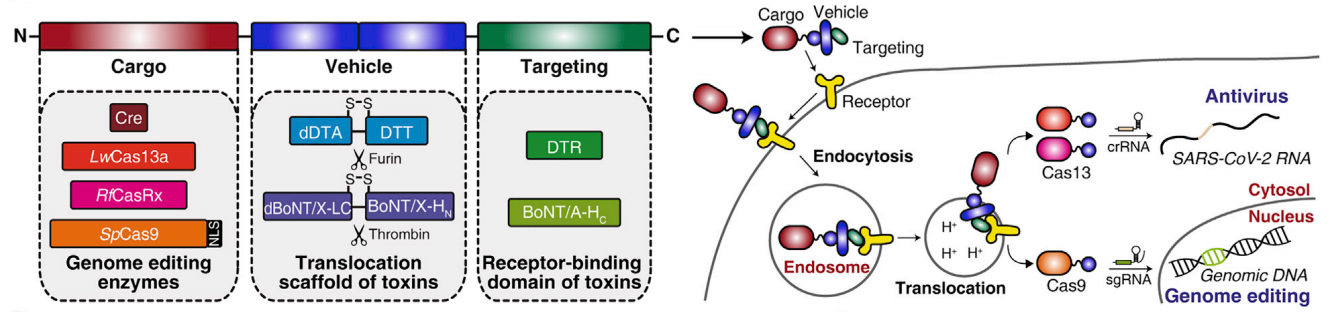
图一 基于脱毒DT和BoNT/X蛋白质递送系统的工作原理[5]
首先是针对靶蛋白Cas13a的递送测试。研究者分别构建了嵌合体蛋白Cas13a-dDT(205 kDa)和Cas13a-XLCHN-DTR(267 kDa),通过检测HeLa-GFP细胞中的GFP荧光蛋白的受抑制效果来评价其细胞内递送效果。由于crRNA无法利用该系统进行递送,因此提前瞬转导入细胞中(图二A)。之后,研究者分别将Cas13a-dDT和Cas13a-XLCHN-DTR嵌合体蛋白添加到细胞培基中,24小时后发现相比对照组细胞,GFP荧光和mRNA均被显著下调,并且呈现蛋白浓度依赖(图二B-F)。此外,研究者还测试了其他三个靶向内源性蛋白PPIB、KRAS和CXCR4的抑制效果,发现在添加嵌合体蛋白后它们的mRNA表达都被显著抑制(图二G-I)。以上结果表明,利用脱毒DT和BoNT/X的蛋白质递送系统,可将靶蛋白Cas13a成功递送到细胞质中。
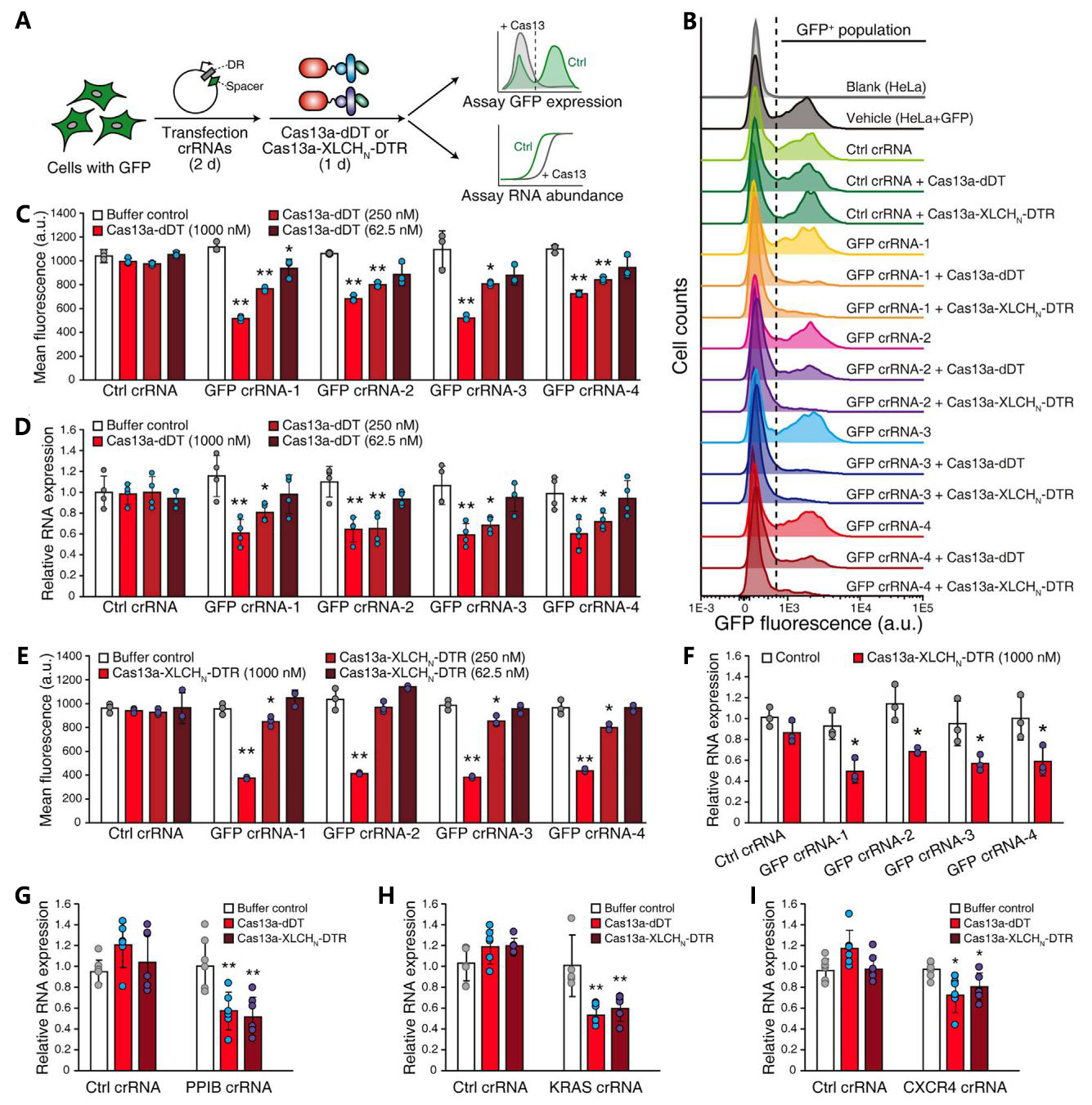
图二 基于脱毒DT和BoNT/X系统的Cas13a蛋白递送测试[5]
接下来,研究者针对靶蛋白Cas9进行递送测试,分别构建了嵌合体蛋白Cas9-dDT(221 kDa)和Cas9-XLCHN-DTR(283 kDa)。同样提前将sgRNA瞬转导入细胞后,在细胞培基中添加嵌合体蛋白,孵育48小时后进行sgRNA靶基因区域的基因组DNA二代测序(NGS)(图三A)。结果显示,添加了Cas9-dDT和Cas9-XLCHN-DTR蛋白的实验组,在HeLa细胞(图三B)和HEK293细胞(图三C)中均可检测到一定比例的基因编辑造成的序列插入或缺失,其中1nt序列插入的基因型占比最多(图三D),并且HEK293细胞的基因编辑效率更高。可是该系统的整体编辑效率相比病毒感染和脂质体瞬转两种递送系统都低了约100倍(图三B和C)。研究者进一步通过RNAi敲低DT受体HBEGF在HeLa细胞(图三E)和HEK293细胞(图三F)中的表达,发现添加Cas9-dDT和Cas9-XLCHN-DTR蛋白的编辑效率均被显著降低(图三G),证实了Cas9是通过受体介导的蛋白质递送方式进入细胞,从而执行基因编辑功能。以上结果表明,利用脱毒DT和BoNT/X的蛋白质递送系统,可将靶蛋白Cas9成功递送到细胞核内。
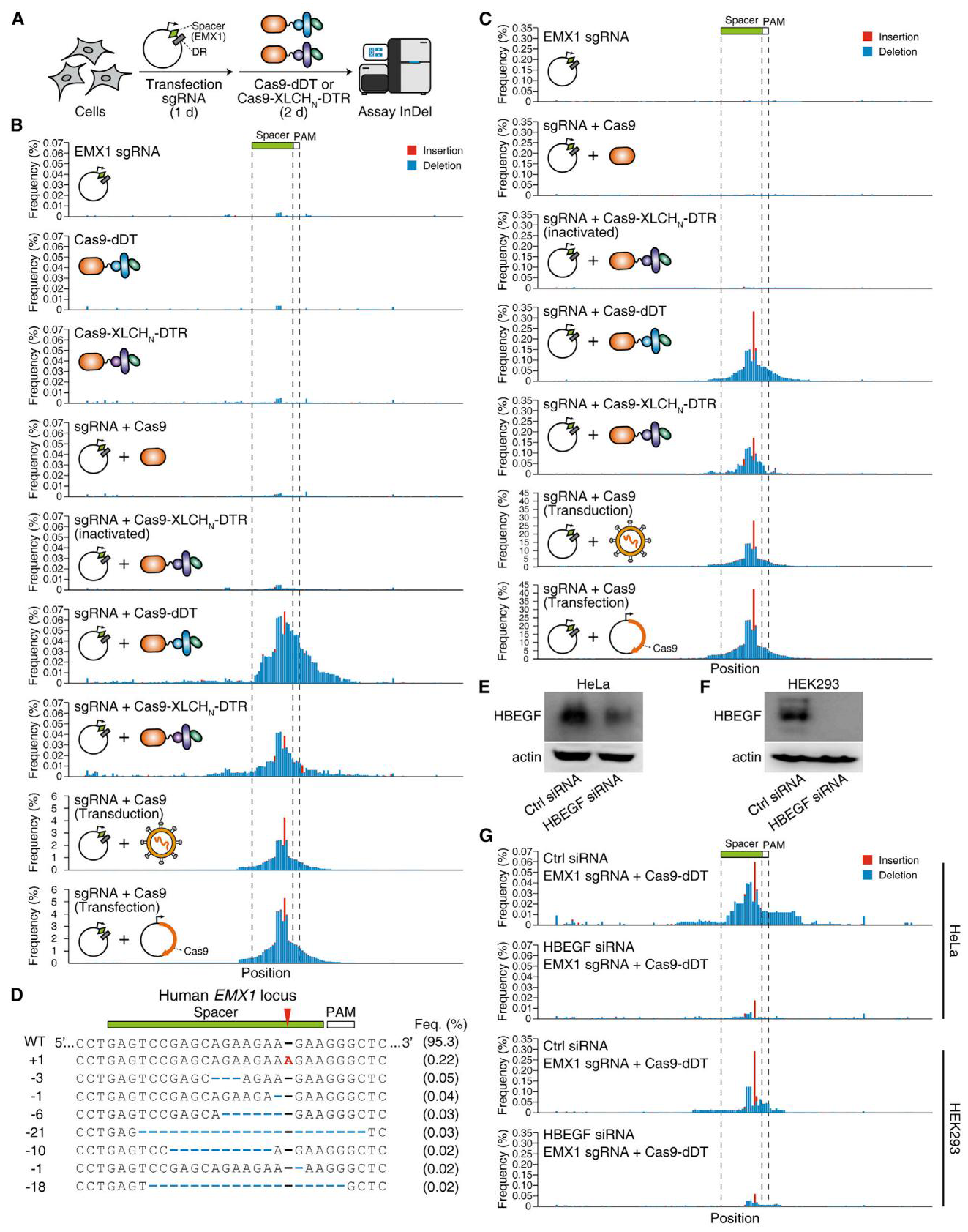
图三 脱毒DT和BoNT/X系统可递送Cas9蛋白进入细胞核[5]
最后,研究者选择递送困难的神经元细胞进行递送测试,通过iPSC分化获得人类神经元。由于BoNT/X系统自身可靶向作用于神经元,因此研究者构建并纯化了嵌合蛋白Cas9-XLCHN-AHC(316 kDa)。提前将sgRNA利用病毒导入神经元细胞后,在细胞培基中添加Cas9-XLCHN-AHC蛋白,孵育48小时后进行基因组DNA二代测序(图四A)。结果显示,添加了嵌合蛋白的实验组可检测到一定比例的基因编辑,尽管编辑效率仍低于病毒感染约100倍(图四B)。以上结果说明利用脱毒BoNT/X的蛋白质递送系统,可将靶蛋白Cas9成功递送到难以转染和感染的人类神经元细胞核内。
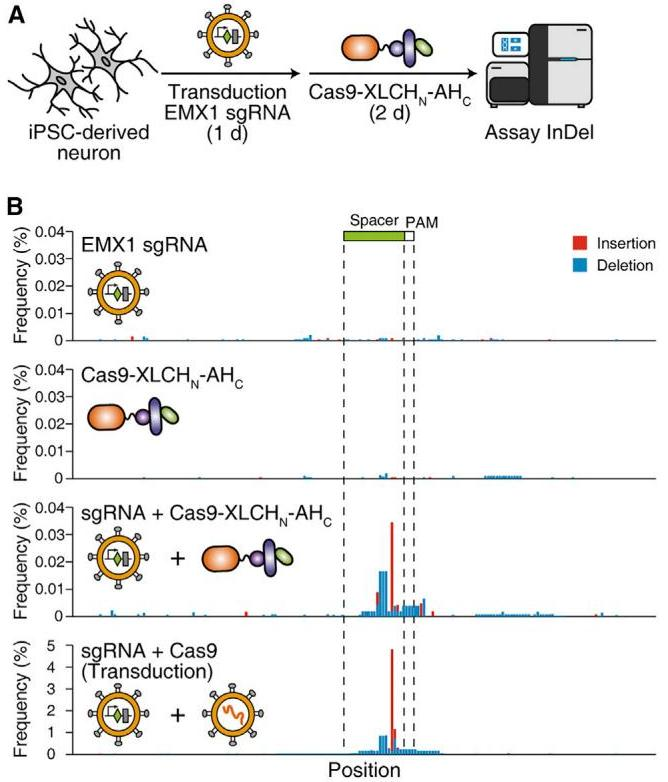
图四 脱毒BoNT/X系统可递送Cas9蛋白进入人类神经元的细胞核[5]
综上所述,这种基于脱毒单链细菌毒素模块的蛋白质输送系统,可将生物大分子治疗药物递送到靶向细胞中。与现有的药物传递系统相比,该系统具有几个显著优势:(1)生产工艺简单,仅生产单一的融合蛋白质;(2)可将Cas蛋白瞬时传递到细胞核内,从而减少脱靶效应的累积;(3)包含靶向细胞和脱离核内体的功能结构域,可以根据需要进行选择和人工改造,使用更为灵活。尽管如此,该系统仍有许多改进空间,比如通过优化融合蛋白质序列来提高蛋白质递送效率,开发其他单链细菌毒素的模块,进行体内功能验证等。该系统的进一步优化,将为蛋白质生物疗法用于治疗细胞内靶点提供一种强有力的工具。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Hanlon KS, Kleinstiver BP, Garcia SP, Zaborowski MP, Volak A, Spirig SE, Muller A, Sousa AA, Tsai SQ, Bengtsson NE et al: High levels of AAV vector integration into CRISPR-induced DNA breaks. Nat Commun 2019, 10(1):4439.
2. Wang D, Zhang F, Gao G: CRISPR-Based Therapeutic Genome Editing: Strategies and In Vivo Delivery by AAV Vectors. Cell 2020, 181(1):136-150.
3. Ramakrishna S, Kwaku Dad AB, Beloor J, Gopalappa R, Lee SK, Kim H: Gene disruption by cell-penetrating peptide-mediated delivery of Cas9 protein and guide RNA. Genome Res 2014, 24(6):1020-1027.
4. Lino CA, Harper JC, Carney JP, Timlin JA: Delivering CRISPR: a review of the challenges and approaches. Drug Deliv 2018, 25(1):1234-1257.
5. Tian S, Liu Y, Appleton E, Wang H, Church GM, Dong M: Targeted intracellular delivery of Cas13 and Cas9 nucleases using bacterial toxin-based platforms. Cell Rep 2022, 38(10):110476.



