技术分享:精准靶向肺部的新型脂质纳米颗粒
Tips:在“心房特异性的AAV9递送系统”技术分享中,我们介绍了病毒递送系统AAV9的载体设计,从而实现心房特异性的基因递送。本期将详细介绍非病毒递送系统LNPs的改造,从而实现肺部特异性的mRNA递送。
开发mRNA药物来治疗疾病具有巨大潜力,例如开发mRNA疫苗[1]、蛋白质替代疗法[2]和肿瘤免疫疗法[3]以及基因治疗[4]等。将mRNA安全有效地递送至体内特定器官和细胞是开发mRNA药物的主要挑战。脂质纳米颗粒(LNPs)作为一种非病毒的药物递送工具,大多局限于将mRNA药物递送至肝脏[5]。为了充分发挥mRNA药物的治疗潜力,将mRNA高效递送至肝外特定组织的技术亟待开发。
2022年2月,PNAS上发表了美国塔夫茨大学许巧兵教授团队研发的新型N-系列LNPs,可特异性靶向肺部组织递送mRNA。并利用其中的306-N16B LNP靶向递送Tsc2 mRNA至肺部组织,可有效缓解肺淋巴管肌瘤病(LAM)模型小鼠的肿瘤负荷[6]。
由于LNPs进入血液后,其表面会迅速吸附一层或多层蛋白质如血清蛋白等,形成“蛋白冠”结构。蛋白冠的存在将重塑LNPs的表面性质,从而影响LNPs与器官和细胞间的相互作用[7]。研究者前期已建立尾部含有酯键的O-系列LNPs,可选择性靶向肝脏递送mRNA[8]。本文研究者通过Michael加成反应将不同的丙烯酰胺尾部(N16B、N14B和N12B)与氨基头部(113、304和306)分别结合,生成9种可生物还原的N-系列LNPs(图一A)。将萤光素酶mRNA(fLuc mRNA)包装入N-系列LNPs,通过小鼠尾静脉注射给药。在IVIS成像系统下可观察到萤光素酶主要表达在小鼠肺部(图一B),且注射6小时后306-N16B LNP组的荧光酶表达最强,表明其肺部递送效果最佳(图一C)。
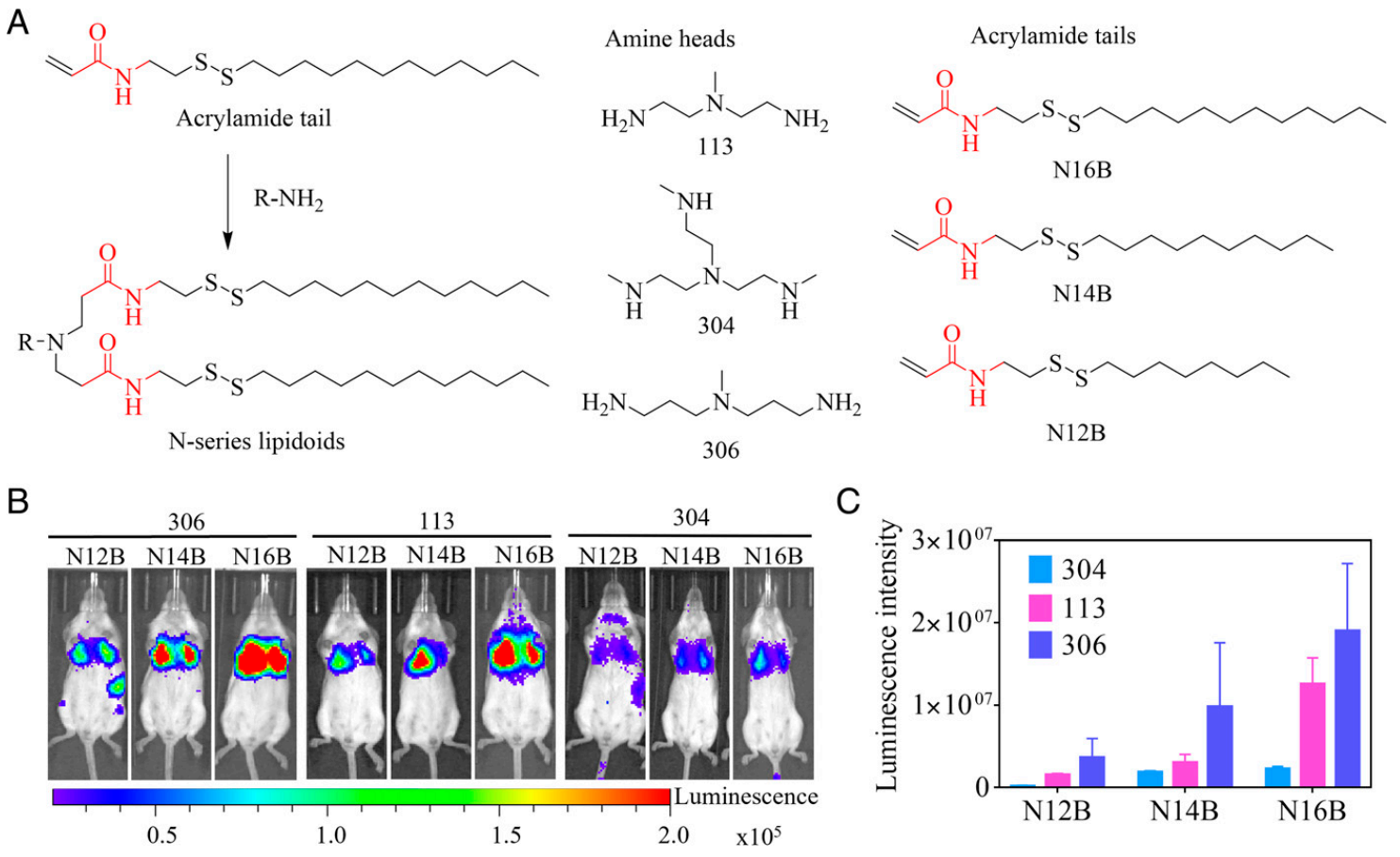
图一 N-系列LNPs的合成与体内筛选[6]
然后,研究者进一步研究N-系列LNPs靶向的肺细胞类群。选择递送效率最高的两种LNPs 306-N16B和113-N16B来递送Cre mRNA至Ai14报告小鼠体内,递送至细胞内的Cre重组酶表达将激活tdTomato红色荧光的表达(图二A)。LNPs递送7天后进行小鼠组织取样,共聚焦成像结果显示注射306-N16B和113-N16B LNPs的小鼠肺部均特异性检测到tdTomato红色信号(图二B和C)。研究者将肺部组织消化成单细胞悬液并进行流式细胞仪分析,结果表明306-N16B LNP能够选择性地将Cre mRNA递送至肺内皮细胞(图二B),而113-N16B LNP优先将Cre mRNA递送至内皮细胞,然后依次为巨噬细胞和上皮细胞(图二C)。这些结果表明,只需调整N-系列LNPs的头部结构即可靶向不同的肺细胞类群。

图二 不同头部结构的N-系列LNPs可靶向不同肺细胞类群[6]
接下来,研究者测试306-N16B LNP可装载的mRNA长度和RNA类型。相较于前述的fLuc mRNA的1,960个核苷酸与Cre mRNA的1,350个核苷酸,研究者利用306-N16B LNP同时装载4,521个核苷酸的Cas9 mRNA与靶向loxP的sgRNA(sgloxP),递送到Ai14小鼠体内(图三A)。7天后检测可见红色荧光蛋白主要分布在肺部(图三B和C)。值得注意的是,在肝脏中也能检测到少量红色荧光蛋白(图三B和C),推测可能是由于sgRNA的同时装载影响了LNP的物理属性,从而影响其组织特异靶向性。
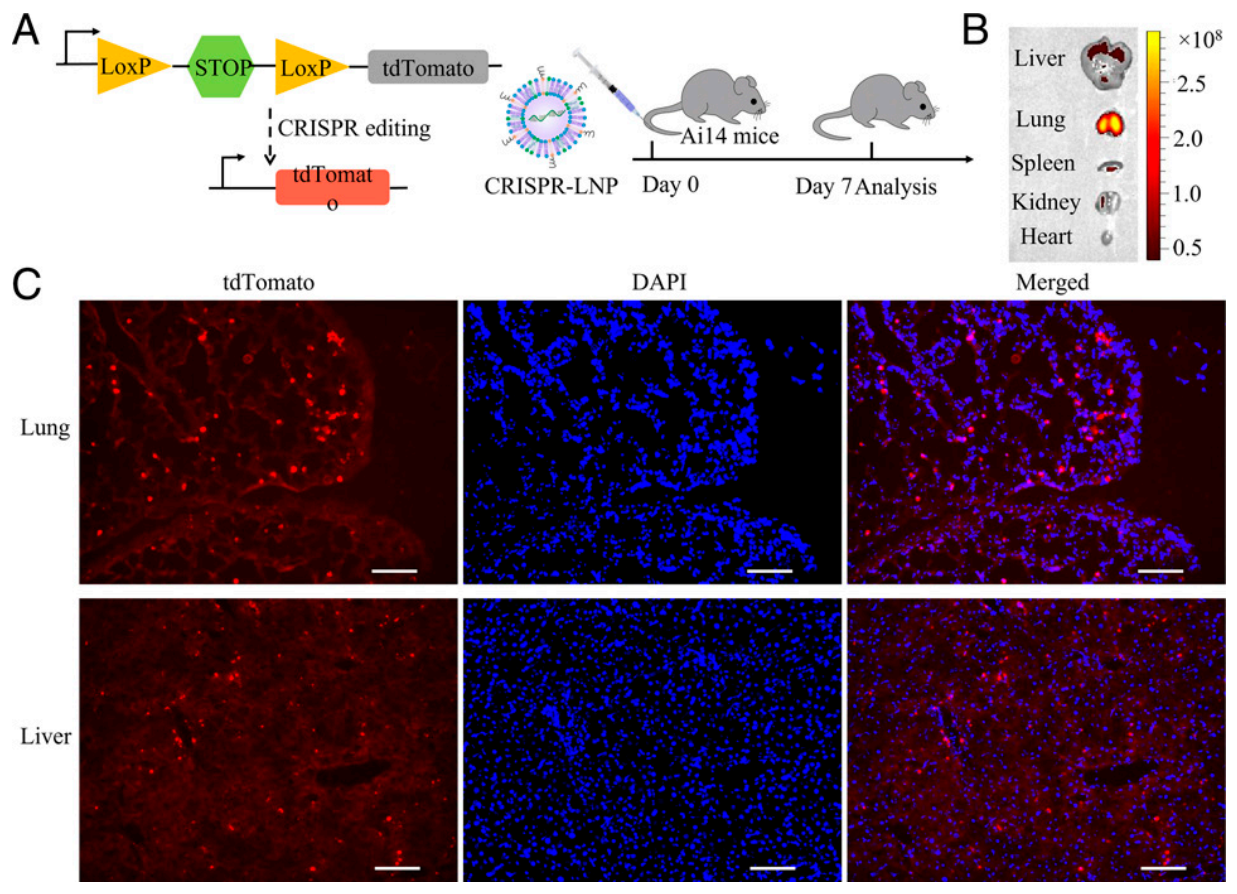
图三 Cas9 mRNA和sgRNA的共同递送[6]
最后,研究者在肺淋巴管肌瘤病(LAM)模型小鼠上进行mRNA药物的临床前实验,评价靶向肺部的LNPs递送mRNA药物的疗效。LAM是一种由Tsc1或Tsc2基因突变失活,造成mTORC1过度激活而导致的罕见遗传性肺病。研究者将特异性靶向肺部的306-N16B LNP和特异性靶向肝脏的306-O12B LNP(O-系列LNPs)[8],经等摩尔混合配制成LNP混合物(hLNP),利用hLNP递送Tsc2 mRNA(5,445个核苷酸)至LAM模型小鼠。其中,LAM模型小鼠是尾静脉注射Tsc2-null TTJ肾上皮肿瘤细胞模拟肺部结节的荷瘤小鼠,造模24天后开始隔天给药进行5次治疗(图四A)。造模34天作为实验终点,发现与hLNP空载组和未治疗组相比,装载Tsc2 mRNA的hLNP治疗可显著抑制肺结节的生长(图四B),IHC结果表明hLNP递送Tsc2 mRNA可显著降低肿瘤内的细胞增殖,并增强T细胞的浸润(图四C和D)。以上结果表明,特异性肺部靶向的LNPs可递送mRNA药物来治疗LAM。
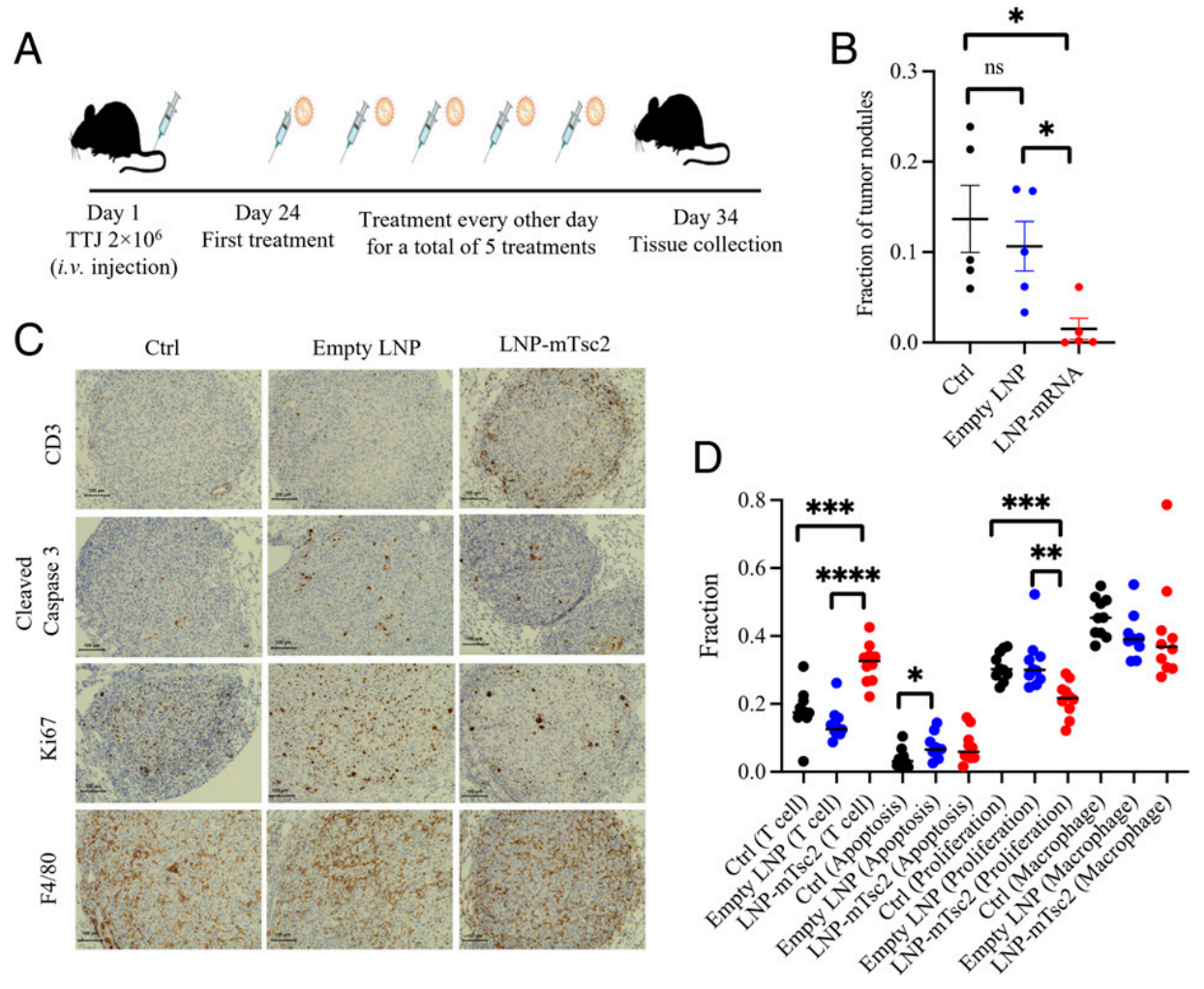
图四 靶向肺部的LNPs递送mRNA药物治疗LAM的疗效评价[6]
综上所述,研究者开发的新型N-系列LNPs,可以装载不同大小的mRNA药物,精准靶向肺部组织进行定向治疗,为治疗LAM提供更多可能。通过调整LNPs的头、尾部结构以及键合方式,可以改变LNPs的组织器官靶向性。进一步筛选优化特异性靶向的LNPs,可拓宽mRNA药物的应用范围,助力开发精准细胞与基因治疗药物。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂的调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Maruggi G, Zhang C, Li J, Ulmer JB, Yu D: mRNA as a Transformative Technology for Vaccine Development to Control Infectious Diseases. Mol Ther 2019, 27(4):757-772.
2. Sahin U, Karikó K, Türeci Ö: mRNA-based therapeutics--developing a new class of drugs. Nat Rev Drug Discov 2014, 13(10):759-780.
3. Pastor F, Berraondo P, Etxeberria I, Frederick J, Sahin U, Gilboa E, Melero I: An RNA toolbox for cancer immunotherapy. Nat Rev Drug Discov 2018, 17(10):751-767.
4. Zhang HX, Zhang Y, Yin H: Genome Editing with mRNA Encoding ZFN, TALEN, and Cas9. Mol Ther 2019, 27(4):735-746.
5. Cheng Q, Wei T, Jia Y, Farbiak L, Zhou K, Zhang S, Wei Y, Zhu H, Siegwart DJ: Dendrimer-Based Lipid Nanoparticles Deliver Therapeutic FAH mRNA to Normalize Liver Function and Extend Survival in a Mouse Model of Hepatorenal Tyrosinemia Type I. Adv Mater 2018, 30(52):e1805308.
6. Qiu M, Tang Y, Chen J, Muriph R, Ye Z, Huang C, Evans J, Henske EP, Xu Q: Lung-selective mRNA delivery of synthetic lipid nanoparticles for the treatment of pulmonary lymphangioleiomyomatosis. Proc Natl Acad Sci U S A 2022, 119(8):e2116271119.
7. Tenzer S, Docter D, Kuharev J, Musyanovych A, Fetz V, Hecht R, Schlenk F, Fischer D, Kiouptsi K, Reinhardt C: Rapid formation of plasma protein corona critically affects nanoparticle pathophysiology. Nat Nanotechnol 2013, 8(10):772-81.
8. Qiu M, Glass Z, Chen J, Haas M, Jin X, Zhao X, Rui X, Ye Z, Li Y, Zhang F et al: Lipid nanoparticle-mediated codelivery of Cas9 mRNA and single-guide RNA achieves liver-specific in vivo genome editing of Angptl3. Proc Natl Acad Sci U S A 2021, 118(10):e2020401118.



