技术分享:tTARGIT AAVs系统助力特定神经元研究
Tips:关于位点特异性重组酶(SSR),我们在“一个集合Vika、Flp、Dre和Cre重组系统的报告基因小鼠模型”技术分享中已经介绍了四种SSR系统的联用。关于AAV,我们在“心房特异性的AAV9递送系统”技术分享中介绍了通过设计特定载体,实现AAV9的心房特异性基因递送。本期我们将详细介绍设计联用两种SSR系统与Tet-off系统,并借助AAV原位注射系统进行基因递送,以实现特定神经元的特异性标记与功能研究。
位点特异性重组酶(SSR)是一类具有催化活性,能够特异性识别DNA序列,实现位点特异性重组的基因操作工具。其中Cre、Flp和Dre系统最为常用,在基因工程中发挥着关键作用。Tet-off系统中当四环素不存在时,tTA可结合到TRE启动子上,驱动下游目的基因表达;而当四环素存在时,tTA构象发生改变并从TRE启动子上脱落,从而关闭下游目的基因表达。组合联用SSR系统与Tet-off系统,可实现更为精准的基因操作,用于各种生命科学研究。
2021年3月,eLife上发表了一种双重重组酶依赖激活基因表达的系统——tTARGIT AAVs系统,以实现更加精确地遗传靶向特定神经元细胞亚群,及其功能研究[1]。该系统利用腺相关病毒(AAV)来进行基因递送,包含Driver AAV和Payload AAV两种AAV载体。其中Driver AAV为组织特异性启动子驱动表达的Flp依赖双floxed倒置tTA,而Payload AAV为TRE启动子驱动表达的Cre依赖双floxed倒置目的基因(图一a)。当不存在四环素时,Flp可识别重组Driver AAV的双floxed序列使得tTA翻转回正向,从而在组织特异性启动子的驱动下表达tTA;同时,Cre可识别重组Payload AAV的双floxed序列使得目的基因翻转回正向,在表达tTA的特定组织细胞中tTA结合TRE启动子,驱动下游目的基因的表达(图一a)。因此,这套tTARGIT AAVs系统需要Driver AAV、Payload AAV、Flp和Cre这四要素的同时存在,目的基因才能稳定表达。并且加入四环素,可关闭目的基因表达。
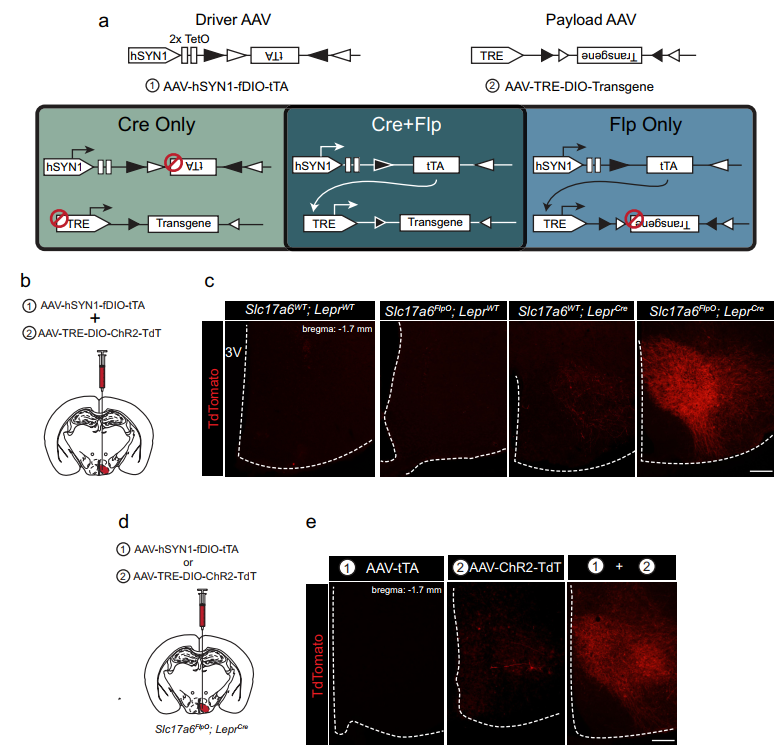
图一 tTARGIT AAVs系统的工作原理与LepRbVMH神经元标记测试[1]
研究者利用tTARGIT AAVs系统来测试标记特定神经元细胞亚群。瘦素(Leptin)是一种由脂肪组织分泌的肽类激素,作用于瘦素受体(LepR)。LepR在下丘脑中表达,其中表达瘦素受体b(LepRb)的神经元介导瘦素调控的大部分功能。表达LepRb的神经元多位于下丘脑的核团中,包括弓状核(ARC)、背内侧核(DMH)、腹内侧核(VMH)、下丘脑外侧区(LHA)和腹侧前乳头核(PMv)。下丘脑腹内侧核LepRb (LepRbVMH)神经元可通过调控摄食量来控制能量平衡[2, 3]。由于其密度高且临近弓状核、背内侧和外侧区域,LepRbVMH神经元不能简单用LeprCre小鼠进行标记研究。另外,Slc17a6主要表达在LepRbVMH神经元中,且在周围的LepRb神经元中大多不表达[4]。之前有报道利用Slc17a6FlpO、LeprCre、Flp和Cre依赖的Rosa26RCFL-eGFP-L10a报告小鼠、或者INTRSECT AAV系统[5]来标记LepRbVMH神经元,但是这些系统仍然缺乏特异性和敏感性。因此,研究者选择LepRbVMH神经元来进行tTARGIT AAVs系统的标记测试。
首先,研究者构建了人源synapsin I (hSYN1)启动子驱动的Driver AAV-hSYN1-fDIO-tTA,和表达ChR2-TdTomato的Payload AAV-TRE-DIO-ChR2-TdT。并将这两种AAVs分别原位注射到野生型、Slc17a6FlpO、LeprCre以及Slc17a6FlpO;LeprCre小鼠的VMH区,免疫荧光结果显示只有Slc17a6FlpO;LeprCre小鼠的VMH区有很强的红色荧光信号(图一b和c);且只有共同注射两种AAVs才有强信号(图一d和e)。
接下来,研究者利用tTARGIT AAVs系统来定位LepRbVMH神经元的神经投射。构建了Payload AAV-TRE-DIO-GFP-2A-SynmRuby,用于表达GFP以及Synaptophysin-mRuby融合蛋白(图二a)。Synaptophysin蛋白是突触标志物,定位于突触囊泡上,与mRuby融合后可用红光进行检测。但由于红光信号不强,研究者直接观察GFP绿色荧光标记的LepRbVMH神经元的神经投射。将Payload AAV和Driver AAV共同原位注射到Slc17a6FlpO;LeprCre小鼠的VMH区(图二a),可观察到VMH区的强GFP绿色荧光信号(图二b),并且GFP标记的LepRbVMH神经元可以投射至中枢神经中的导水管周围灰质(PAG)、弓状核(ARC)、丘脑室旁核(PVT)、下丘脑室旁核(PVN)、终纹床核(BNST)和视前区(POA)(图二c和d)。这与已知的VMH神经投射结果一致[6-8]。
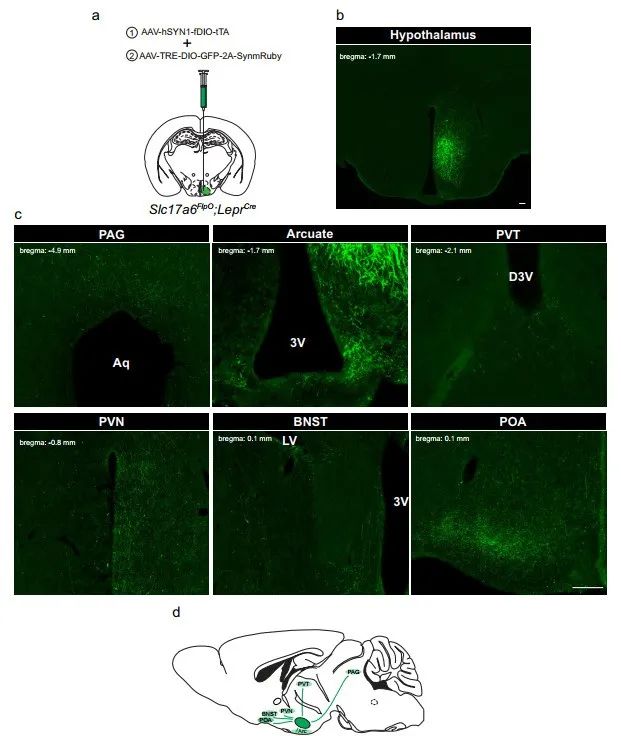
图二 利用tTARGIT AAVs系统定位LepRbVMH神经元的神经投射[1]
最后,研究者进一步研究LepRbVMH神经元对饮食代谢的功能影响,构建了表达hM3Dq-mCherry的Payload AAV-TRE-DIO-hM3Dq-mCherry。其中hM3Dq是DREADD系统的人工设计蛋白受体,可特异性被人工设计药物CNO激活,进而激活神经元。将Payload AAV与Driver AAV共同原位注射到Slc17a6FlpO;LeprCre小鼠的VMH区(图三a),可检测到VMH区的hM3Dq-mCherry红光荧光强信号(图三b)。当用CNO激活后,可特异性在VMH区中检测到mCherry和神经元激活标志物FOS的表达共定位,表明LepRbVMH神经元被特异性激活(图三c和d)。研究者将小鼠饲养于代谢笼中,每天喂食两次CNO,观测LepRbVMH神经元的激活对小鼠的能量消耗、活动与摄食的影响(图三e-j)。结果显示,当CNO激活LepRbVMH神经元后,小鼠的24小时耗氧量 (VO2) 和能量消耗均显著增加(图三e和h),而夜间活动、食物摄取量和日间呼吸交换率均显著减少(图三g,i和j)。为了解棕色脂肪组织 (BAT)在此过程中是否起作用,研究者在小鼠肩胛上放置了温度探头以监测BAT的产热情况。发现当CNO激活LepRbVMH神经元后,小鼠的肩胛温度显著增加(图三k和l)。表明LepRbVMH神经元激活后,可部分通过增加BAT产热来促进能量消耗,进一步证明了LepRbVMH神经元对机体能量平衡的重要调节作用。
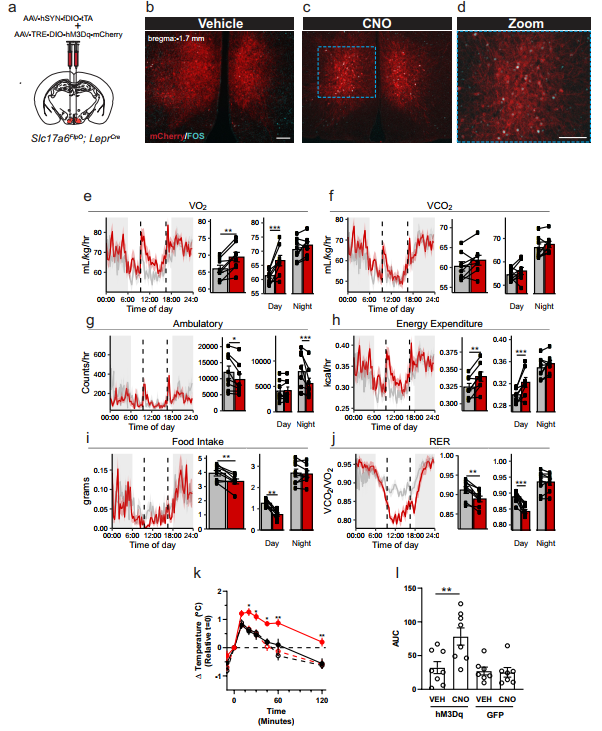
图三 LpRbVMH神经元的激活对小鼠饮食与能量代谢的影响[1]
综上所述,利用双重重组酶依赖激活基因表达的tTARGIT AAVs系统可精准操纵LepRbVMH神经元,并用于中枢神经系统中特定细胞亚群的功能研究。此外,研究者还扩展了一系列用于条件性开启或关闭基因表达的tTARGIT AAVs工具包(表一)。其中Driver AVV分为表达tTA和rtTA两种,前者为Tet-off系统,表达无需加药;后者为Tet-on系统,需要在加药情况下才能激活表达。而Payload AAV根据目标基因序列的方向可分为Flp-ON/Cre-ON和Flp-ON/Cre-OFF两类。这些工具包的灵活使用极大丰富了生物医学研究技术,科学家可根据目标研究基因和具体研究对象选择不同组合的tTARGIT AAVs系统。
表一 可用的tTARGIT AAVs系统工具包[1]

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂的调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Sabatini PV, Wang J, Rupp AC, Affinati AH, Myers MG: tTARGIT AAVs mediate the sensitive and flexible manipulation of intersectional neuronal populations in mice. eLife Sciences 2021, 10:e66835.
2. Bingham NC, Anderson KK, Reuter AL, Stallings NR, Parker KL: Selective loss of leptin receptors in the ventromedial hypothalamic nucleus results in increased adiposity and a metabolic syndrome. Endocrinology 2008, 149(5):2138-2148.
3. Dhillon H, Zigman JM, Ye C, Lee CE, McGovern RA, Tang V, Kenny CD, Christiansen LM, White RD, Edelstein EA et al: Leptin directly activates SF1 neurons in the VMH, and this action by leptin is required for normal body-weight homeostasis. Neuron 2006, 49(2):191-203.
4. Vong L, Ye C, Yang Z, Choi B, Chua S, Jr., Lowell BB: Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron 2011, 71(1):142-154.
5. Fenno LE, Mattis J, Ramakrishnan C, Hyun M, Lee SY, He M, Tucciarone J, Selimbeyoglu A, Berndt A, Grosenick L et al: Targeting cells with single vectors using multiple-feature Boolean logic. Nature methods 2014, 11(7):763-772.
6. Canteras NS, Simerly RB, Swanson LW: Organization of projections from the ventromedial nucleus of the hypothalamus: a Phaseolus vulgaris-leucoagglutinin study in the rat. The Journal of comparative neurology 1994, 348(1):41-79.
7. Zhang J, Chen D, Sweeney P, Yang Y: An excitatory ventromedial hypothalamus to paraventricular thalamus circuit that suppresses food intake. 2020, 11(1):6326.
8. Meek TH, Nelson JT, Matsen ME, Dorfman MD, Guyenet SJ, Damian V, Allison MB, Scarlett JM, Nguyen HT, Thaler JP et al: Functional identification of a neurocircuit regulating blood glucose. Proceedings of the National Academy of Sciences of the United States of America 2016, 113(14):E2073-2082.



