技术分享:ODInCas9系统在临床前药物研发中的应用
Tips:在“新型调控sgRNA活性的CRISPR-Switch系统”技术分享中我们介绍了利用调控sgRNA来实现对CRISPR-Cas9系统的调控,本期将分享调控Cas9在临床前药物研发中的应用。另外,在上期“大片段DNA高效插入的基因编辑工具FiCAT”技术分享中我们介绍了一种结合CRISPR-Cas9和PiggyBac系统的新型基因编辑工具FiCAT,本期将分享利用ZFN来实现大片段DNA在基因组上的定点插入。
CRISPR-Cas9基因编辑技术是一种高效的基因组编辑工具,是由人工设计的sgRNA识别目的基因组序列,并引导Cas9蛋白酶对靶向基因组DNA进行有效切割,形成DNA双链断裂,损伤后修复可造成基因敲除或敲入等,从而实现对基因组DNA的定向改造。2020年9月,Nature Communication上报道了一种ODInCas9(ObLiGaRe Doxycycline Inducible Cas9)系统,可在基因组上定点插入Tet-on Cas9元件,快速构建由强力霉素(Dox)诱导调控Cas9表达的工具细胞和工具小鼠,从而用于临床前的药物筛选与研究[1]。
研究者将Tet-on系统所需的两个调控元件TRE-Cas9-T2a-EmGFP和CAG-rtTA,与药筛元件PKG-Neo共同设计在一个质粒上,整个质粒共18 kb。其中,采用的是Tet-on 3G系统,并利用绝缘子Ins将TRE启动子元件与其他两个元件区隔开,使其更好地响应Dox的诱导,避免Tet-on系统的泄露(图一b)。研究者在前期工作中已开发了ObLiGaRe(Obligate Ligation-Gated Recombination)系统,利用基因编辑工具锌指核酸酶(ZFN)来介导大片段DNA(15 kb)的基因组定点插入,是由DNA损伤修复的非同源末端连接(NHEJ)来介导完成的[2]。因此,在本研究中同样选择ObLiGaRe系统来定点插入Tet-on Cas9的转基因元件ODInCas9,利用ZFN介导的靶位点双链DNA断裂来插入ODInCas9元件(图一b)。
确定好构建方案后,研究者首先构建ODInCas9工具细胞,分别在肝细胞HepG2、肾细胞HEK293、神经细胞N2a、肺细胞A549、结肠细胞HCT116、卵巢细胞OVCAR8和人诱导多能干细胞(hiPSC)中测试ODInCas9系统(图一a)。将ODInCas9质粒和ZFN靶向质粒(AAVS1或ROSA26位点)瞬转入细胞,1-2周后筛选出新霉素耐受的阳性细胞群;再利用流式分选单细胞到384孔板内,加入Dox进行Tet-on诱导,从而挑选出GFP阳性的单克隆细胞系。整个流程共计2-6周即可构建出ODInCas9细胞株(图一c)。ODInCas9细胞严格响应Dox的诱导表达,其中GFP指示Cas9的表达情况(图一d和e);导入sgRNA后可检测到Cas9介导的高效靶向性切割(图一f)。
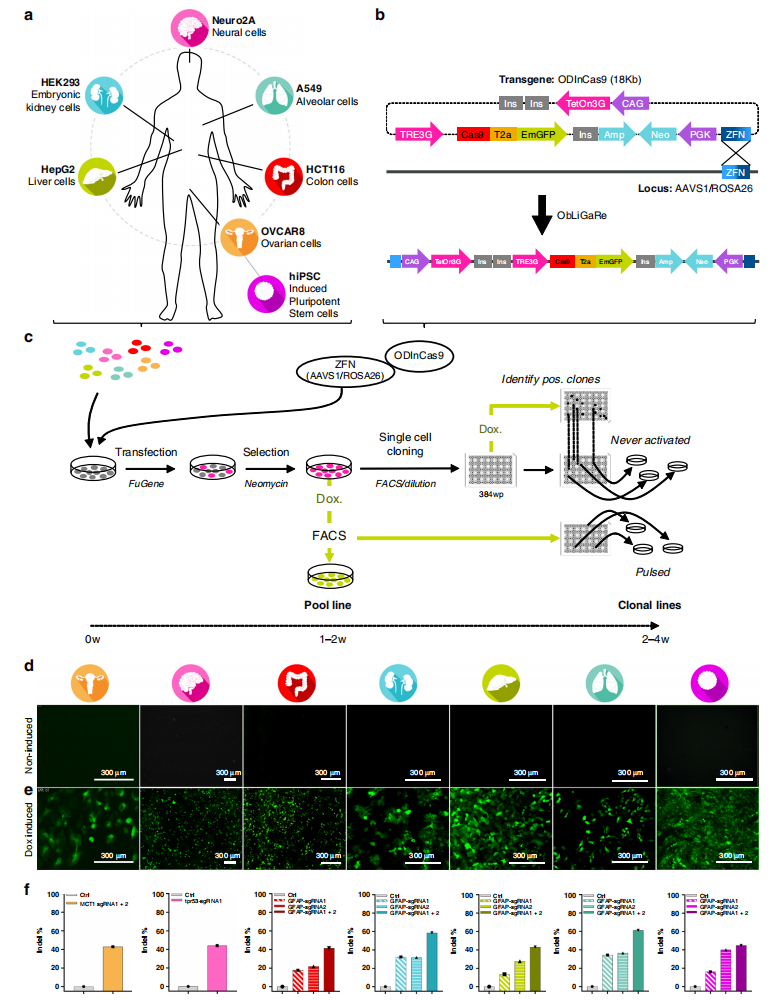
图一ODInCas9工具细胞的构建与测试[1]
随后研究者构建ODInCas9工具小鼠。首先,在小鼠胚胎干细胞(mESC)上的Rosa26位点进行打靶,获得的ODInCas9 mESC加Dox后可观察到GFP和Cas9的诱导表达(图二a和b)。然后,将ODInCas9 mESC进行囊胚注射,获得嵌合小鼠,再通过与野生型小鼠交配获得生殖系遗传的ODInCas9小鼠(图二c)。ODInCas9杂合小鼠喂食Dox 24 h后,可检测到各器官开始表达GFP(图二g);喂食Dox 72 h后各器官的GFP表达增强(图二d和e)。ODInCas9纯合小鼠相较杂合小鼠的表达效果更佳(图二f和h)。对ODInCas9杂合小鼠进行Dox给药、撤药以及三周后再给药的处理,可检测到GFP表达的开启和关闭严格响应Dox的诱导(图二i)。值得注意的是,GFP在脑和睾丸的诱导表达量并不高。
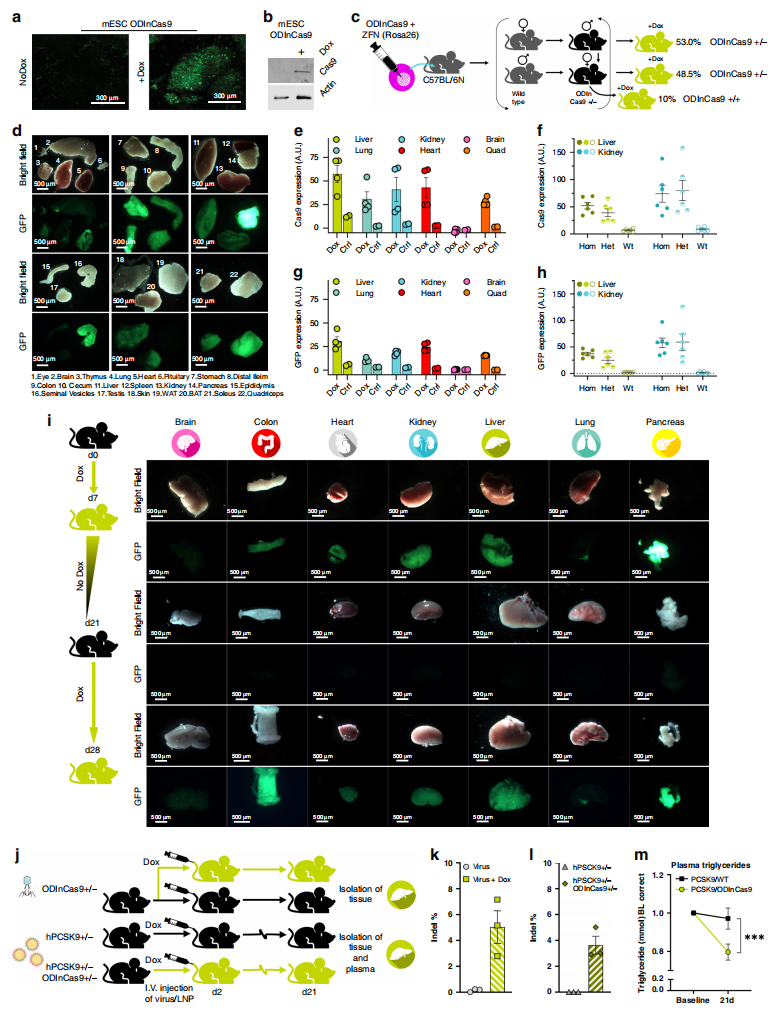
图二ODInCas9工具小鼠的构建与测试[1]
研究者进一步测试ODInCas9工具小鼠的基因编辑能力。利用尾静脉注射AAV9来递送靶向Trp53的sgRNA(图二j,上图),小鼠喂食Dox后可在肝脏中检测到Cas9介导的高效靶向性切割(图二k)。另外,将ODInCas9小鼠与肝脏过表达人源hPCSK9的高胆固醇血症小鼠进行杂交,利用尾静脉注射脂质纳米颗粒(LNP)来递送靶向PCSK9的sgRNA(图二j,下图),小鼠喂食Dox后可在肝脏中检测到Cas9介导的PCSK9高效切割,进而显著性降低20%的血浆甘油三酯水平(图二l和m)。以上结果表明在ODInCas9工具小鼠中,Cas9的表达严格响应Dox的诱导调控,没有出现系统泄露。
接着,研究者利用ODInCas9工具小鼠来进行复杂基因型的肿瘤模型造模,模拟KrasG12D;Trp53−/−,KrasG12C;Trp53−/− 和KrasG12D;Stk11−/−三种基因型的非小细胞肺癌(NSCLC)模型。研究者选择AAV9递送系统来进行造模,AAV载体包含靶向Kras,Trp53/ Stk11的sgRNA,以及KrasG12C/D点突变的同源修复打靶序列(HDR template)。ODInCas9小鼠喂食Dox三天后,将AAV9采用口咽抽吸法经咽部注入气管,再喂食Dox一天后撤药,观察NSCLC的发生发展(图三a)。ODInCas9小鼠在AAV9造模3周后开始出现Ⅰ级和Ⅱ级支气管肺泡腺瘤,并逐步发展至Ⅲ级和Ⅳ级腺瘤(图三b)。在NSCLC造模的肿瘤建系细胞(图三c)和原位肿瘤(图三d和e)中都能检测到Trp53和Stk11的KO,以及KrasG12C/D点突变的正确基因型(图三e和f)。以上结果表明ODInCas9工具小鼠结合AAV高效递送系统,可以快速构建复杂基因型的原位肿瘤模型。
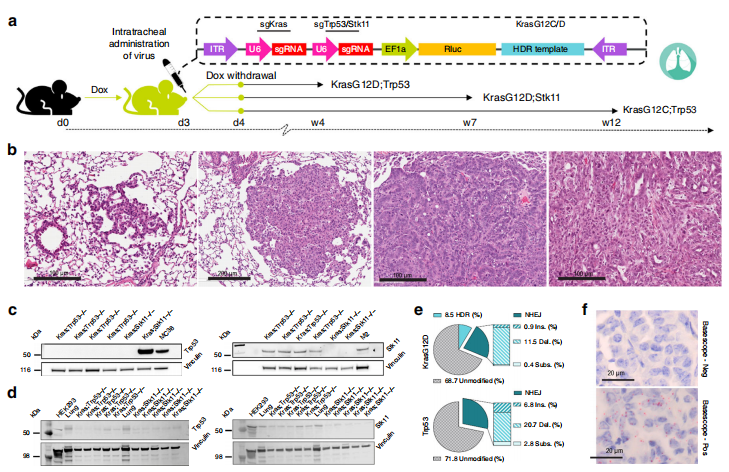
图三 ODInCas9工具小鼠的非小细胞肺癌造模[1]
最后,研究者利用ODInCas9小鼠的原位NSCLC模型,来进行临床前体内药效评价。在ODInCas9小鼠上利用AAV9递送KrasG12D;Trp53−/−基因型造模4周后,开始进行2周的紫杉醇和司美替尼(AZD6244,MEK抑制剂)联合治疗(图四a),可观察到联合治疗组能有效阻滞肿瘤进展,并显著降低肿瘤的肺占位比例(图四b-f)。
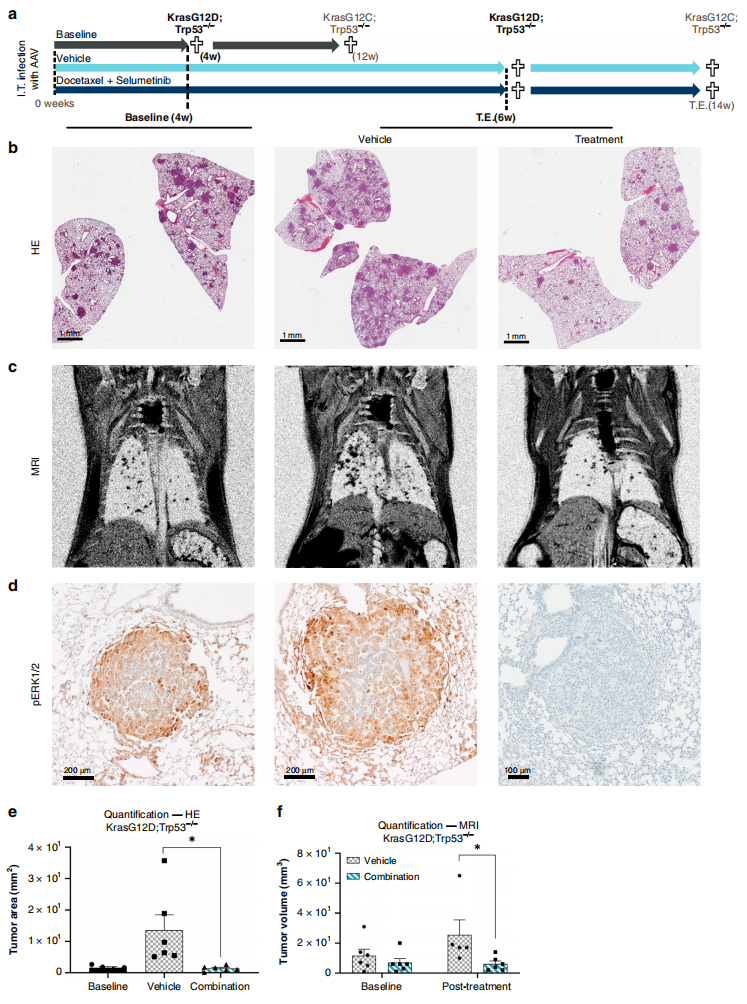
图四 利用ODInCas9小鼠的原位NSCLC模型进行临床前体内药效评价[1]
综上所述,ODInCas9系统提供了一个短时高效、可重复的精准调控基因工程开发平台。可快速构建ODInCas9工具细胞系(2周),并进行基因KO等,用于疾病靶标的筛选和验证。此外,ODInCas9工具小鼠结合AAV高效递送系统,可快速便捷地构建多种复杂基因型的原位肿瘤模型,降低研发时间与成本,广泛应用于临床前的药效评价与研究。

GTP研发中心已制备完成Gt(ROSA)26Sortm3(tetO-Flag-Cas9)小鼠(GTP ID: G-21000010),在安全位点Gt(ROSA)26Sor中敲入tetO-Flag-Cas9元件(图五)。该小鼠与组织特异的rtTA小鼠交配后,喂食Dox可实现时空特异的Tet-On诱导Flag-Cas9的表达,其中Flag标签蛋白可指示Cas9的过表达情况与蛋白定位。该小鼠同样采用Tet-on 3G系统,并利用绝缘子Ins将TRE启动子元件区隔开,可有效避免Tet-on系统的泄露。
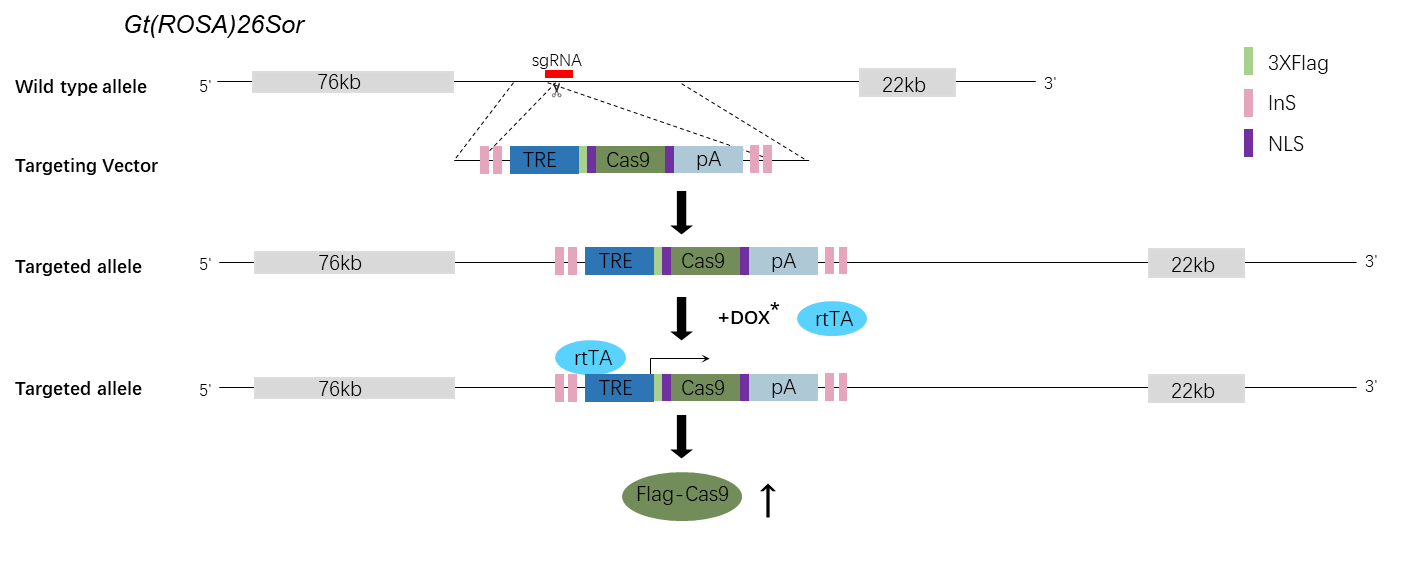
图五 GTP研发中心的Gt(ROSA)26Sortm3(tetO-Flag-Cas9)小鼠构建策略

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。
如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Lundin A, Porritt MJ, Jaiswal H, Seeliger F, Maresca M: Development of an ObLiGaRe Doxycycline Inducible Cas9 system for pre-clinical cancer drug discovery. Nature Communications 2020, 11(1).
2. Maresca M, Lin VG, Guo N, Yang Y: Obligate Ligation-Gated Recombination (ObLiGaRe): Custom-designed nuclease-mediated targeted integration through nonhomologous end joining. Genome research 2013, 23(3):539-546.

