技术分享:大片段DNA高效插入的基因编辑工具FiCAT
Tips:在“出乎意料”的基因编辑错误技术分享中,我们介绍了由于精准修复失败出现多拷贝串联的 “意外”基因编辑错误,需要引起科学家们的注意,以免获得假阳性的基因改造小鼠。本期将分享新型基因编辑工具FiCAT,看它如何提升大片段DNA的插入效率,从而更精准高效地运用于基因治疗等领域。
实现精准基因编辑需要三个关键步骤:精准识别、精准切割和精准修复。CRISPR-Cas9技术在实现精准基因编辑的前两项——精准识别和精准切割过程中表现优异,而其中第三项的精准修复是由细胞自行选择DNA损伤修复机制来完成的,主要包括同源修复(HR)与非同源末端连接(NHEJ)修复等[1]。细胞启用不同修复机制会产生不同编辑产物,HR修复机制最为精准,在接头处两端不会引入任何突变,但是修复效率低,其中又以外源大片段DNA插入的效率最低。通常编辑完成后,科学家们能从中筛选出精准基因编辑的产物用于后续研究实验即可,大多可以接受HR效率低的问题。但是在临床应用方面,以基因治疗为例,一些起治疗作用的功能蛋白质往往具有基因尺寸较大的问题,此时的低效率不能使得病人获益,成为一项亟需解决的技术瓶颈。
此外,现常用的基因治疗载体主要分为病毒载体和非病毒载体两种类型。病毒载体中,慢病毒(LV)的目的片段装载空间约为6.4 kb,并且存在基因组随机整合的风险;而安全性较高的腺相关病毒(AAV)虽然不整合基因组,但是装载空间仅为4.2 kb左右,因此表达外源大片段DNA时无法通过病毒载体实现高效递送。而非病毒载体主要包括裸露DNA、脂质体、纳米载体等,虽然具有成本低、制备简单、外源基因长度不受限制等优点,但是存在体内转染效率不高,表达时间短等缺陷,仍然需要不断改进。其中PiggyBac(PB)载体系统的装载空间预计达到27 kb,可满足各种外源基因表达的需求,并且该系统可将外源大片段DNA高效整合到宿主基因组的TTAA位点中。
因此,倘若将CRISPR-Cas9的精准识别能力与PB系统的大片段DNA基因组整合能力相结合,能否开发出一种用于大片段DNA定点插入基因组的高效基因编辑工具呢?2021年12月,Nature Communications杂志报导了新型FiCAT(Find and cut-and-transfer)基因编辑工具,利用CRISPR-Cas9系统作为基因组位点的识别和切割模块,PB系统作为供体序列的剪切和转移模块,二者结合进行定向筛选,获得了高效定点插入大片段DNA的基因编辑工具,具有广阔的应用前景[2]。
研究者首先建立了一种报告细胞,用于筛选作用元件的组合方式。在HEK293T细胞的基因组安全位点AAVS1或TRAC位点(Target靶位点)插入Target-2/2intron-SA-2/2emGFP元件,即携带部分内含子、剪接受体(SA)和部分GFP荧光蛋白序列。打靶的供体DNA序列设计为ITR-pCAG-1/2emGFP-SD-1/2intron-ITR,即携带PB转座酶识别的两个ITR、启动子、部分GFP、剪接供体(SD)和部分内含子序列。当Cas9-PB融合蛋白能发挥功能时,可响应sgRNA的识别功能,将Cas9-PB蛋白带到靶位点上,再由PB转座酶剪切和转移供体DNA序列,实现供体DNA的基因组定点插入。该报告系统只有当供体DNA正确插入到靶位点上,才能正确剪接启动GFP的表达(图一a)。PB的基因组插入总体效率由红色荧光蛋白(RFP)对照供体序列来评价,即当对照供体序列随机插入基因组后细胞都会表达RFP。

图一 基于Cas9和PB转座酶的FiCAT开发[2]
研究者利用上述报告细胞进行筛选,将不同的Cas9蛋白与PB转座酶进行组合,发现与dCas9和nCas9相比,仅有Cas9在N端与PB转座酶在C端的融合蛋白,即Cas9-PB才有较高比例的GFP阳性细胞产生,从而表示Cas9对靶位点的双链DNA切割能有效提高靶位点的正确插入。不过目前的系统始终有高比例非靶位点的插入(图一b)。由此,研究者进一步突变PB转座酶,一边通过降低其DNA结合活性,来减少供体序列在非靶位点的插入;另一边通过提高其对供体序列的剪切能力,来提高靶位点的插入。研究者发现PB突变体的靶位点插入效率均显著提高(图一c和一d)。同时,研究者进一步证明了PB及其突变体介导的靶位点插入依赖于Cas9介导的双链DNA切割(图一e)。
研究者展示了FiCAT系统(R372A_K375A_D450N)的靶位点插入不依赖TTAA基序的要求,尽管在靶位点两侧会引入一定的突变序列(图二a)。FiCAT系统能响应sgRNA的导向在基因组上表现为靶位点定点插入,具有位点特异性(图二b),并且对于大片段DNA的插入具有显著性优势(图二c)。
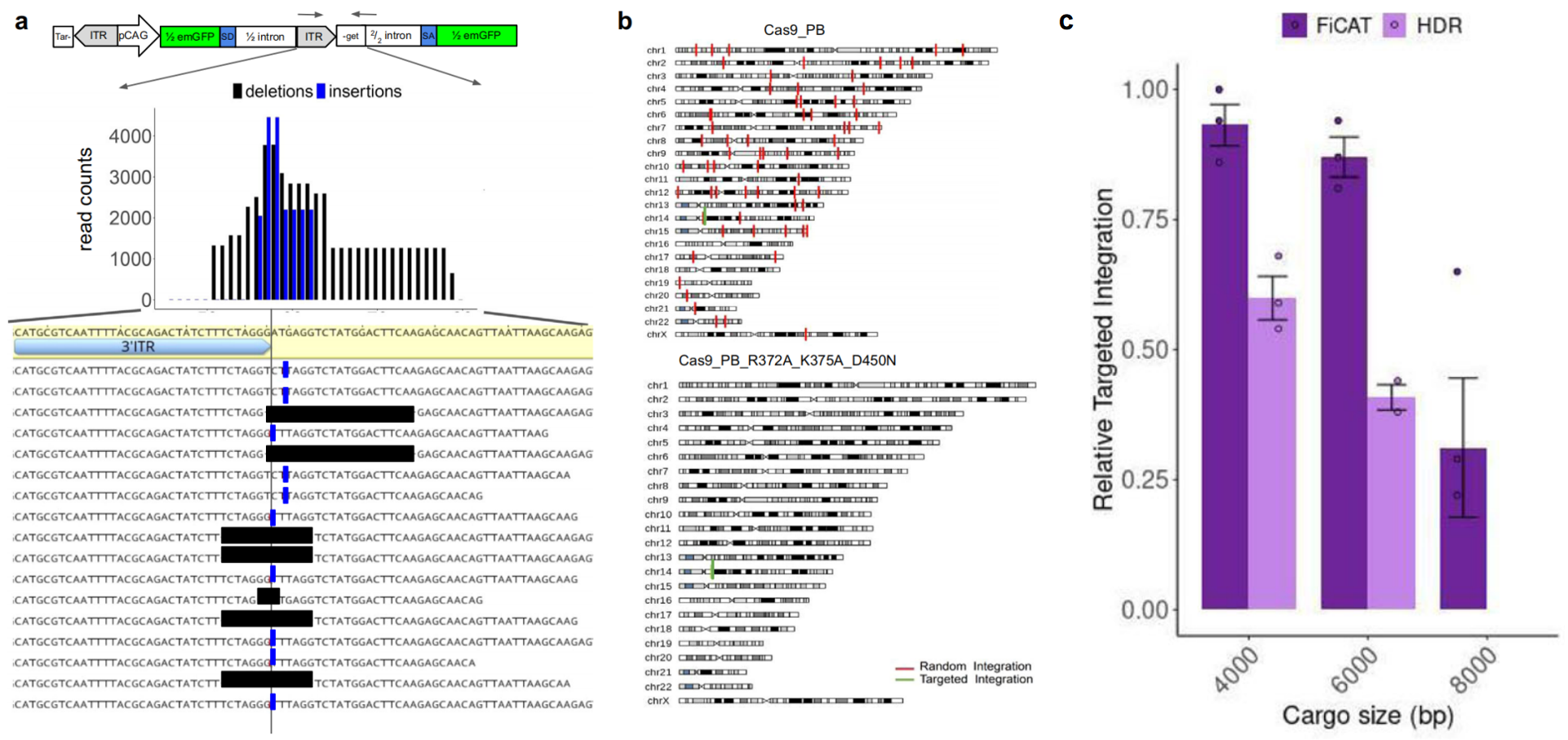
图二 FiCAT系统的基因组定点插入和大片段DNA传递优势[2]
接下来,研究者进一步在其他哺乳动物细胞和小鼠体内来测试FiCAT系统。在C2C12小鼠成肌细胞中靶向Lama2基因插入RFP,FiCAT系统(R372A_K375A_D450N)的阳性打靶效率约为20%(图三a-d)。体内实验中,通过高压水动力法注射FiCAT系统(R372A_K375A_D450N),可在小鼠肝脏中检测到高拷贝的靶向Rosa26位点的RFP表达(图三e),并且靶向Rosa26位点的荧光素酶在注射5周后相较对照组表达更为稳定持久(图三f),PCR也能检测到FiCAT系统介导的基因组定点插入(图三g)。
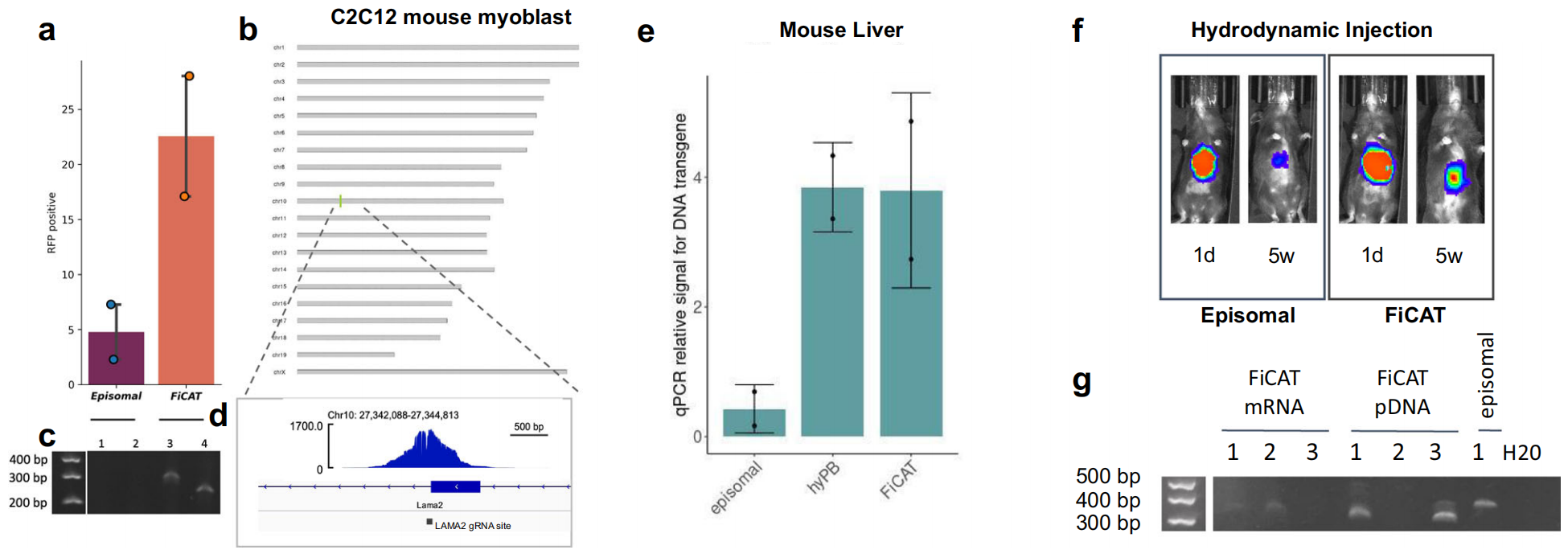
图三 FiCAT系统在其他哺乳动物细胞和小鼠体内测试[2]
最后,研究者继续突变PB进行定向筛选,生成了394,000个变体,最终筛选出靶向效率达25-30%的FiCAT基因编辑工具。利用FiCAT可在哺乳动物细胞或小鼠体内的基因组中高效定点插入长达上千碱基的大片段DNA,进一步推动基因治疗等领域的发展。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Sander JD, Joung JK: CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol 2014, 32(4):347-355.
2. Pallares-Masmitja M, Ivancic D, Mir-Pedrol J, Jaraba-Wallace J, Tagliani T, Oliva B, Rahmeh A, Sanchez-Mejias A, Guell M: Find and cut-and-transfer (FiCAT) mammalian genome engineering. Nat Commun 2021, 12(1).

