技术分享:新型调控sgRNA活性的CRISPR-Switch系统
CRISPR-Cas9基因编辑技术是一种高效的基因组编辑工具,是由人工设计的sgRNA识别目的基因组序列,并引导Cas9蛋白酶对靶向基因组DNA进行有效切割,形成DNA双链断裂,损伤后修复可造成基因敲除或敲入等,从而实现对基因组DNA的定向改造。一些特定的CRISPR-Cas9应用需要严格时空调控,如条件性基因破坏、重要基因表型分析和sgRNA文库筛选等。因此,一些通过诱导Cas9核酸酶和sgRNA的表达来实现对靶基因精准调控的方法被开发出来[1, 2]。例如利用光或小分子时空激活修饰型或分割型Cas9[3, 4],但这类系统由于调控元件复杂常常会导致DNA编辑效率降低。然而常用的诱导效率高的方法如强力霉素(DOX)诱导调控Cas9核酸酶或sgRNA表达的系统,容易出现系统泄漏问题。
2019年11月,Nature Communication上发表了一种新型CRISPR-Switch(SgRNA With Induction/Termination by Cre Homologous recombination)系统,结合Cre重组酶系统的高效性来严格调控sgRNA的表达或终止,从而实现对sgRNA表达的精准调控[5]。文中一共介绍了CRISPR-Switch-ON、CRISPR-Switch-OFF和CRISPR-Switch-OVER 3种系统。
首先是CRISPR-Switch-ON系统,结合Cre或Flp重组酶系统来实现sgRNA开启表达(图一)。该系统在sgRNA表达载体的crRNA和tracrRNA序列之间插入loxP/FRT-poly T-loxP/FRT序列。正常情况下由于poly-U的转录导致sgRNA转录提前中止而被降解;但是在转入Cre或Flp重组酶后,poly T序列被切割,仅剩下单个loxP或FRT序列,并且该序列不影响sgRNA的转录,从而开启sgRNA的表达(图一a)。在持续性过表达EGFP蛋白质的小鼠胚胎干细胞系(mESC)中测试该系统,在不导入Cre或Flp重组酶时,该系统基本不泄露(图一b)。导入Cre或Flp重组酶后,靶向EGFP序列的sgRNA表达被开启,从而破坏EGFP蛋白质的表达。值得注意的是,Cre重组酶系统具有延迟性,但不影响最终整体效果;而Flp重组酶系统没有延迟问题(图一c)。
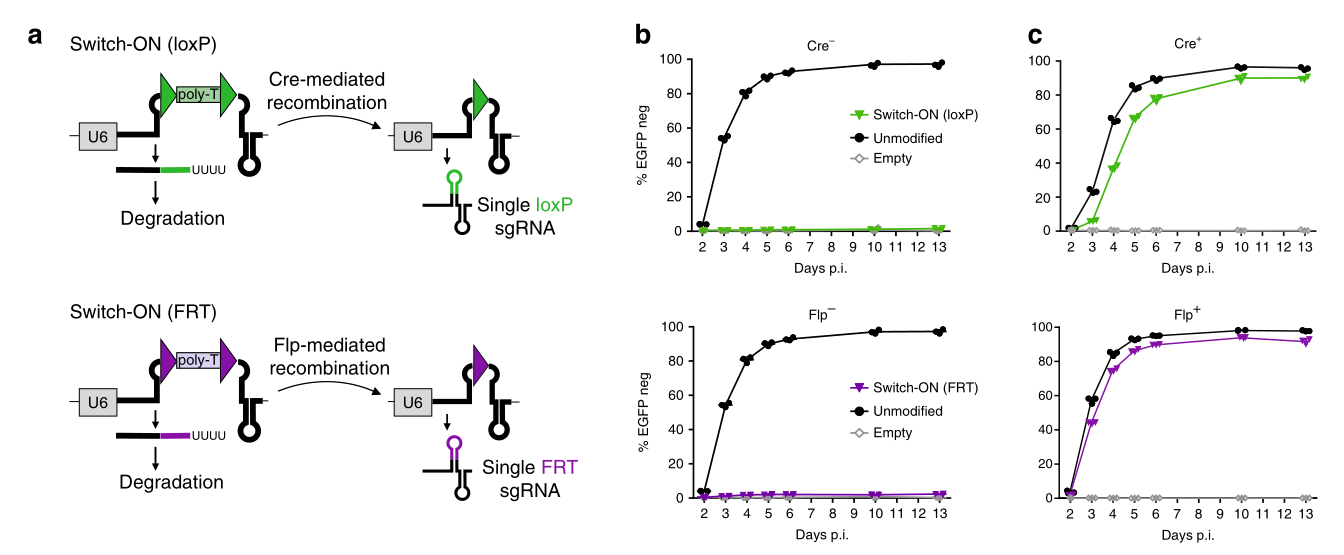
图一 CRISPR-Switch-ON系统[5]
其次是CRISPR-Switch-OFF系统,同样结合Cre重组酶系统来实现sgRNA表达的关闭(图二)。该系统在sgRNA表达载体的crRNA和tracrRNA序列之间,以及sgRNA终止密码子的下游分别插入一个loxP序列。正常情况下sgRNA持续性表达;但是在转入Cre重组酶后,sgRNA序列被切割,从而关闭sgRNA的表达(图二a)。在持续性过表达EGFP蛋白质的小鼠胚胎干细胞系(mESC)中测试该系统,在不导入Cre重组酶时,靶向EGFP序列的sgRNA持续表达,持续性破坏EGFP蛋白质的表达(图二b左图)。导入Cre重组酶后,sgRNA序列被破坏,EGFP蛋白质的表达不受影响(图二b右图)。
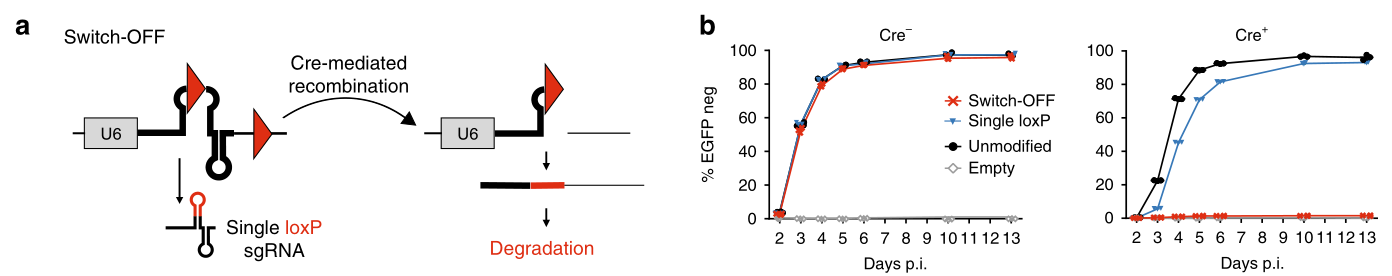
图二 CRISPR-Switch-ON系统[5]
最后是CRISPR-Switch-OVER系统,是将CRISPR-Switch-ON/OFF两个系统进行结合,从而实现对2个sgRNA表达的顺序调控(图三)。该系统带有2个sgRNA靶向序列,在sgRNA1(蓝色)的crRNA和tracrRNA序列之间插入一个loxP序列,在sgRNA2(紫色)的crRNA后插入loxP-poly T-blasti-mU6-sgRNA1-loxP序列。正常情况下sgRNA1在mU6的启动下持续性表达;但是在转入Cre重组酶后,sgRNA1序列被切除并被重新拼接成有功能的sgRNA2,启动sgRNA2的表达,从而实现对两个基因位点的顺序调控。这种顺序表达两个sgRNA的方式可能优于同时表达两个sgRNA,既避免了不同sgRNA与Cas9蛋白酶的竞争性结合,又可作为有效的系统对照组。
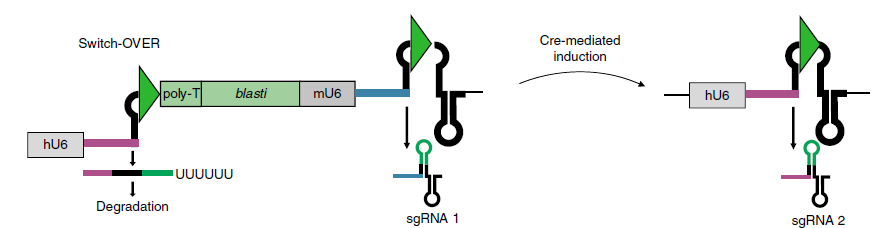
图三 CRISPR-Switch-OVER系统[5]
本期分享的调控sgRNA活性的CRISPR-Switch系统可以精确快速地开启或关闭sgRNA的表达,以及切换成第二个sgRNA的表达,丰富了CRISPR-Cas9基因编辑系统的调控方式,满足不同实验需求。该系统可与Cre或CreERT2的小鼠模型连用,实现在体多元化基因调控。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Nihongaki Y, Otabe T, Sato M: Emerging Approaches for Spatiotemporal Control of Targeted Genome with Inducible CRISPR-Cas9. Anal Chem 2018, 90(1):429-439.
2. Dai XF, Chen X, Fang QW, Li J, Bai ZH: Inducible CRISPR genome-editing tool: classifications and future trends. Crit Rev Biotechnol 2018, 38(4):573-586.
3. Zhou XX, Zou XZ, Chung HYK, Gao YC, Liu YX, Qi LS, Lin MZ: A Single-Chain Photoswitchable CRISPR-Cas9 Architecture for Light-Inducible Gene Editing and Transcription. Acs Chem Biol 2018, 13(2):443-448.
4. Nunez JK, Harrington LB, Doudna JA: Chemical and Biophysical Modulation of Cas9 for Tunable Genome Engineering. Acs Chem Biol 2016, 11(3):681-688.
5. Chylinski K, Hubmann M, Hanna RE, Yanchus C, Michlits G, Uijttewaal ECH, Doench J, Schramek D, Elling U: CRISPR-Switch regulates sgRNA activity by Cre recombination for sequential editing of two loci. Nature communications 2019, 10.

