技术分享:光遗传学红光/远红光精准调控新工具的开发与应用
Tips:在前期技术分享“远红外诱导调控的分割型Cre-loxP重组酶系统”中,我们介绍了利用光敏蛋白BphS系统的改进与应用;在“蓝光诱导调控的Cre-loxP重组酶系统的开发与升级”中,我们介绍了利用Magnet系统的开发与升级,该系统是由光敏蛋白VVD系统改造而来。
近年来光遗传学技术发展迅速,许多自然存在的光敏蛋白如CRY2,FKF1,VVD,EL222, PhyB,BphP1和BphS等被开发成光遗传学技术,用于基础科研以及生物医药转化研究中的精准时空调控。2021年10月,华东师范大学的叶海峰研究组在Nature Biotechnology上报道了一种基于植物光敏色素PhyA改进的新型REDMAP(red/far-red light-mediated and miniaturized Δphytochrome A (ΔPhyA)-based photoswitch)系统[1]。该系统具有模块小、灵敏度高、可逆性强的特点,为基础科研以及生物医药转化研究提供了强有力的光遗传学新工具。
植物光敏色素PhyA通过共价结合发色团藻青素(PCB)可响应红光(660 nm)和远红光(730 nm)的调控[2, 3],在与穿梭蛋白FHY1结合后可进入细胞核中[4, 5]。PhyA与FHY1可在红光(660 nm)作用下诱导结合,并且在远红光(730 nm)作用下解离(图一a)。基于该系统的优势,研究者在其基础上进行改进,并设计了报告基因系统来评价光控诱导效率。将PhyA与转录激活蛋白Gal4融合,利用Gal4-UAS系统激活报告系统中分泌型胎盘碱性磷酸酶(SEAP)的表达。当PhyA与FHY1结合后入核,SEAP的表达被开启(图一b)。利用该报告基因系统,研究者筛选出截短型ΔPhyA-Gal4(PhyA, 1-617 aa)(图一c)、穿梭蛋白FHY1(图一d)以及FHY1-VP64融合蛋白形式(图一e)的光控诱导效率最高。在PCB存在下,ΔPhyA-Gal4与FHY1-VP64组合的光控诱导效率高达到150倍以上(图一f),从而确定了REDMAP系统的表达元件。

图一 REDMAP系统工作原理示意图及其优化[1]
REDMAP系统可以与CRISPR–dCas9 SAM激活系统[6]相结合开发成REDMAPcas系统。在红光(660 nm)照射下,该系统的ΔPhyA与FHY1结合后入核,Gal4-UAS系统激活MS2-p65-HSF1的表达,进而在同时过表达dCas9和sgRNA的条件下开启CRISPR–dCas9 SAM激活系统,实现对靶基因的激活表达(图二右图)。在远红光(730 nm)作用下,MS2-p65-HSF1的表达被关闭,从而关闭CRISPR–dCas9 SAM激活系统(图二左图)。
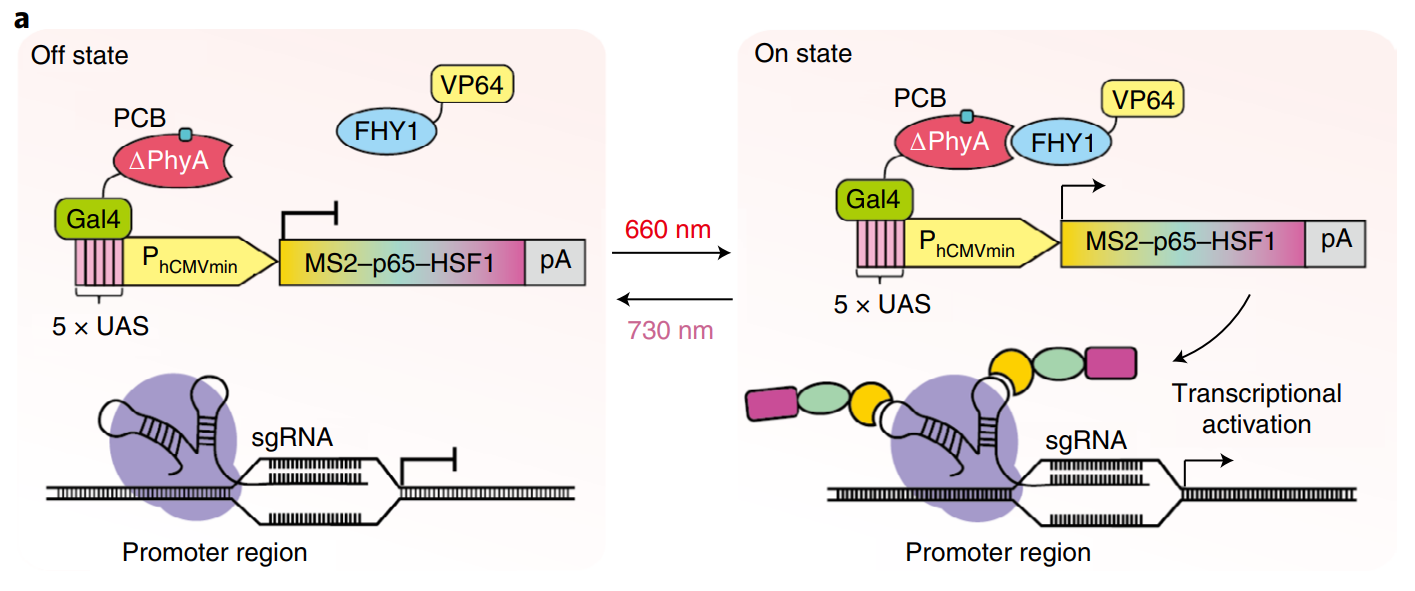
图二 REDMAPcas系统工作原理示意图[1]
由于REDMAP系统的质粒PhCMV-ΔPhyA-Gal4-P2A-FHY1-VP64-pA较小,即模块小,便于包装在一个AAV载体中。将REDMAP AAV与UAS-luciferase报告系统AAV混合后,通过尾静脉注射到小鼠体内,在AAV注射后的2~11周观察期中,光照前小鼠腹腔注射PCB,仅用1分钟的红光(660 nm)照射即可高效诱导小鼠体内荧光素酶报告基因的表达(图三)。以上小鼠体内数据结果进一步证明了REDMAP系统的光响应速度快,并且AAV包装系统的简便性可更好地运用于基因治疗等领域的体内精准调控。

图三 AAV介导REDMAP系统在小鼠体内的光控应用[1]
基于REDMAP系统灵敏度高、红光/远红光组织穿透性强的优势,研究者进一步将其应用到体内疾病治疗模型中,选择的是Ⅰ型糖尿病(T1D)模型。研究者将ΔPhyA–Gal4,FHY1–VP64,PCB产生质粒以及驱动胰岛素表达P5×UAS-SEAP-P2A-insulin-pA的四个表达载体,稳转入HEK293细胞(图四a右图),并将工程细胞微胶囊皮下注射至T1D小鼠模型背部(图四a左图)。在每天5秒的红光(660 nm)照射下,2天后可检测到T1D小鼠模型的血液胰岛素含量显著升高(图四b),血糖含量显著降低(图四c),并且在小鼠糖耐受实验中也能有效改善糖代谢能力(图四d)。REDMAP系统在T1D大鼠模型体内也能观察到同样的降血糖效果,仅将红光(660 nm)照射时间调整为每天2次,每次5分钟。

图四 REDMAP系统在T1D小鼠模型中维持葡萄糖稳态的应用[1]
综上所述,REDMAP系统具有模块小、灵敏度高、可逆性强的特点,并且红光/远红光的组织穿透性强,可广泛应用于在体研究,简化并提高基因治疗和细胞治疗的精准调控,推进光遗传技术在基础科研以及生物医药转化研究的应用。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。
多个光控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法快速获得光遗传技术的基因改造小鼠。

有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Zhou Y, Kong DQ, Wang XY, Yu GL, Wu X, Guan NZ, Weber W, Ye HF: A small and highly sensitive red/far-red optogenetic switch for applications in mammals. Nat Biotechnol 2021.
2. Jorissen HJMM, Quest B, Lindner I, de Marsac NT, Gartner W: Phytochromes with noncovalently bound chromophores: The ability of apophytochromes to direct tetrapyrrole photoisomerization. Photochem Photobiol 2002, 75(5):554-559.
3. Kami C, Mukougawa K, Muramoto T, Yokota A, Shinomura T, Lagarias JC, Kohchi TJPotNAoSotUSoA: Complementation of phytochrome chromophore-deficient Arabidopsis by expression of phycocyanobilin:ferredoxin oxidoreductase. 2004, 101(4):1099-1104.
4. Possart A, Hiltbrunner A: An evolutionarily conserved signaling mechanism mediates far-red light responses in land plants. The Plant cell 2013, 25(1):102-114.
5. Rausenberger J, Tscheuschler A, Nordmeier W, Wust F, Timmer J, Schafer E, Fleck C, Hiltbrunner A: Photoconversion and Nuclear Trafficking Cycles Determine Phytochrome A's Response Profile to Far-Red Light. Cell 2011, 146(5):813-825.
6. Konermann S, Brigham MD, Trevino AE, Joung J, Abudayyeh OO, Barcena C, Hsu PD, Habib N, Gootenberg JS, Nishimasu H et al: Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature 2015, 517(7536):583-588.

