技术分享:全基因组CRISPRa激活筛选发现脯氨酸代谢酶PRODH2可增强CAR-T疗效
Tips:在“CRISPRa和CRISPRi的人原代T细胞筛选系统”技术分享中,我们介绍了CRISPRa激活系统和CRISPRi抑制系统的原理,及其应用于人原代T细胞的大规模筛选,以获得细胞治疗新靶点。本期我们将介绍利用CRISPRa激活系统进行小鼠原代T细胞的全基因组筛选,鉴定并证明了PRODH2新靶点可增强CAR-T疗法的治疗效果。
T细胞是适应性免疫的基石,是维持人类健康的重要角色。嵌合抗原受体T细胞(CAR-T)免疫疗法已在治疗癌症和免疫疾病方面取得了巨大进展[1, 2]。然而,目前CAR-T疗法仍然面临多种挑战,例如抗原丢失、靶标识别失败、癌症免疫逃逸和持久性不足等[3, 4]。因此,寻找可增强CD8+ T细胞效应功能的靶点基因,将其应用于工程化改造T细胞,可为T细胞治疗带来广泛的应用前景和疗效受益。
2022年4月,Cell Metabolism上报道了一种基于dead-guide RNA(dgRNA)CRISPRa激活系统的功能增益(gain-of-function,GOF)筛选方法,用于原代CD8+ T细胞的高通量筛选,以获得增强T细胞效应功能的GOF靶点。利用该筛选方法,研究者获得了多个GOF靶点,并鉴定了脯氨酸脱氢酶2(PRODH2)可通过重塑原代CD8+ T细胞以及CAR-T细胞的代谢途径和基因表达谱式,显著性提高T细胞的杀伤功能,增强CAR-T细胞的体内外抗肿瘤效果[5]。
首先,研究者构建了慢病毒T细胞dgRNA激活(TdgA)载体 (图一A),并针对小鼠mm10基因组所有注释蛋白质的启动子序列,设计了全基因组的dgRNA文库(mm10dgLib)(图一B)。经过筛选,最终mm10dgLib包含有靶向22,391个编码转录本和1,000个非靶向对照(NTC)的共计84,601个dgRNAs,它们被合成克隆到TdgA载体中(图一B)。研究者将这些mm10dgLib质粒库包装成慢病毒,并且质控确认已达到足够的病毒滴度用于下游的CRISPRa系统筛选。
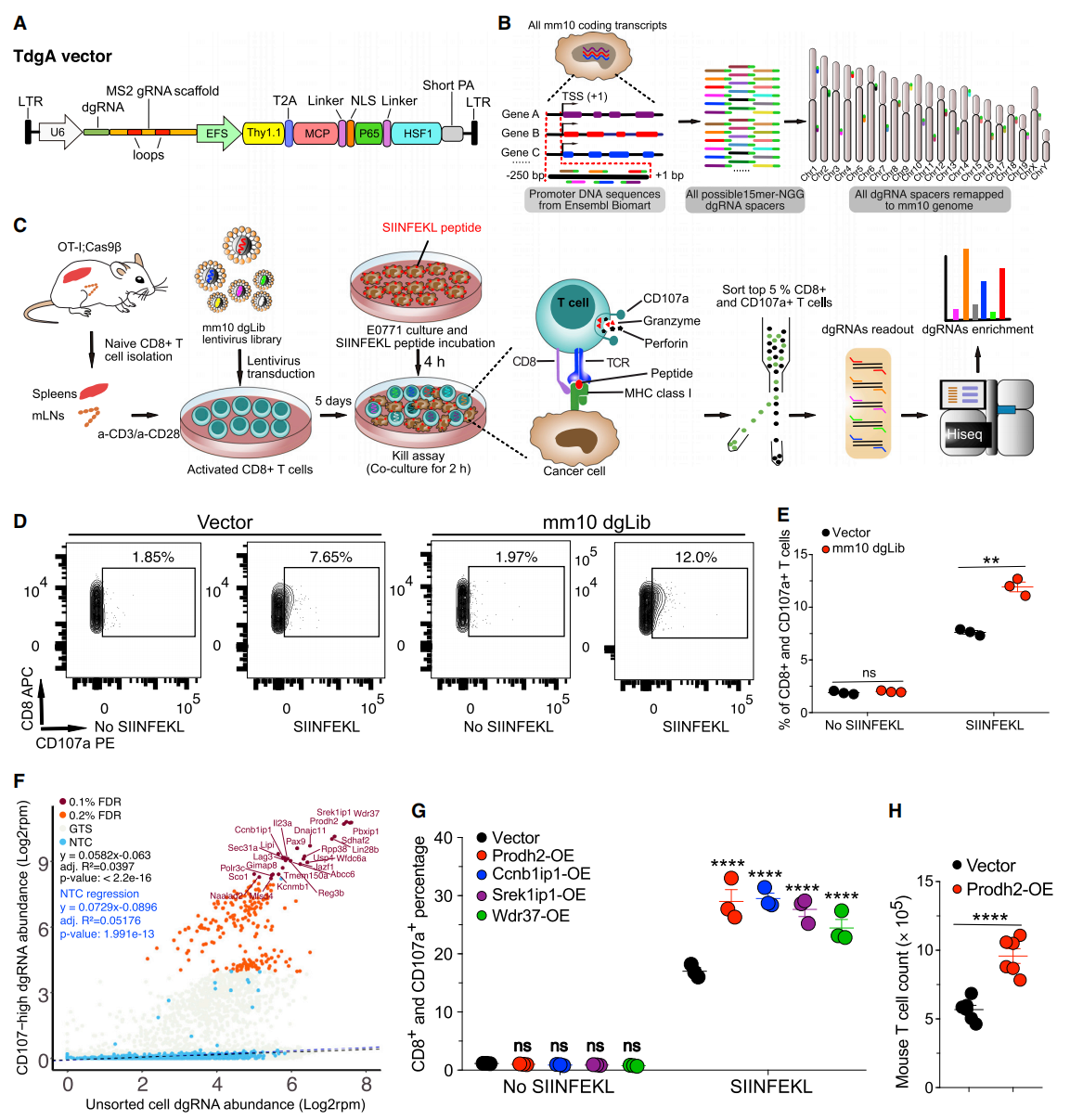
图一 基于dgRNA的CRISPRa系统筛选出增强CD8+ T细胞效应功能的靶点[5]
脱颗粒是细胞毒性CD8+ T淋巴细胞(CTL)介导靶细胞杀伤的主要机制之一[6],CD107a(也称为LAMP-1)是其标记物,可在脱颗粒后出现于细胞表面[7]。为了鉴定出能够增强CD8+ T细胞脱颗粒能力的靶点基因,研究者利用基于mm10dgLib的CRISPRa系统进行CD8+ T细胞杀伤试验筛选(dgTKS),将来源于OT-I;Cas9β小鼠的CD8+ T细胞与提呈SIINFEKL肽的E0771乳腺癌细胞共培养(图一C)。结果显示,与对照组相比,mm10dgLib慢病毒转导的CD8+ T细胞在共培养后CD107a水平显著升高(图一D和E)。研究者利用FACS分选出前5%高表达CD107a的CD8+ T细胞,测序鉴定出富集的dgRNA序列(图一C),共获得靶向Prodh2、Srek1ip1、Wdr37、Ccnb1ip1、Pbxip1和Sdhaf2在内的26个GOF靶点(图一F)。进一步验证了其中4个靶点,发现PRODH2、CCNB1IP1、SREK1IP1、WDR37的过表达都能显著提高CD8+ T细胞的脱颗粒能力(图一G);并且PRODH2过表达还显著促进了CD8+ T细胞的增殖(图一H)。以上数据表明,基于dgRNA的CRISPRa系统可以用于快速筛选增强CD8+ T细胞效应功能的潜在GOF靶点。
为了验证PRODH2对CD8+ T细胞的GOF作用,研究者构建了特异性靶向TRAC位点的AAV-CD22-CAR-T2A-PRODH2,使得CD22-CAR和PRODH2在人原代T细胞中同时过表达,并构建了AAV-CD22-CAR-T2A-PRODH2 (Stop)作为对照(图二A)。FACS结果显示,AAV递送稳定敲入人原代CD8+ T细胞,并成功分选富集了CD22-CAR-T细胞(图二B),免疫印迹结果证明了PRODH2的同时过表达(图二C)。通过FACS检测细胞增殖标志物Ki-67,发现Ki-67的表达水平在PRODH2过表达的CAR-T细胞中显著上升(图二D)。细胞共培养实验显示,PRODH2过表达的CAR-T细胞相比对照组具有更强的靶细胞杀伤能力(图二E)。类似地,研究者构建了另一个过表达PRODH2的HER2-CAR-T细胞(图二F),同样显示PRODH2过表达使得CAR-T细胞具有更强的靶细胞杀伤能力(图二G)。此外,研究者使用慢病毒分别构建了PRODH2过表达的CD22-CAR-T和BCMA-CAR-T细胞(图二H和J),再次证明PRODH2过表达显著增强了CAR-T细胞的杀伤能力(图二I和K),其中PRODH2对BCMA-CAR-T细胞的增强效果更为明显(图二K)。以上数据表明,在多种CAR-T细胞模型中,过表达PRODH2的GOF作用可增强抗原特异性CAR-T细胞的体外杀伤能力。
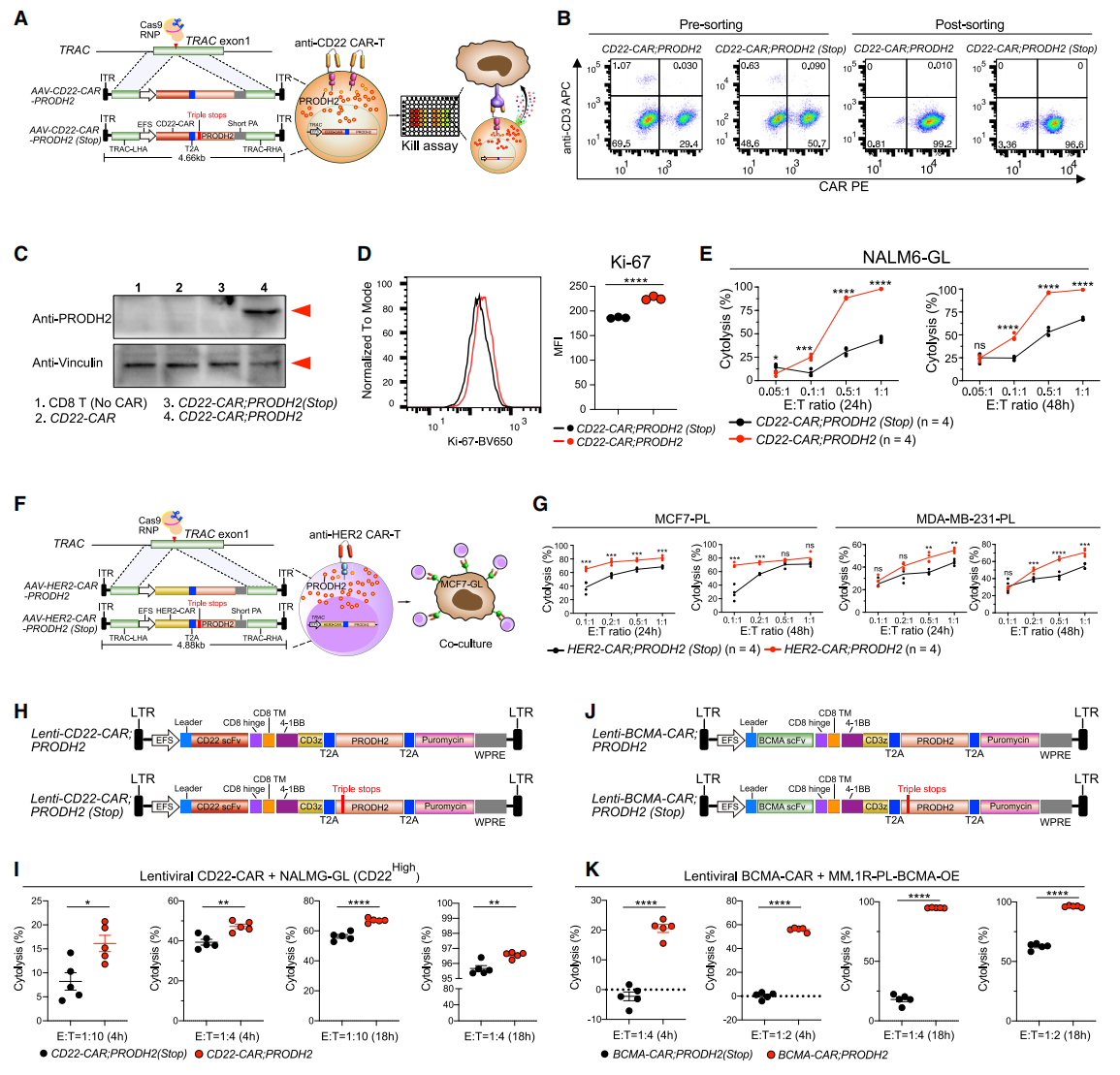
图二 PRODH2过表达可显著性增强CAR-T细胞的体外杀伤能力[5]
接着,研究者进一步测试PRODH2的GOF作用能否提高CAR-T细胞的体内治疗效果。首先测试了CD22阳性的B细胞白血病模型(图三A),结果显示,对照组CD22-CAR-T细胞虽然具有抗肿瘤活性,但白血病很快又会复发;而PRODH2过表达组显示出更卓越的抗肿瘤活性,可以有效控制白血病进展(图三B和C)。研究者还使用AAV和慢病毒两种不同递送方法的CAR-T平台,在系统性多发性骨髓瘤模型中进行测试(图三D)。AAV递送系统的总生存期分析显示,对照组BCMA-CAR-T细胞略微延长了小鼠总体生存期,而PRODH2过表达组具有更优的体内治疗效果,显著提高了总体生存期(图三E和F)。慢病毒递送系统的结果显示,PRODH2过表达增强了BCMA-CAR-T细胞的抗肿瘤效果(图三G和H)。以上数据表明,在多种小鼠肿瘤模型中,过表达PRODH2显著增强了CAR-T细胞的抗肿瘤在体治疗效果,且对BCMA-CAR-T细胞疗法的增益效果更为显著。
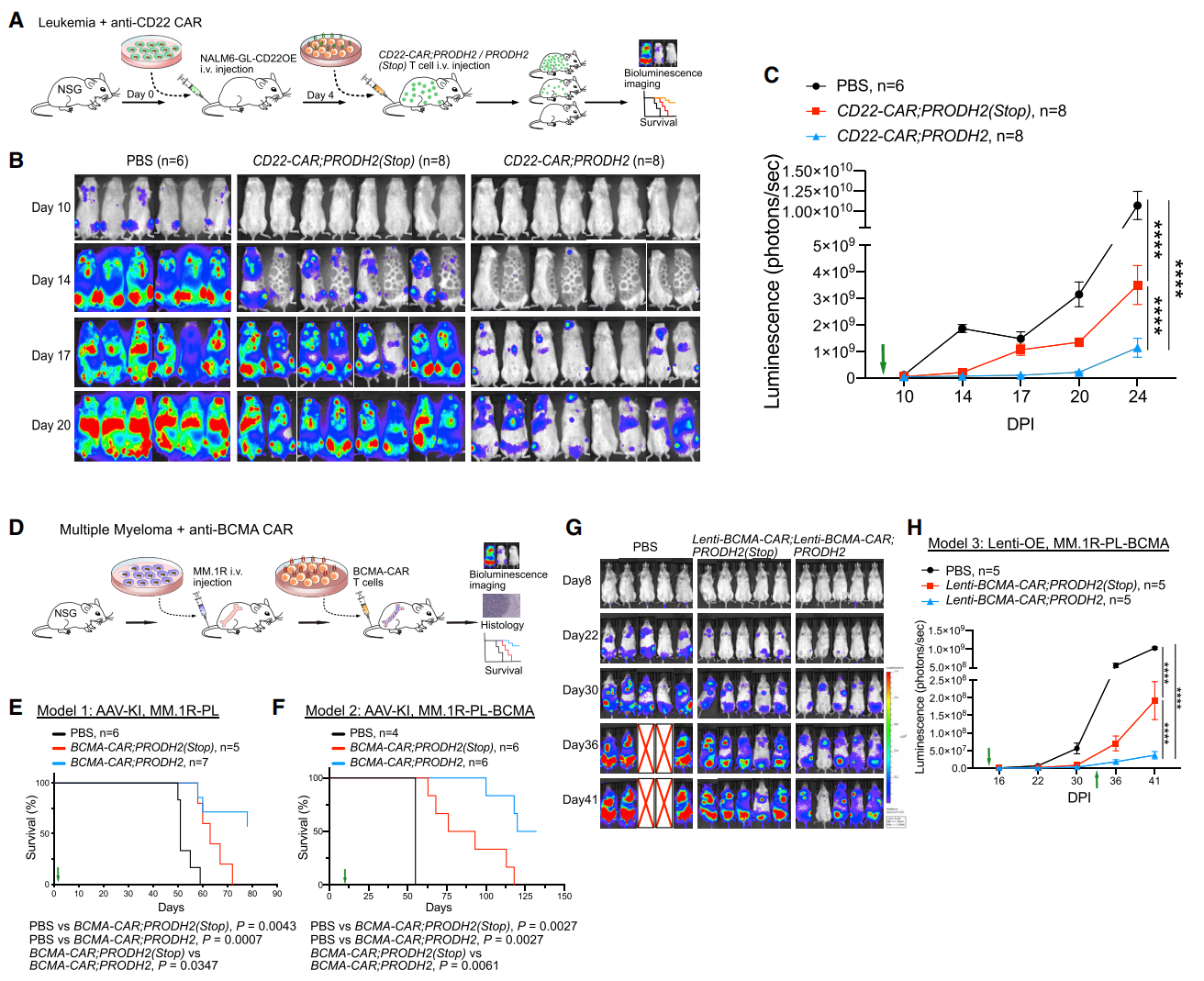
图三 PRODH2过表达可增强小鼠肿瘤模型的CAR-T细胞疗效[5]
下一步,研究者利用多组学分析对PRODH2的GOF分子机制进行研究,发现PRODH2的过表达重塑了以细胞周期、T细胞活化和代谢过程为核心的CD22-CAR-T细胞的基因表达谱式和免疫效应功能。PRODH2编码的脯氨酸脱氢酶,可以催化4-羟基脯氨酸(4Hyp)转化为1-吡咯啉-3-羟基-5-羧酸盐(PHC),这是脯氨酸代谢途径的关键步骤[8]。通常情况下,PRODH2在大多数人体器官和细胞中的表达水平较低,包括原代CD4+ T细胞和CD8+ T细胞。最后,研究者对CAR-T细胞进行了代谢组学分析,共鉴定出75种代谢产物,其中8种在PRODH2过表达CAR-T细胞中表达更加丰富,而有19种被显著下调(图四A和B)。PRODH2的催化底物4Hyp和产物PHC也分别被检测到相应的下调与上调表达(图四A和B)。L-脯氨酸在P4HA1或P4HA2的催化下可产生4Hyp,进而被PRODH2催化成PHC(图四C)。研究者采用脯氨酸代谢相关底物或抑制剂预处理CAR-T细胞3-6天,然后进行共培养和流式测定实验(图四C和D),并确认了实验细胞中高效的CAR敲入(图四E)。结果显示,L-脯氨酸和4Hyp的添加仅显著增强了PRODH2过表达CAR-T细胞的肿瘤杀伤能力(图四F);而P4HA1和P4HA2的抑制剂1,4-DPCA也仅降低了PRODH2过表达CAR-T细胞的肿瘤杀伤能力,且对T细胞活力没有影响(图四G);PRODH2过表达后IFNg表达水平上调,且高浓度1,4-DPCA的添加可显著抑制IFNg的表达使其接近对照组细胞水平(图四H和I)。此外,PRODH2的代谢产物PHC是由GOT1/2转运,添加GOT1/2抑制剂PF04859989同样仅降低了PRODH2过表达CAR-T细胞的肿瘤杀伤能力(图四J)。以上脯氨酸代谢途径的扰动实验结果表明,PRODH2过表达对CAR-T细胞的功能增益机制是由其脯氨酸代谢酶的功能发挥作用的。
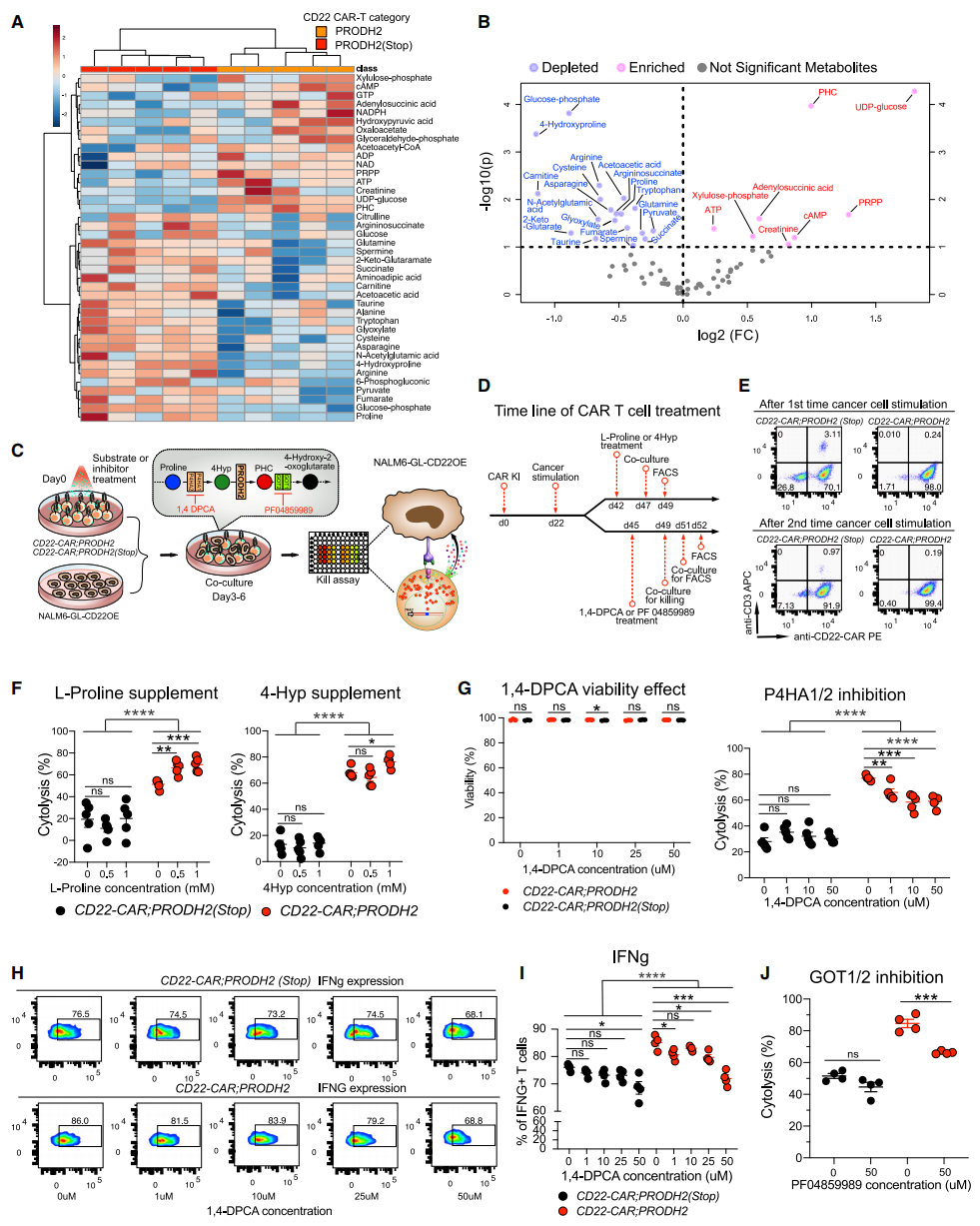
图四 PRODH2过表达CAR-T细胞的代谢组学分析和生化免疫学验证[5]
综上所述,研究者开发的基于dgRNA的全基因组CRISPRa激活筛选方法,可以高通量筛选获得增强CAR-T细胞效应功能的GOF新靶点,进而鉴定并验证了GOF新靶点PRODH2通过其脯氨酸代谢酶功能,重塑了CD8+ T细胞和CAR-T细胞中的转录组、代谢组以及免疫功能,增强了CAR-T细胞的体内外抗肿瘤效果。该研究为进一步提高CAR-T疗法的治疗效果提供了新的靶点,不仅增加了CAR-T疗法的治疗疾病种类,还能拓展到其他以T细胞为核心的细胞免疫疗法中,具有广泛的临床意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Majzner RG, Mackall CL. Clinical lessons learned from the first leg of the CAR T cell journey. Nat Med 2019, 25(9):1341-1355.
2. Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science 2015, 348(6230):62-68.
3. June CH, O'Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science 2018, 359(6382):1361-1365.
4. Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell 2017, 168(4):707-723.
5. Ye L, Park JJ, Peng L, Yang Q, Chow RD, Dong MB, Lam SZ, Guo J, Tang E, Zhang Y et al. A genome-scale gain-of-function CRISPR screen in CD8 T cells identifies proline metabolism as a means to enhance CAR-T therapy. Cell Metab 2022, 34(4):595-614 e514.
6. Trapani JA, Smyth MJ. Functional significance of the perforin/granzyme cell death pathway. Nature reviews Immunology 2002, 2(10):735-747.
7. Peters PJ, Borst J, Oorschot V, Fukuda M, Krähenbühl O, Tschopp J, Slot JW, Geuze HJ. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. The Journal of experimental medicine 1991, 173(5):1099-1109.
8. Phang JM, Liu W, Zabirnyk O. Proline metabolism and microenvironmental stress. Annual review of nutrition 2010, 30:441-463.



