技术分享:CRISPRa和CRISPRi的人原代T细胞筛选系统
Tips:在上期“基于CRISPRa-SAM小鼠的疾病造模方法”技术分享中,我们介绍了CRISPRa激活系统以及利用CRISPRa-SAM小鼠来进行多种疾病造模。本期我们将介绍利用CRISPRa激活系统和CRISPRi干扰系统来进行人原代T细胞的大规模筛选,以获得细胞治疗新靶点。
调节性T细胞受刺激后分泌的细胞因子是平衡免疫反应的关键。细胞因子的失调可导致自身免疫性疾病、免疫缺陷和癌症[1-3]。全面了解调控人原代T细胞产生细胞因子的通路将有助于开发新一代免疫疗法,也将为了解相关疾病机制提供更多依据。
CRISPR作为强大的基因编辑工具,其衍生的CRISPR-KO高效筛选系统已广泛应用于全基因组范围的功能缺失研究中。CRISPRa激活系统和CRISPRi干扰系统是通过调控靶基因转录的激活或沉默,来实现功能获得或功能缺失。由于是对靶基因的转录调控,CRISPRa和CRISPRi系统要发挥作用需要持续表达dCas9,这就限制了这两个系统在原代细胞中的大规模筛选应用。
2022年2月,Science上报道了一种可用于人原代T细胞进行大规模CRISPRa和CRISPRi筛选的平台,研究者优化了高滴度慢病毒的生产方法,使得人原代T细胞的病毒转导效率高达80%,突破了之前的技术瓶颈。并且,利用这两个系统发现了一群新的调控因子,可刺激依赖性地调控人原代T细胞分泌细胞因子[4]。
研究者首先优化CRISPRa和CRISPRi系统的原代细胞转导条件,通过优化高滴度慢病毒载体的生产方法同时递送最小的dCas9-VP64质粒,使得病毒转导效率高达80%。研究者采用CRISPRa-SAM激活系统来进行全基因组的激活表达筛选,在人原代T细胞上先后感染dCas9-VP64慢病毒和sgRNA慢病毒文库,其中后者包含超过112,000个sgRNAs共靶向18,800余个靶基因。阳性筛选结果是利用流式细胞仪来分选CD4+ T细胞中IL-2高表达或CD8+ T细胞中IFN-γ高表达的细胞,并经测序确定被激活的靶基因(图一A)。sgRNA靶向IL2和IFNG的阳性对照在各自的筛选结果中被富集,而非靶向的阴性对照没有被富集(图一B),表明筛选系统真实可靠。CRISPRa系统的CD4+ IL-2hi和CD8+ IFN-γhi两个筛选结果分别获得444个和471个靶基因,其中交集为171个靶基因(图一C-E)。两个筛选结果在不同人的T细胞中都有高度重复性(图一C和D)。
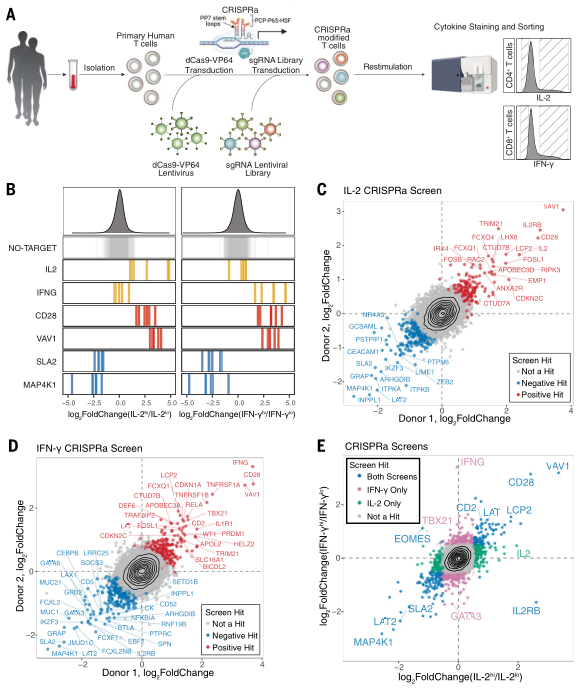
图一 人原代T细胞的全基因组CRISPRa筛选[4]
同理,研究者进行CRISPRi筛选,CD4+ IL-2hi和CD8+ IFN-γhi两个筛选结果分别获得226个和203个靶基因,其中交集为92个靶基因。在不同人T细胞中,两个筛选结果同样有高度重复性(图二A和B)。值得注意的是,CRISPRi系统筛选得到的靶基因通常是原本高表达的基因,而CRISPRa系统得到的往往是原本低表达的基因(图二C-E)。因此,CRISPRa和CRISPRi两个筛选系统的结果相互补充,能更全面地发现功能性调控因子。举个例子,通过CRISPRi筛选得知可通过抑制T细胞刺激信号MALT1、BCL10、TRAF6和TAK1,来抑制NF-κB复合物,从而促进IFN-γ的分泌。另外,通过CRISPRa筛选得知可通过激活肿瘤坏死因子超家族受体,来抑制NF-κB复合物,促进IFN-γ的分泌(图二E和F)。从而全面获得针对NF-κB复合物的正、反调控因子,共同起到促进IFN-γ分泌的作用。
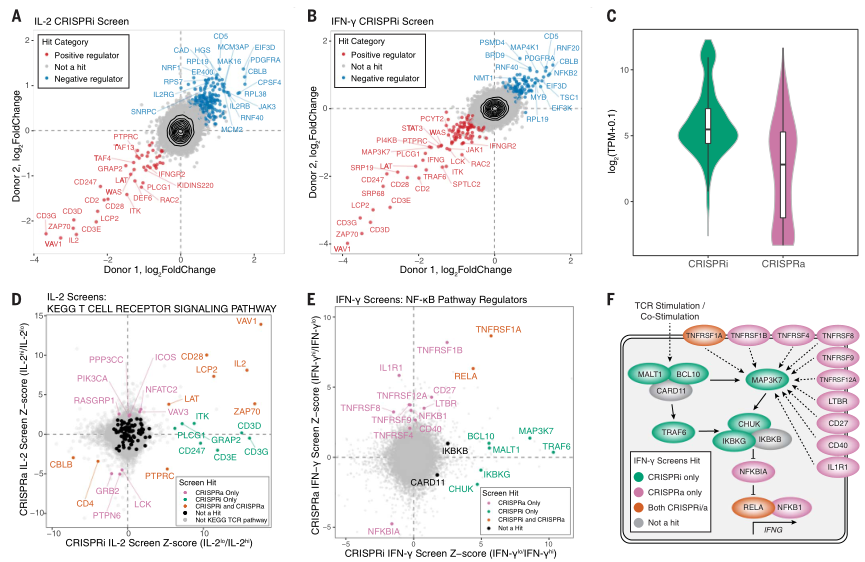
图二 人原代T细胞的全基因组CRISPRi筛选[4]
最后,为了评价每个CRISPRa基因激活后产生的整体分子特征,研究者将CRISPRa与单细胞测序scRNA-seq相结合开发了CRISPRa Perturb-seq平台。将一个直接捕获序列整合到CRISPRa-SAM系统的sgRNA支架上,以实现与scRNA-seq方法的测序兼容性(图三A)。研究者使用CRISPRa Perturb-seq平台激活70个靶基因,并对约56,000个人原代T细胞进行scRNA-seq(图三B),揭示了不同调控因子激活T细胞产生不同细胞因子的过程。
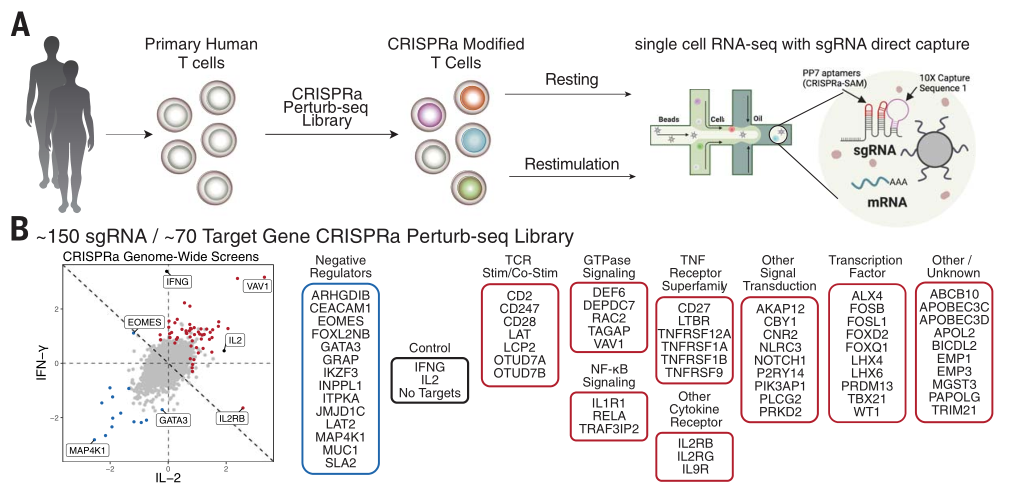
图三 CRISPRa Perturb-seq平台的工作原理[4]
综上所述,利用CRISPRa激活系统和CRISPRi干扰系统可进行人原代T细胞的大规模筛选,功能获得和功能缺失的筛选结果可以相互补充,获得全面的功能性调控因子。进一步细化研究可得到T细胞的关键调控因子,有望成为新一代细胞治疗靶点,用于增强T细胞的肿瘤杀伤能力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
邮编:200031
责任编辑:多一百
新媒体运营:suway
参考文献:
1. Abbas AK, Trotta E, Simeonov DR, Marson A, Bluestone JA: Revisiting IL-2: Biology and therapeutic prospects. Sci Immunol 2018, 3(25).
2. Ni L, Lu J: Interferon gamma in cancer immunotherapy. Cancer Med-Us 2018, 7(9):4509-4516.
3. Ivashkiv LB: IFN gamma: signalling, epigenetics and roles in immunity, metabolism, disease and cancer immunotherapy. Nature Reviews Immunology 2018, 18(9):545-558.
4. Schmidt R, Steinhart Z, Layeghi M, Freimer JW, Bueno R, Nguyen VQ, Blaeschke F, Ye CJ, Marson A: CRISPR activation and interference screens decode stimulation responses in primary human T cells. Science 2022, 375(6580):eabj4008.



