通过调节细胞力学来增强实体肿瘤治疗的CRISPR/Cas基因编辑效率
Tips:在“精准靶向肺部的新型脂质纳米颗粒”技术分享中,我们介绍了通过非病毒递送系统LNPs的改造实现肺部特异性的mRNA递送。本期将详细介绍利用LNPs同时递送多种mRNA和siRNA,促进LNPs内吞进入实体肿瘤内部,从而显著性提高实体肿瘤治疗的基因编辑效率和疗效。
CRISPR/Cas基因编辑系统具有精准失活或修复癌症相关基因的能力,在癌症治疗中具有巨大的潜力[1, 2]。然而,基于CRISPR/Cas的实体肿瘤治疗面临着两个关键障碍。第一是癌症具有无限增殖能力,少量细胞的成功编辑无法逆转疾病症状。第二是肿瘤微环境中存在着坚硬且纤维化的基质,这种物理性致密的肿瘤微环境会妨碍CRISPR/Cas系统递送入肿瘤,同时阻止了免疫细胞浸润到肿瘤组织[3]。因此,若能在治疗过程中克服这种递送障碍,将会为CRISPR/Cas递送入实体肿瘤进行有效的癌症治疗带来新的希望。
2022年5月,Nature Nanotechnology 上报道了一种靶向肿瘤组织力学的多功能自组装脂质纳米颗粒系统[4],将靶向黏附激酶(FAK)的siRNA、Cas9 mRNA和sgRNA(siFAK+CRISPR-LNPs)联合封装到脂质纳米颗粒(LNPs)中(图一a)。该系统可通过降低肿瘤细胞外基质(ECM)的硬度,增加LNPs内吞作用和组织渗透,从而实现高效的LNPs肿瘤递送,使得基因编辑效率提高10倍以上。
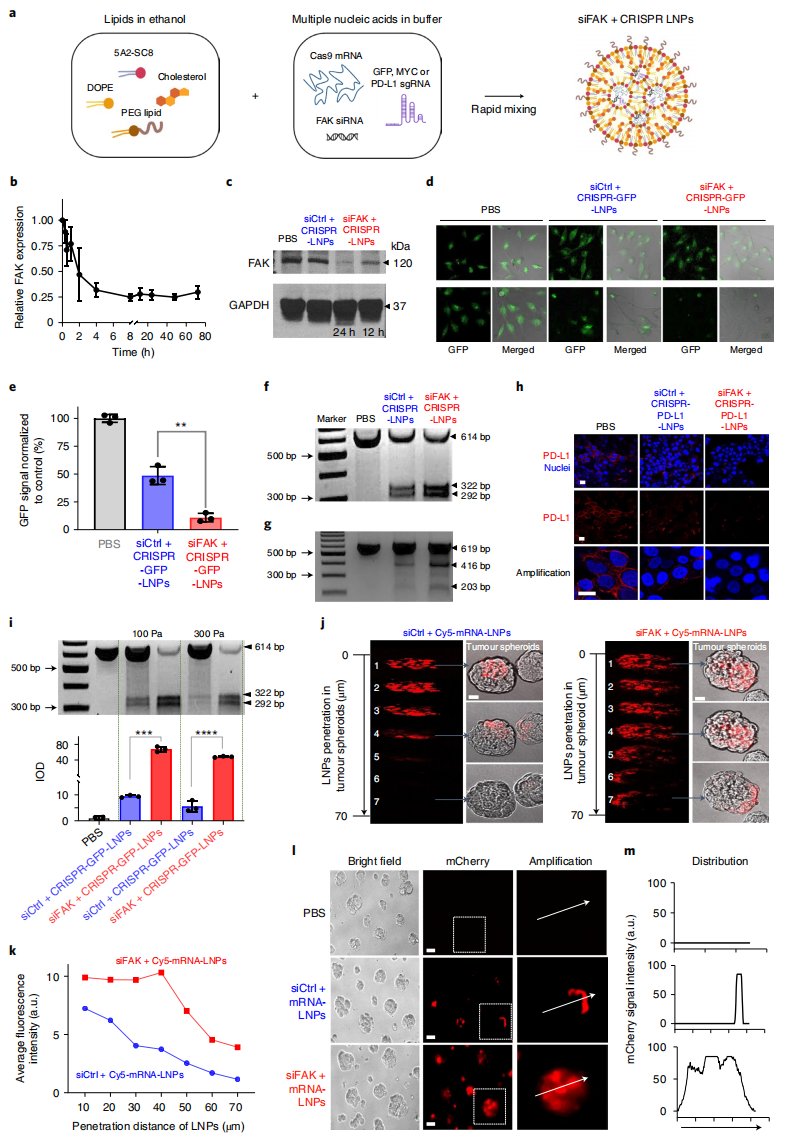
图一 FAK敲低可增强LNPs介导的mRNA递送和CRISPR基因编辑[4]
研究者首先在细胞系上测试FAK的敲低是否能提高CRISPR/Cas的编辑效率。将特异性靶向绿色荧光蛋白(GFP)的siFAK+CRISPR-LNPs递送至HeLa-GFP细胞,siRNA介导的基因沉默成功抑制了FAK的表达(图一b和c)。与对照组相比,siFAK+CRISPR-GFP-LNPs处理的HeLa-GFP细胞,GFP的表达更少(图一d和e),GFP DNA中插入/缺失的频率更高(图一f),表明CRISPR/Cas的编辑效率更高。研究者将靶向PD-L1的siFAK+CRISPR-PD-L1-LNPs递送至人类卵巢癌细胞(IGROV1)中,同样地,观察到PD-L1 DNA的插入/缺失频率增加(图一g),PD-L1蛋白的表达明显降低(图一h)。此外, siFAK+CRISPR-GFP-LNPs还能够在3D培养的多细胞球体中实现基因编辑,其中对GFP DNA的切割是对照组的7倍(图一i)。研究者进一步递送了Cy5标记的mRNA和报告基因mCherry mRNA,以检测LNPs的有效性和空间递送。通过Cy5荧光追踪,siFAK+mRNA-LNPs在4小时内穿透整个细胞球体(图一j和k),呈现为整个球体mCherry表达(图一l和m)。相比之下,对照组无法穿透球体中心,只能将mRNA递送到外周(图一j-m)。以上数据表明,FAK敲低可使得LNPs成功地将三种类型的核酸递送至多个肿瘤细胞系,克服肿瘤球体的物理障碍,增强RNA递送,实现高效基因编辑。
下一步,研究者对FAK敲低如何提高siFAK+CRISPR-LNPs基因编辑效果的机制展开研究。首先使用共聚焦显微镜和流式细胞术定量了IGROV1细胞对LNPs的吞食作用,在siFAK实验组中观察到更多的细胞吞食(图二a和b)。接着,研究者使用多种小分子抑制剂来抑制不同的细胞吞食通路。结果表明,FAK敲低主要通过调节网格蛋白和小泡依赖的内吞通路来增加细胞对LNPs的吞食(图二c)。膜内陷和内吞作用是这两种通路的主要步骤,涉及到由F肌动蛋白丝和肌动球蛋白网络产生拉力来调节细胞膜的张力。因此,研究者比较了应力纤维的动态变化和肌动球蛋白网络分布。与对照组相比,siFAK实验组细胞的应力纤维和肌动球蛋白网络均减少,表明siFAK-CRISPR-LNPs处理降低了细胞的收缩力(图二d-e)。进一步对细胞膜进行染色,发现siFAK+CRISPR-LNPs处理的细胞膜以时间和siFAK浓度依赖的方式发生形变和内吞(图二f-g)。以上结果表明,FAK敲低可降低细胞膜的收缩力,从而增强纳米颗粒的细胞内吞作用和渗透。
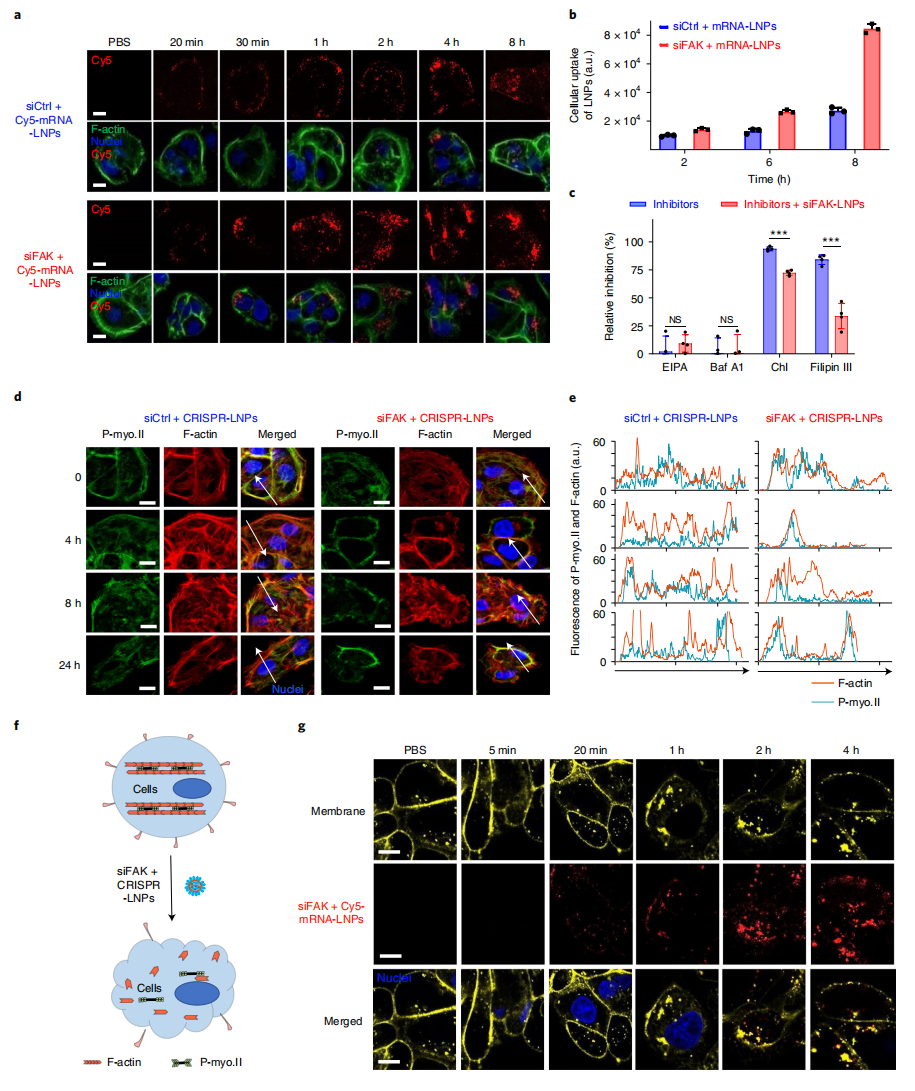
图二 FAK敲低通过改变收缩力和细胞膜张力来增强LNPs的内吞作用[4]
接下来,研究者使用携带ID8-Luc异种移植肿瘤的C57BL/6小鼠来评估siFAK+CRISPR-PD-L1-LNPs的基因编辑和抗肿瘤效果。通过在小鼠中局部给与不同处理,检测到siFAK+mCherry-mRNA-LNPs处理组肿瘤组织边缘和中心的LNPs渗透以及mCherry表达增强(图三a-b),siFAK+CRISPR-PD-L1-LNPs和siFAK+CRISPR-Ctrl-LNPs治疗的小鼠肿瘤微环境中的肿瘤组织YAP蛋白和I型胶原蛋白表达减少,硬度降低(图三c-d)。同时,siFAK+CRISPR-PD-L1-LNPs的治疗抑制了小鼠肿瘤生长,30天后平均肿瘤体积显著小于对照组(图三e-f)。以上结果表明,FAK敲低可使得细胞外基质硬度降低和PD-L1基因编辑增强,从而显著抑制肿瘤生长。
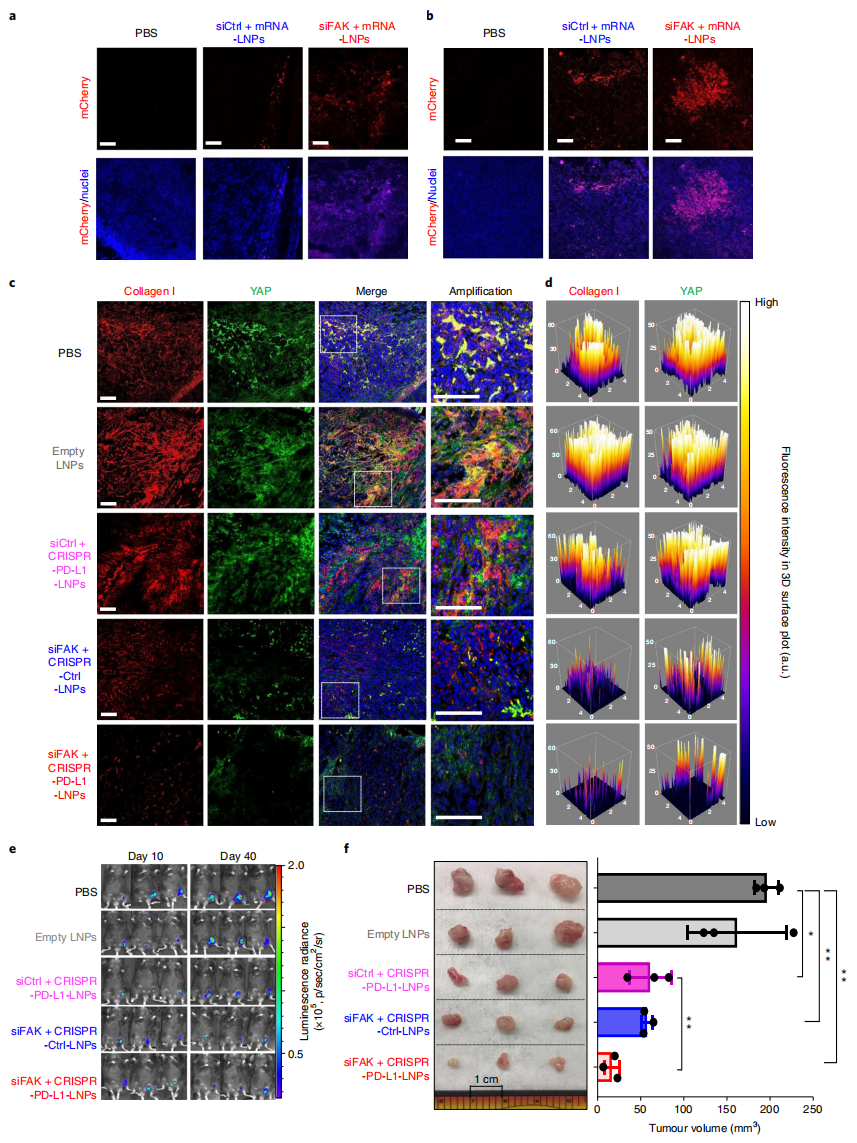
图三 siFAK+CRISPR-PD-L1-LNPs治疗可显著抑制异种移植瘤的生长[4]
最后,为进一步评估FAK敲低后增强基因编辑的效果,研究者在MYC转基因肝癌小鼠中注射siFAK+CRISPR-PD-L1-LNPs(图四a),分别在第 35、45 和 55 天检查肝脏。结果发现接受siFAK+CRISPR-PD-L1-LNPs和siFAK+CRISPR-Ctrl-LNPs治疗的小鼠胶原纤维化水平显著降低,癌细胞中YAP和I型胶原蛋白表达减少,表明癌细胞中FAK表达的敲低降低了肿瘤组织的硬度(图四b和c)。同时,FAK敲低可显著增强DNA切割效率,促使肿瘤组织中PD-L1(图四d-g)和MYC(图四h-j)表达显著降低。以上数据表明,通过FAK敲低可以增强体内肿瘤基因编辑效果,降低肿瘤硬度,从而抑制肿瘤生长。
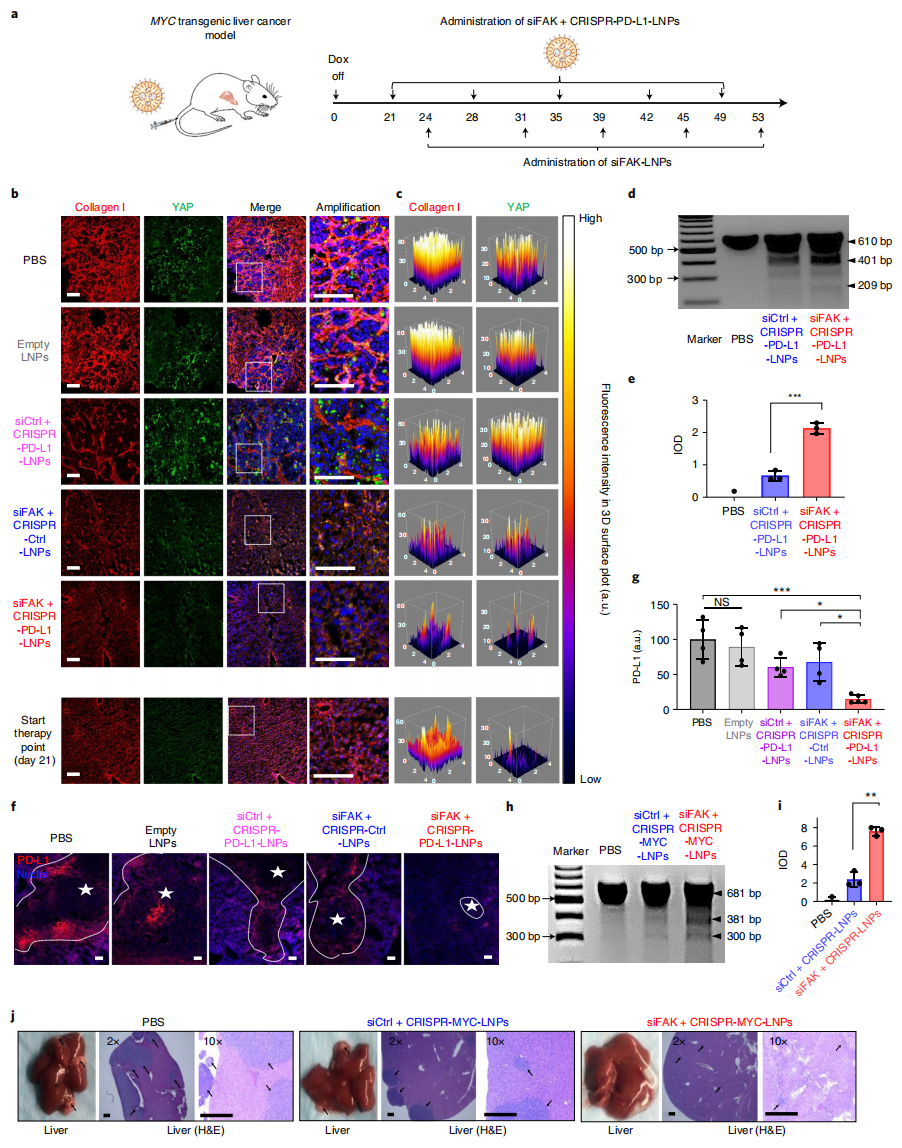
图四 siFAK+CRISPR-LNPs治疗可通过降低肝癌小鼠的肿瘤硬度来增强基因编辑[4]
综上所述,FAK敲低可通过降低肿瘤细胞的收缩力和膜张力以及ECM硬度,增加LNPs内吞作用和肿瘤渗透,从而显著性增强异体移植和体内肿瘤模型中肿瘤组织细胞的CRISPR基因编辑效率,最终提高多种难以治疗的癌症模型的免疫治疗效果。这种多功能LNPs的策略可用于各种癌症类型中的不同癌症靶点,为采用CRISPR/Cas基因编辑来治疗癌症提供了一种新的方法。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Wei T, Cheng Q, Farbiak L, Anderson DG, Langer R, Siegwart DJ: Delivery of Tissue-Targeted Scalpels: Opportunities and Challenges for In Vivo CRISPR/Cas-Based Genome Editing. ACS Nano 2020, 14(8):9243-9262.
2. Huang CH, Lee KC, Doudna JA: Applications of CRISPR-Cas Enzymes in Cancer Therapeutics and Detection. Trends Cancer 2018, 4(7):499-512.
3. Jiang H, Hegde S, Knolhoff BL, Zhu Y, Herndon JM, Meyer MA, Nywening TM, Hawkins WG, Shapiro IM, Weaver DT et al: Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nat Med 2016, 22(8):851-860.
4. Zhang D, Wang G, Yu X, Wei T, Farbiak L, Johnson LT, Taylor AM, Xu J, Hong Y, Zhu H et al: Enhancing CRISPR/Cas gene editing through modulating cellular mechanical properties for cancer therapy. Nat Nanotechnol 2022.



