技术分享:一种治疗艾滋病的新型基因疗法——体内改造B细胞使其分泌中和抗体
Tips:在“表观遗传基因治疗可缓解青春期过度饮酒造成的酒精依赖症和焦虑”技术分享中,我们介绍了CRISPR/dCas9表观遗传激活系统作为一种新型治疗手段在表观遗传基因治疗中的临床前研究。本期我们将介绍通过AAV递送CRISPR-Cas9系统体内基因改造B细胞使其分泌中和抗体,实现基因治疗一针注射即可长期治疗艾滋病的临床前研究。
艾滋病(AIDS)的抗病毒治疗(ART),是当前最为有效的治疗及预防策略,可将HIV病毒抑制在检测不出的水平,但无法彻底清除,需要终身每日服药[1]。靶向HIV包膜糖蛋白的广泛中和抗体(bNAbs),为抑制HIV病毒提供了一种新的长期治疗方式。在最新研究中,两种中和抗体3BNC117和10-1074的联合治疗可在中断ART治疗时长期抑制HIV病毒,最高可达43周[2]。但该疗法仅能用于治疗对3BNC117和10-1074敏感的HIV病毒。由于HIV病毒的快速复制很容易发生突变,易在机体中产生耐药性,使得中和抗体失去中和效能,这给研制HIV疫苗造成了很大困难。
2022年6月,Nature Biotechnology在线发表了一种治疗艾滋病的新型基因治疗方法,通过AAV递送CRISPR-Cas9基因编辑系统直接体内基因改造B细胞,促使改造后的B细胞表达中和抗体3BNC117来抑制HIV病毒。当体内HIV病毒重新出现时,可刺激体内B细胞再次响应分泌中和抗体。并且基因改造B细胞保留有克隆选择能力,可应对HIV病毒的高频突变,达到机体自身长期控制HIV病毒的治疗效果[3]。
研究者采用的B细胞基因改造策略,之前已在ex vivo系统中完成测试,即体外基因改造B细胞后回输体内具有HIV治疗效果[4]。这次的in vivo改造系统,采用相同的基因改造策略,不同的是利用AAV病毒来体内递送B细胞基因改造所需的两个质粒。第一个质粒编码CRISPR-Cas9系统,包括saCas9和靶向小鼠IgH基因J-C内含子区的sgRNA。另一个KI donor质粒,可在sgRNA靶向位点上定点插入编码中和抗体3BNC117轻链(VL)和重链可变区(VH)序列,其中VL和VH序列由Furin裂解位点和2A肽隔开,并由增强子依赖的Ig启动子驱动表达(图一a)。由CRISPR-Cas9系统介导基因组定点KI成功的基因改造B细胞,由于同时引入了剪接供体序列(SD),可在内源调节作用下表达各类同种型的中和抗体3BNC117(图一b)。最终实现基因改造后的B细胞不仅可响应抗原刺激表达中和抗体3BNC117,而且仍然具有维持免疫记忆、抗体同种型转换(CSR)、体细胞高频突变(SHM)、克隆选择与扩增的能力(图一c-e)。
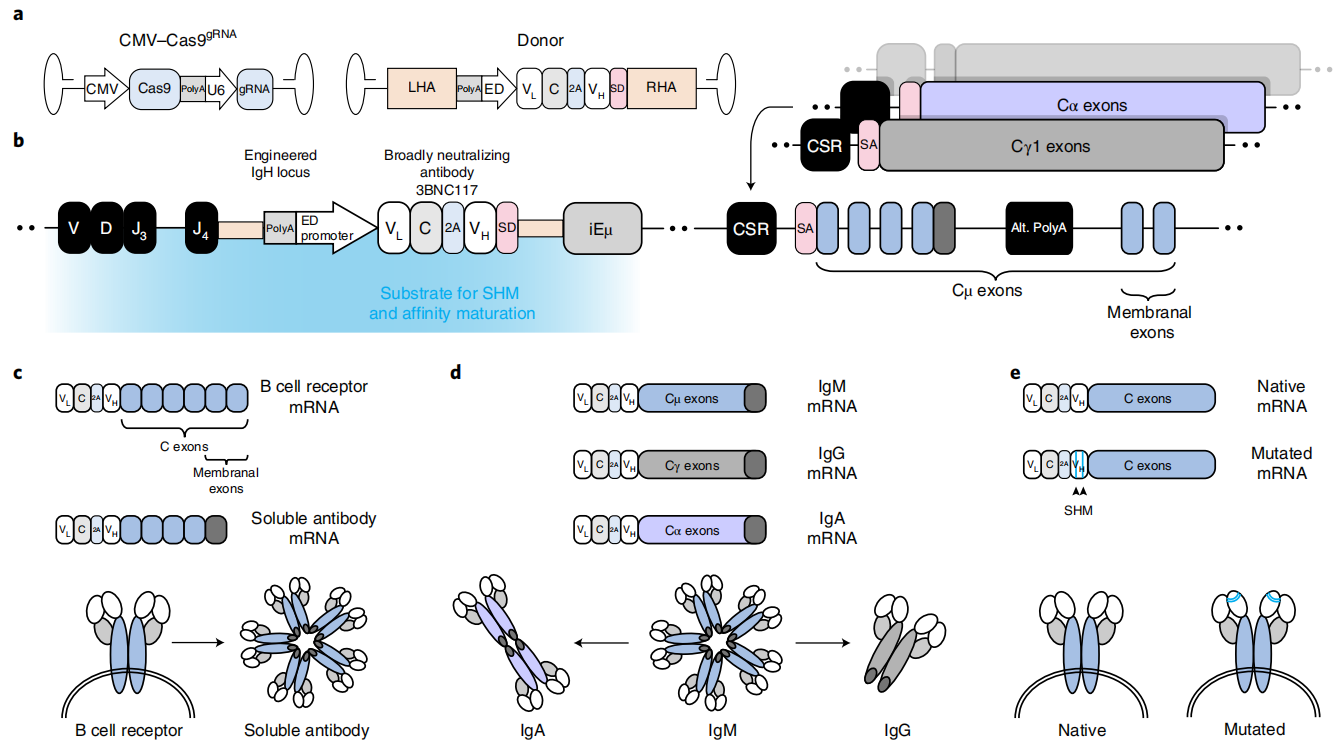
图一 基因改造B细胞的原理及其产物抗体[3]
研究者对上述体内基因改造B细胞的方案进行测试,检测一次注射能否产生中和抗体。首先,采用HIV抗原gp120免疫野生型小鼠6天后,单次尾静脉注射两种AAV病毒进行体内基因改造,并且在第8、23、68、98和128天再次抗原免疫。相应的在第37、52、67、82、97、112和127天采集小鼠血液进行抗体检测(图二a)。结果显示,在同时注射两种AAV病毒的小鼠血液中可检测到中和抗体3BNC117的表达,浓度最高可达5 μg/ml,并且中和抗体的表达量响应抗原刺激而增多(图二b)。从实验组小鼠血液中纯化出的IgG可以中和自体YU2.DG假病毒和异源JRFL假病毒(图二c)。另外,研究者采用其他HIV毒株的MD39抗原或者可溶性2CC抗原分别免疫野生型小鼠重复该实验,均可获得高浓度的中和抗体3BNC117(图二d-g)。利用酶联免疫斑点技术(ELISPOT)也能从骨髓中鉴定出分泌中和抗体的细胞在双AAV递送实验组中显著增多(图二h和i)。

图二 体内基因改造B细胞可表达高浓度中和抗体3BNC117[3]
其次,研究者检测表达中和抗体的细胞类型和比例。实验第136天即最后一次免疫8天后对小鼠进行分析(图二a),可在脾脏中检测到最高23%的浆母细胞表达中和抗体3BNC117(图三a和b),以及生发中心5-10%的淋巴细胞表达中和抗体(图三c和d)。研究者进一步分析体细胞高频突变和克隆选择情况,从小鼠肝脏和脾脏中提取基因组DNA,对扩增的3BNC117 VH片段进行Illumina测序。结果发现,大部分的突变是肝脏和脾脏共有的,它们并没有被克隆选择,这可能与AAV制备的异质性有关。位于CDR1的R30K替换形式是脾脏中最常见的突变,占比20%以上,但在肝脏或AAV中的丰度却很低。此外,还有3种脾脏突变形式显著地被阳性选择(图三e和f)。以上数据表明,体内基因改造的B细胞不仅具有免疫记忆,可长期响应抗原刺激表达中和抗体3BNC117,而且能在体内进行体细胞高频突变和克隆选择。
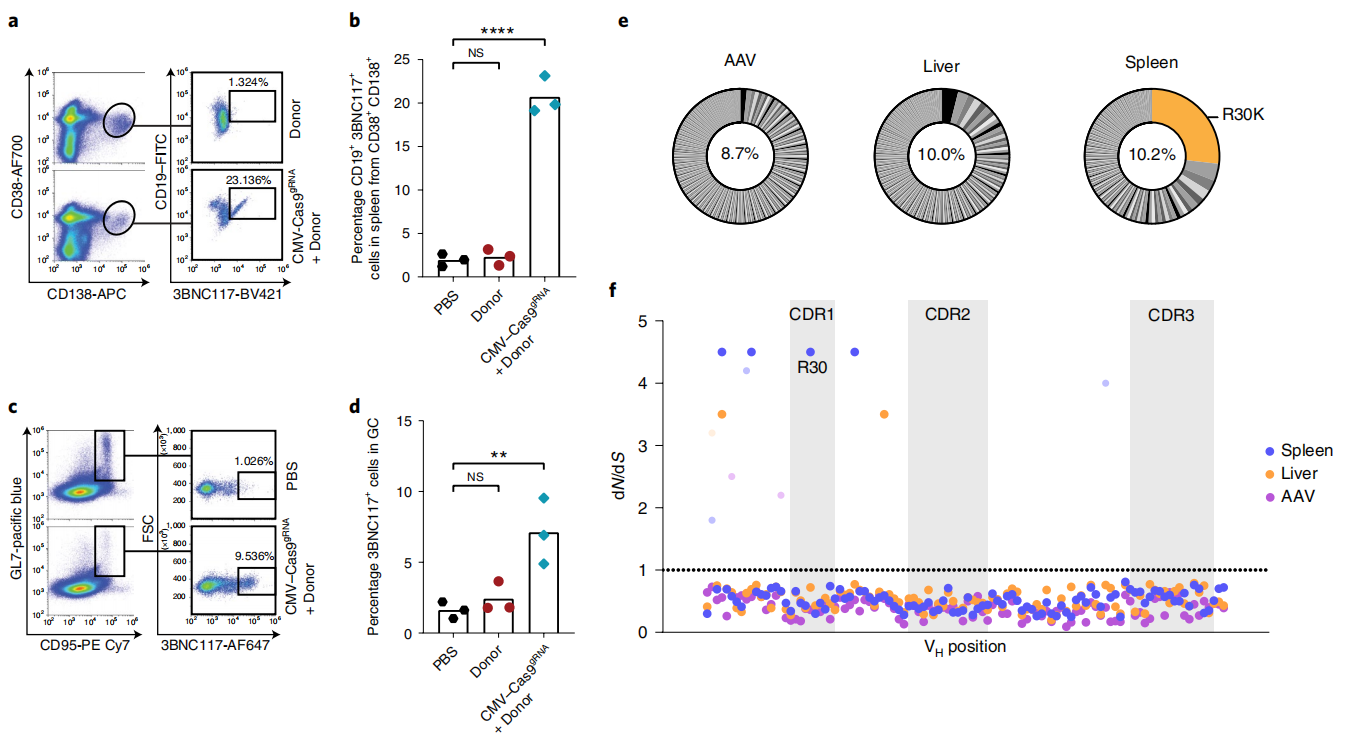
图三 AAV递送130天后体内仍然存在基因改造B细胞[3]
由于AAV递送系统具有组织特异性,仅注射单种KI donor AAV的实验组小鼠在第37天可检测到KI donor拷贝数在肝脏和血液中的富集(图四a),到第136天时主要富集在骨髓和淋巴结中(图四b)。而注射两种AAV的实验组小鼠在第136天时KI donor拷贝数在多个器官中均有富集,其中骨髓和淋巴结的增加最为显著(图四c),表明分泌中和抗体3BNC117的B细胞数量显著增多。通过对小鼠基因组DNA进行CHANGE-seq测序,发现95%的Cas9介导切割都发生在目标靶位点上,脱靶效应低(图四d)。 进一步分析肝脏和脾脏,发现目标靶位点上的错误修复仅发生在肝脏中,脾脏中却很少(图四e)。以上结果显示了该技术的高安全性。
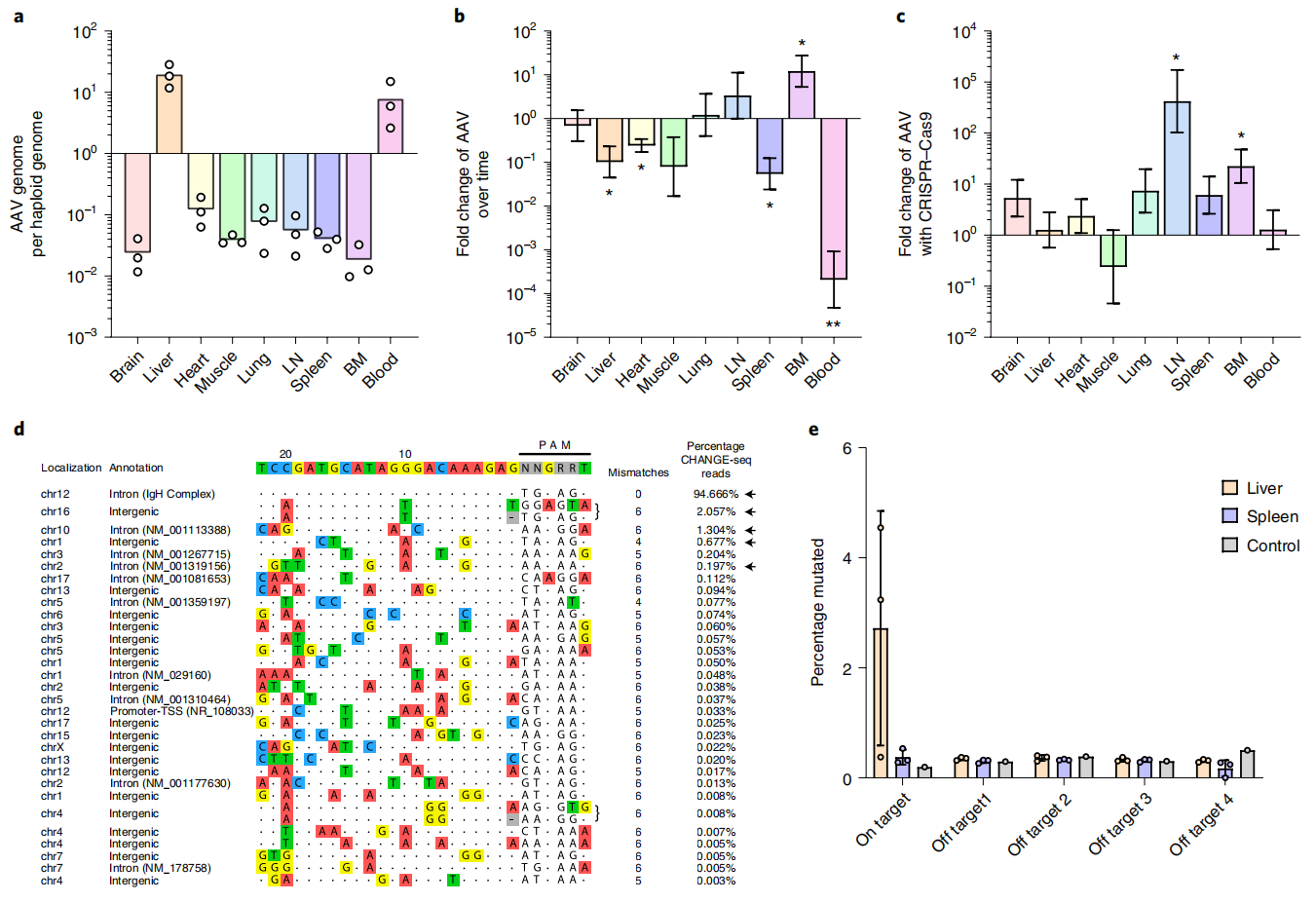
图四 AAV的组织分布和saCas9脱靶效应分析显示高安全性[3]
最后,为了进一步提高基因编辑的组织特异性和安全性,研究者将第一个质粒的Cas9启动子更换成B细胞特异的CD19启动子,并将sgRNA放在第二个KI donor质粒上(图五a)。这样可保证在B细胞中才能启动Cas9的表达,并且仅有同时感染了两种AAV病毒的B细胞才会发生靶位点切割和基因组KI。采用升级后的AAV进行实验(图五b),同样可在小鼠血液中检测到高浓度的中和抗体3BNC117(图五c),以及中和抗体分泌细胞的增多(图五d和e)。在注射两种AAV基因改造3天后,虽然在肝脏和血液中的Cas9转导效率相似,但升级后Cas9的表达在肝脏中显著降低(图五f-h)。经TIDE分析靶位点切割情况,可见由CD19启动子驱动Cas9的表达可显著减少肝脏的靶位点切割(图五i)。以上结果证明,质粒优化后使得该系统组织特异性更高,安全性升级。
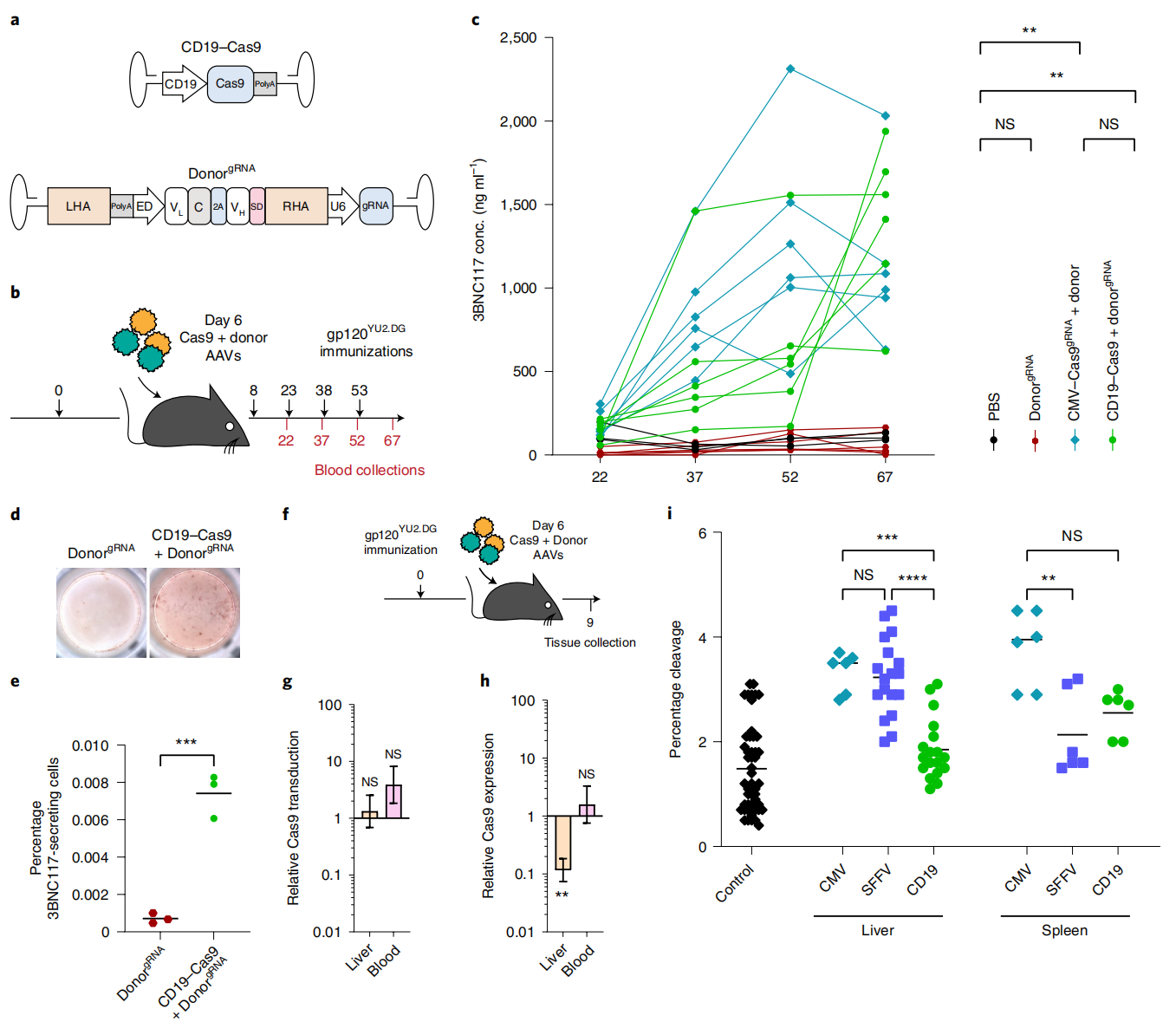
图五 系统优化使得基因改造特异性更高且安全性升级[3]
综上所述,利用AAV递送CRISPR-Cas9基因编辑系统直接体内基因改造B细胞,使其产生所需的中和抗体3BNC117来有效应对HIV病毒的感染,是一种治疗艾滋病的新型基因疗法。该基因疗法不仅避免了细胞治疗ex vivo方式的复杂操作,大大节约了生产工艺成本,还使得仅通过一针AAV注射即可实现长期抑制HIV病毒。另外,相比其他艾滋病治疗方式,该基因疗法具有操作简便、疗效持久的优势,可使患者长期受益。此外,该基因疗法应用拓展性强,可快速开发用于其他疾病的治疗。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献:
1. Deeks SG, Lewin SR, Havlir DV: The end of AIDS: HIV infection as a chronic disease. Lancet 2013, 382(9903):1525-1533.
2. Sneller MC, Blazkova J, Justement JS, Shi V, Kennedy BD, Gittens K, Tolstenko J, McCormack G, Whitehead EJ, Schneck RF et al: Combination anti-HIV antibodies provide sustained virological suppression. Nature 2022, 606(7913):375-381.
3. Nahmad AD, Lazzarotto CR, Zelikson N, Kustin T, Tenuta M, Huang D, Reuveni I, Nataf D, Raviv Y, Horovitz-Fried M et al: In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature biotechnology 2022.
4. Nahmad AD, Raviv Y, Horovitz-Fried M, Sofer I, Akriv T, Nataf D, Dotan I, Carmi Y, Burstein D, Wine Y et al: Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature communications 2020, 11(1):5851.



