技术分享:表观遗传基因治疗可缓解青春期过度饮酒造成的酒精依赖症和焦虑
Tips:在“CRISPRa和CRISPRi的人原代T细胞筛选系统”技术分享中,我们介绍了利用CRISPRa激活系统和CRISPRi抑制系统进行人原代T细胞的大规模筛选,以获得细胞治疗新靶点。本期我们将介绍CRISPR/dCas9表观遗传激活系统作为一种新型治疗手段在表观遗传基因治疗中的临床前研究。
酒精依赖症(alcohol use disorder,AUD),也被称作酒精使用障碍,其产生原因并不清晰,仍无有效的治疗措施[1, 2]。青春期是大脑成熟的关键时期,这一时期过度饮酒会增加成年后罹患AUD以及焦虑等精神疾病的易感性[3, 4]。调节AUD和焦虑的关键脑区在中央杏仁核(CeA)[2]。有研究报道,青春期过度饮酒会导致ARC基因上游的SARE增强子区受到表观遗传抑制,使得ARC在人类和啮齿动物的CeA中表达下调。其中,ARC是大脑可塑性的关键调节因子,可以对突触活动作出迅速且有力的反应[5, 6]。以上研究均是相关性研究,ARC基因SARE增强子的表观遗传抑制与青春期过度饮酒造成AUD之间的因果关系还未被证明。
2022年5月,Science Advances上发表了一篇文章,证明了表观遗传抑制与AUD表型之间的因果关系。研究者利用CRISPR/dCas9基因编辑工具特异性操纵大鼠Arc基因SARE增强子上的组蛋白乙酰化或甲基化修饰谱式,可直接调节大鼠的AUD和焦虑表型[7]。
研究者首先验证恢复Arc基因SARE增强子上的组蛋白乙酰化修饰能否缓解青春期过度饮酒造成的AUD和焦虑表型。利用无DNA切割活性的Cas9(dCas9,D10A和H840A突变)融合组蛋白乙酰转移酶P300,构建dCas9-P300表观遗传激活系统(图一A)。并针对Arc基因SARE增强子区设计了4条sgRNA(图一B),从而招募dCas9-P300结合到sgRNA靶向位点,使得靶位点附近的组蛋白乙酰化修饰增多,实现增强靶基因的表达。为了模拟10-18岁的人类青春期,研究者选择28-41天龄的大鼠进行青春期间歇性酒精暴露(AIE)实验,对照组大鼠腹腔注射生理盐水(AIS)。AIE或AIS造模后,将dCas9-P300和sgRNA慢病毒定位注入双侧CeA中,14天后进行表型和生理分析(图一C),可在注射大鼠的CeA中检测到dCas9-P300和sgRNA的高表达(图一D)。
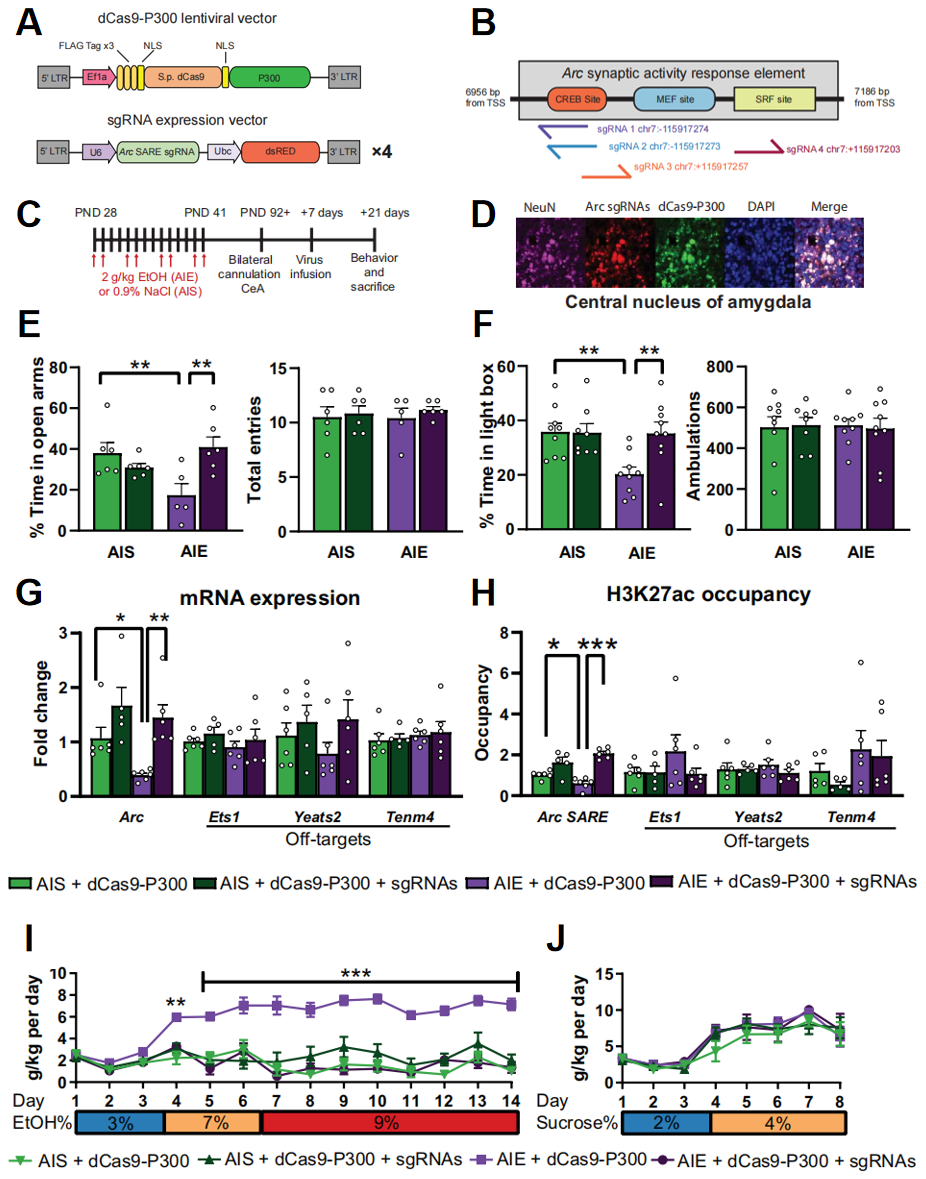
图一 注射dCas9-P300与sgRNAs后可改善AIE大鼠的AUD和焦虑表型[7]
在评价啮齿动物焦虑指数的高架十字迷宫(EPM)行为学实验中,AIE仅注射dCas9-P300组的大鼠在相同统计次数中进入开放臂次数比例(OE%)明显降低,表现出焦虑反应;而AIE同时注射dCas9-P300和sgRNA组的大鼠可缓解这一焦虑反应,并恢复到正常水平(图一E)。另一个明暗箱(LDB)行为学实验也能获得相同结论(图一F)。此外,AIE仅注射dCas9-P300组的大鼠表现出AUD表型的嗜酒偏好性,而AIE同时注射dCas9-P300和sgRNA组大鼠的酒精摄入量则恢复正常(图一I)。同时,各组大鼠的蔗糖摄入量没有区别(图一J)。经检测,AIE同时注射dCas9-P300和sgRNA组大鼠确实恢复了Arc的表达以及SARE增强子上的H3K27ac修饰,并且对预测的脱靶位点没有显著影响(图一G和H)。以上结果表明利用dCas9-P300表观遗传激活系统可恢复Arc基因SARE增强子上的组蛋白乙酰化修饰,进而缓解青春期过度饮酒造成的AUD和焦虑表型。
接下来,研究者进一步验证抑制Arc基因SARE增强子上的表观遗传修饰能否直接造成AUD和焦虑表型。将dCas9与Kox1的转录阻遏物结构域KRAB相融合,构建dCas9-KRAB表观遗传抑制系统(图二A)。将dCas9-KRAB和sgRNA慢病毒定位注入野生型大鼠的双侧CeA中,14天后进行表型和生理分析(图二B),同样可在CeA中检测到dCas9-KRAB和sgRNA的高表达(图二C)。在EPM和LDB行为学实验中,注射dCas9-KRAB和sgRNA组相比野生型大鼠表现出焦虑反应(图二D和E),以及AUD表型的嗜酒偏好性(图二H),同样地对蔗糖摄入量没有影响(图二I)。经检测,注射dCas9-KRAB和sgRNA组大鼠的Arc表达被下调,SARE增强子上的抑制性组蛋白修饰H3K27me3增多,同样对预测的脱靶位点没有显著影响(图二F和G)。这些数据进一步证明了Arc基因SARE增强子上的表观遗传抑制可直接导致焦虑和AUD表型。
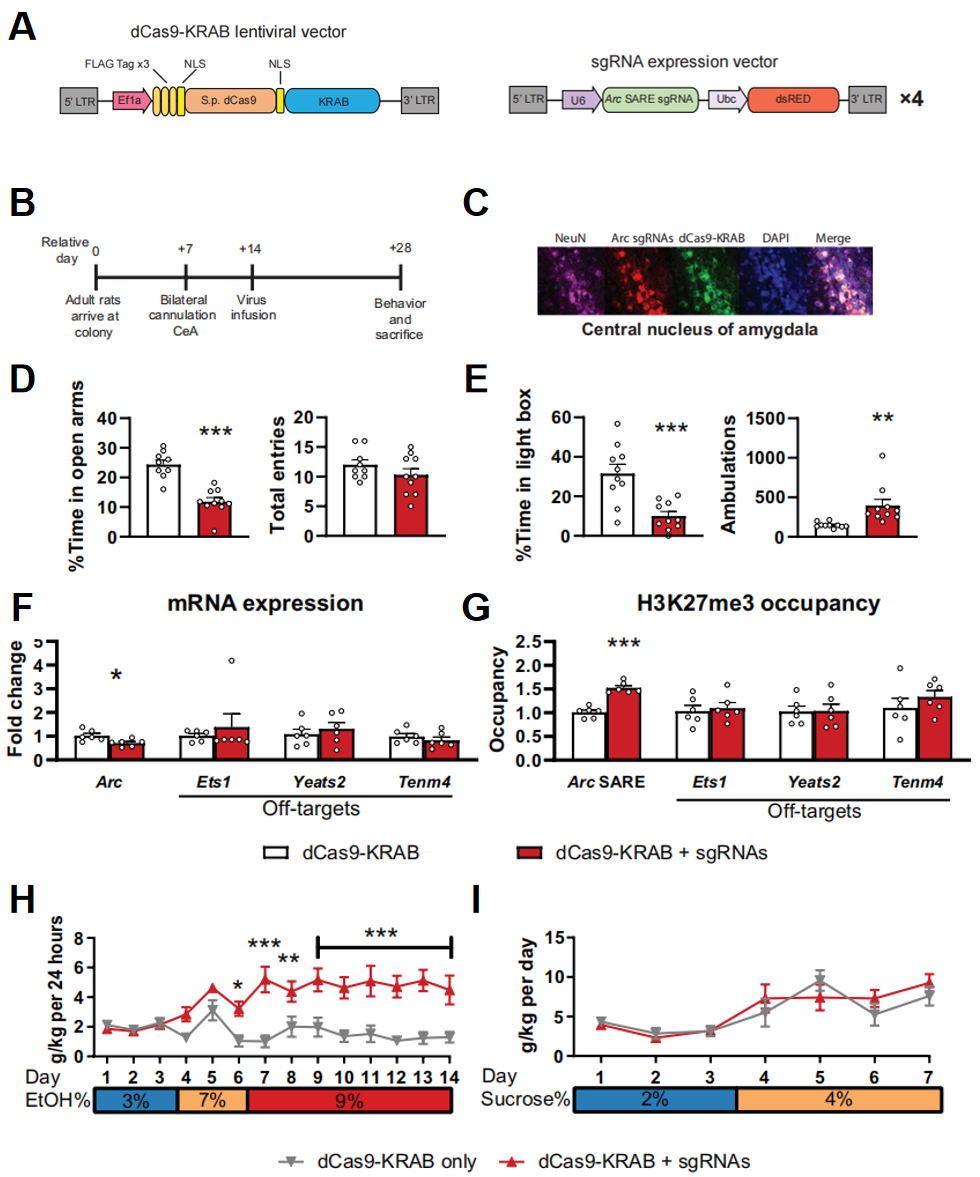
图二 注射dCas9-KRAB与sgRNAs后可直接诱导AUD和焦虑表型[7]
综上所述,利用基于CRISPR/dCas9的表观遗传激活或抑制系统,可操纵靶位点Arc基因SARE增强子上的组蛋白乙酰化或甲基化表观遗传修饰谱式,从而双向调节青春期过度饮酒造成的酒精依赖症(AUD)和焦虑表型。该研究证明了Arc基因SARE增强子上的表观遗传修饰与AUD和焦虑表型的直接因果关系,并在临床前研究中证明了表观遗传基因治疗可作为一种新型疗法,用于治疗青春期过度饮酒造成的AUD和焦虑症状。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Witkiewitz K, Litten RZ, Leggio L: Advances in the science and treatment of alcohol use disorder. Sci Adv 2019, 5(9).
2. Koob GF: Drug Addiction: Hyperkatifeia/Negative Reinforcement as a Framework for Medications Development. Pharmacol Rev 2021, 73(1):163-201.
3. Kyzar EJ, Floreani C, Teppen TL, Pandey SC: Adolescent Alcohol Exposure: Burden of Epigenetic Reprogramming, Synaptic Remodeling, and Adult Psychopathology. Front Neurosci-Switz 2016, 10.
4. Spear LP: Effects of adolescent alcohol consumption on the brain and behaviour. Nat Rev Neurosci 2018, 19(4):197-214.
5. Kyzar EJ, Zhang HB, Pandey SC: Adolescent Alcohol Exposure Epigenetically Suppresses Amygdala Arc Enhancer RNA Expression to Confer Adult Anxiety Susceptibility. Biol Psychiat 2019, 85(11):904-914.
6. Bohnsack JP, Teppen T, Kyzar EJ, Dzitoyeva S, Pandey SC: The lncRNA BDNF-AS is an epigenetic regulator in the human amygdala in early onset alcohol use disorders. Transl Psychiat 2019, 9.
7. Bohnsack JP, Zhang H, Wandling GM, He D, Kyzar EJ, Lasek AW, Pandey SC: Targeted epigenomic editing ameliorates adult anxiety and excessive drinking after adolescent alcohol exposure. Science advances 2022, 8(18):eabn2748.



