技术分享:CRISPR-Cas9系统的抑制自我免疫新机制——tracr-L
Tips:在“新型调控sgRNA活性的CRISPR-Switch系统”的技术分享中我们介绍了通过对sgRNA中的crRNA与tracrRNA序列的改造实现精准调控sgRNA表达,本期将分享一种天然存在的tracr-L对CRISPR-Cas9系统的自我调节作用。
CRISPR-Cas系统是细菌和古生菌应对病毒[1]、质粒[2]等外源入侵因子的获得性免疫防御。生理状态下,所有的免疫系统都具有区分“自我”和“非自我”的能力,CRISPR-Cas系统能高效杀伤这些外源入侵因子已被人们熟知,然而对于该系统是如何被调控避免引起自身免疫反应机制的了解仍知之甚少。
2021年1月的一篇Cell文章中,研究者发现了酿脓链球菌(Streptococcus pyogenes)中天然存在一种tracr-L,它能招募Cas9结合到Cas9自身启动子上,抑制Cas9启动子活性和表达,从而降低CRISPR-Cas9的活性,实现对CRISPR-Cas9系统的自我调节,避免CRISPR-Cas系统高表达引起的自身免疫反应[3]。
首先,研究者利用转座子突变测序(Tn-seq)的方法来筛选可以增强CRISPR-Cas9活性的重要元件,发现在tracr-L的5'端和启动子的多个转座子插入突变均能显著增强CRISPR-Cas9活性,从而增强宿主对噬菌体的抗性(图一B)。在酿脓链球菌中,tracrRNA由2种启动子分别转录形成长的tracr-L和短的tracr-S形式[4](图一A)。单一的tracr-S能发挥剪切功能,而tracr-L的功能尚不明确。为了研究tracr-L的作用,研究人员构建一个原始CRISPR-Cas质粒(图一A),然后敲除tracr-L的启动子52 bp序列和5’端的19个核苷酸,生成Δtracr-L(图一B)。值得注意的是,与筛选获得转座子插入的tracr-L::Tn突变体或者之前报道的hcas9突变体相比[5],Δtracr-L增强了宿主对噬菌体ΦNM4γ4的抗性,提高了约30倍,相比野生型系统增强了3000倍以上(图一C和D)。另外,进一步对tracr-L进行两个点突变的tracr-L*,虽然破坏了tracr-S的表达,但是不能恢复Δtracr-L的高免疫性(图一E)。以上结果表明,Δtracr-L起到功能失活的作用,并且是tracr-L抑制了CRISPR-Cas的活性。
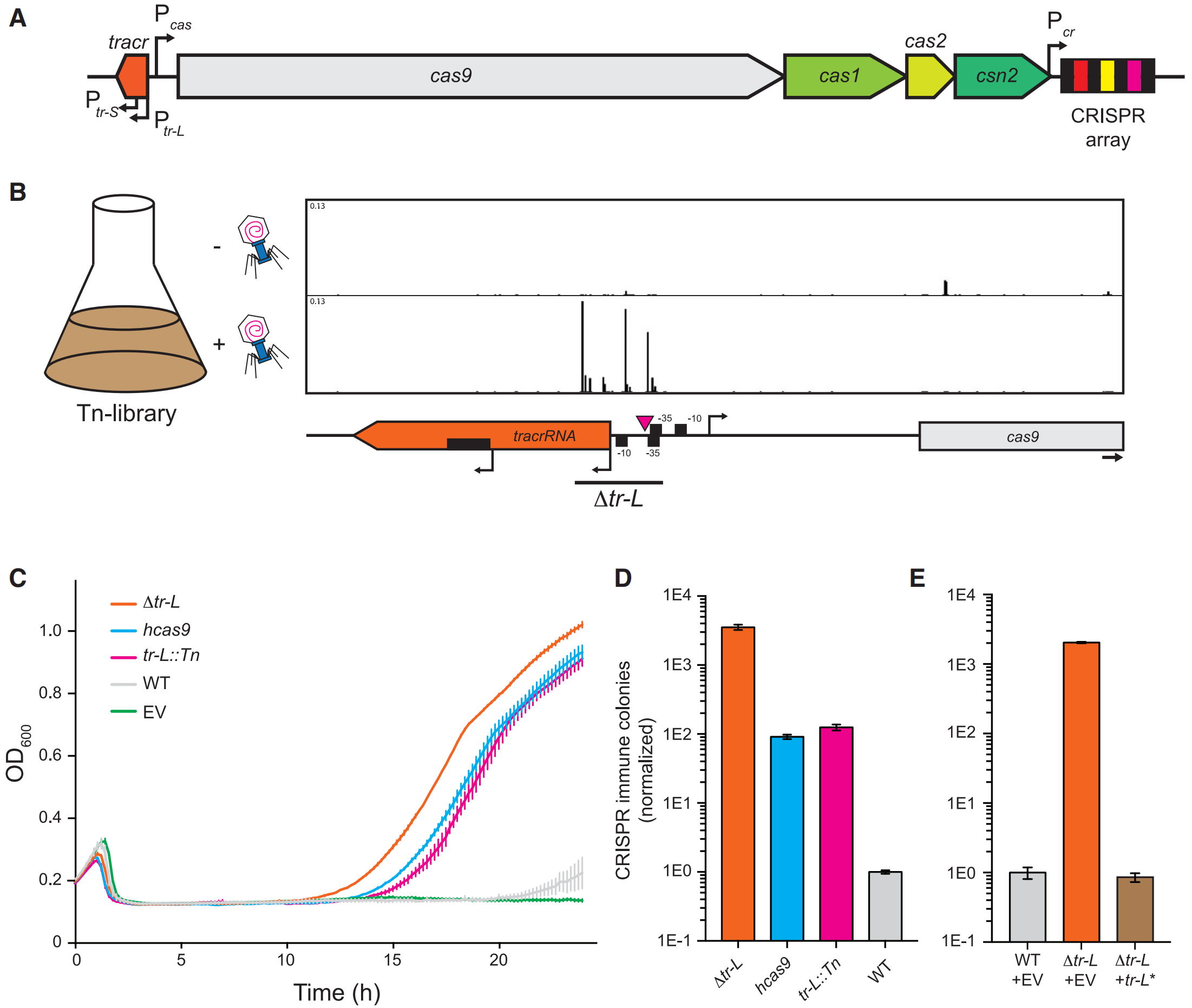
图一 Δtracr-L增强CRISPR-Cas的免疫活性[3]
接下来,研究者从以下三个方面证明tracr-L的抑制作用。第一方面,研究者将四种CRISPR-Cas启动子的质粒分别与GFP融合,检测启动子的表达活性。发现表达Cas9和tracrRNA的细胞与空载对照组相比可显著抑制Pcas活性约50倍,但是不影响其他启动子的活性(图二A)。在表达Cas9和tracr-S(图二B)或单独表达Cas9(图二C)的细胞中未观察到Pcas-GFP的活性抑制,这表明特异性抑制Pcas需要tracr-L的参与。
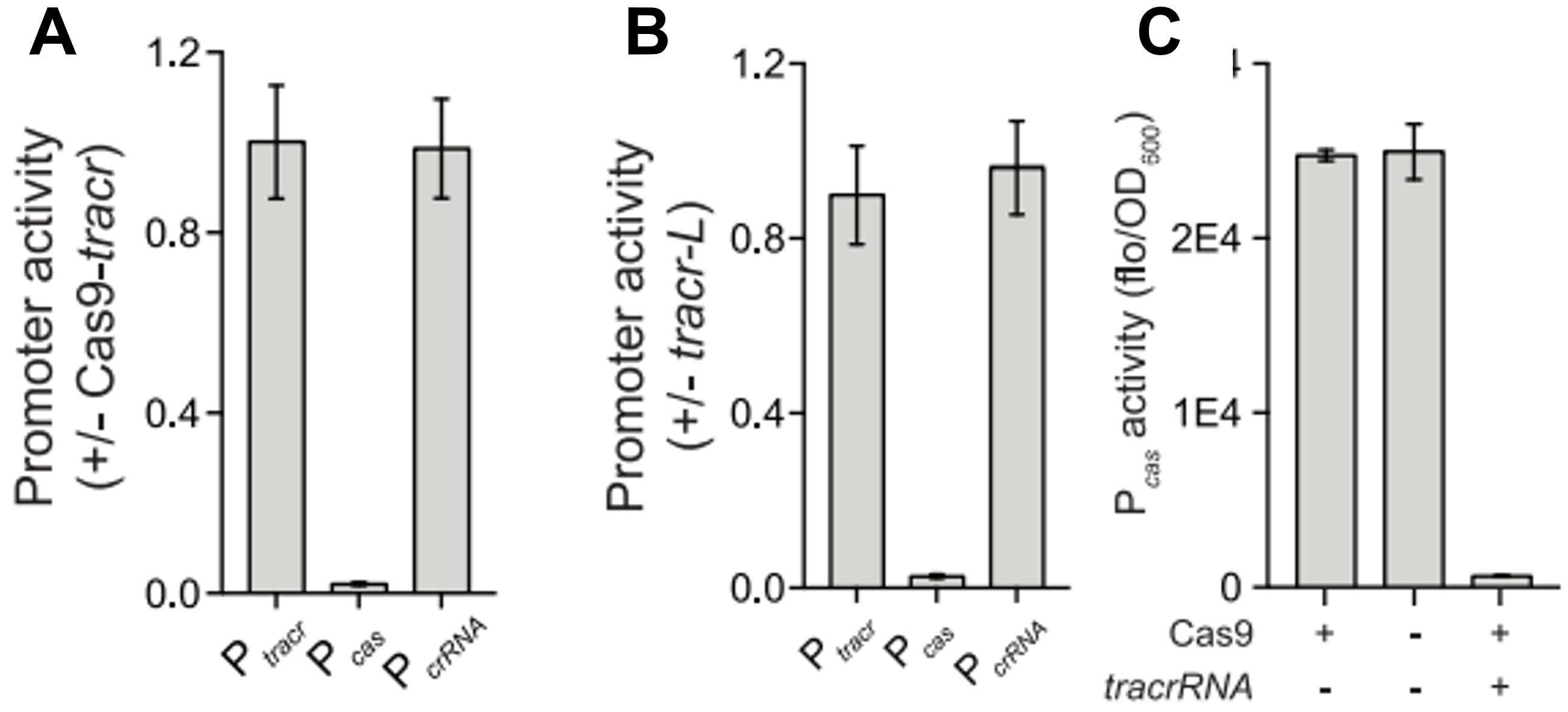
图二 GFP融合启动子的活性检测[3]
第二方面,研究者用纯化的Cas9、体外转录的tracr-L和Pcas DNA,通过凝胶迁移实验证明,Cas9: tracr-L与Pcas结合的亲和力约1.6 nM,远高于单一Cas9结合Pcas的组合或Cas9: tracr-L结合非靶向dsDNA的组合(图三)。表明Cas9:tracr-L可以形成一种高亲和的抑制复合物作用于Pcas DNA。
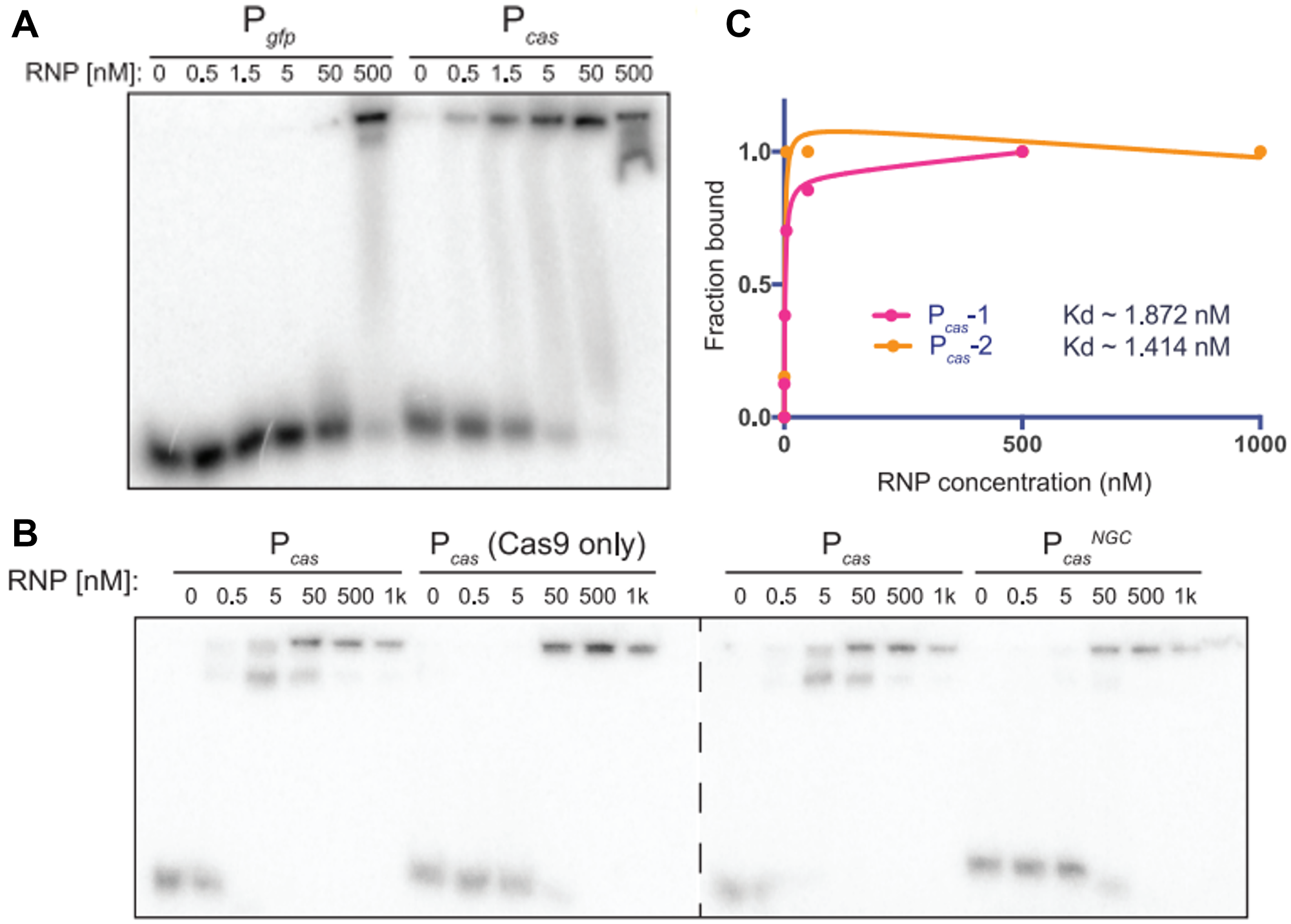
图三 Cas9: tracr-L与Pcas结合的亲和力验证[3]
第三方面,研究者发现tracr-L的5’ 端和Pcas转录起始位点(TSS)的下游2 bp之间存在11个核苷酸的序列匹配(图四A,红色序列),并且存在5’-NGG-3’ PAM的结构序列。研究者通过突变Pcas或者tracr-L的碱基位点,观察其匹配位点的改变是否会影响抑制作用。在对Pcas序列的突变中,发现PAM序列的突变以及结合序列11 bp中9个碱基的突变,都会显著破坏tracr-L对Pcas活性的抑制(图四B)。在对tracr-L序列的突变中,发现破坏tracr-L结构稳定的突变(图四A和C的绿色、蓝色、橙色和粉色序列),均会显著破坏tracr-L对Pcas活性的抑制,这可能是由于破坏了tracr-L与Cas9的结合;对11 bp结合序列的突变(图四A和C的红色序列)同样也显著破坏tracr-L对Pcas活性的抑制。以上结果表明tracr-L可以形成一种天然的sgRNA,引导Cas9的结合从而抑制其自身启动子的活性。
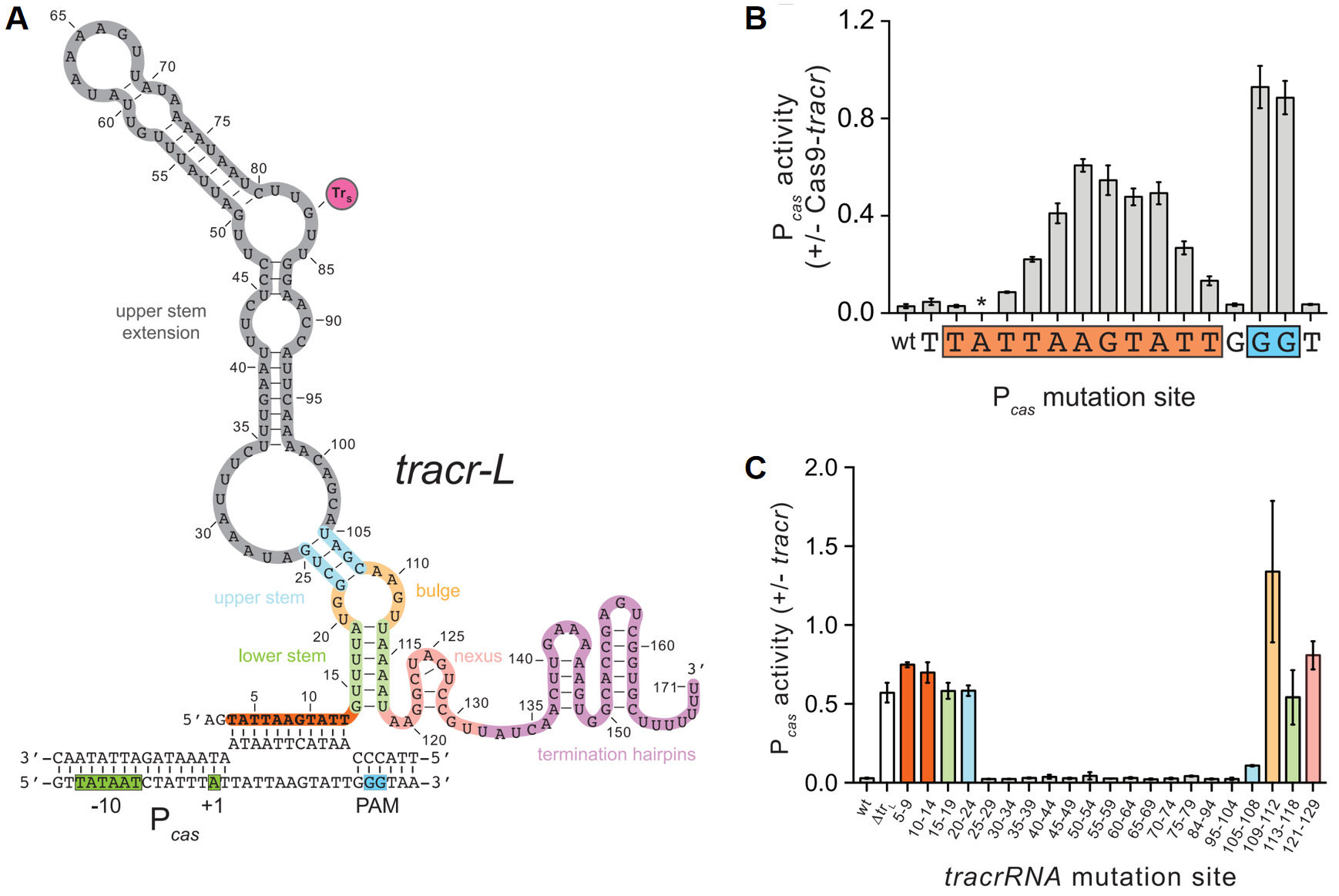
图四 tracr-L引导Cas9抑制其自身的启动子[3]
在野生型细胞中,tracr-L将CRISPR-Cas系统维持在低活性状态。在缺乏噬菌体的情况下,与野生型相比,Δtracr-L细胞中有更多的自我靶向类型[6]。为了判断CRISPR-Cas的过量表达是否会导致生长缺陷,研究人员对野生型和Δtracr-L细胞进行了比较,发现2天后Δtracr-L细胞数量下降到原始数量的3%。表明tracr-L可以通过抑制CRISPR系统的活性来避免引起自身免疫反应。并且生物信息学分析也表明这种tracr-L介导的Pcas的活性调控在II-A型CRISPR-Cas系统中广泛存在。
综上所述,天然存在的tracr-L可折叠成一个sgRNA,直接招募Cas9的结合,靶向抑制Cas9自身启动子的活性,从而维持CRISPR-Cas系统的稳态,避免引发自身免疫性反应。后续tracr-L可以被重编程设计靶向目标启动子,并与多个经典sgRNAs结合使用,从而实现在切割一个位点的同时转录抑制另一个位点。此外,tracr-L对Pcas的抑制调节作用可以用来缓冲Cas9的表达水平从而减轻CRISPR-Cas系统的脱靶效应。未来tracr-L有望成为新一代CRISPR-Cas系统工具,为sgRNA的多元化发展描绘蓝图。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P: CRISPR provides acquired resistance against viruses in prokaryotes. Science 2007, 315(5819):1709-1712.
2. Marraffini LA, Sontheimer EJ: CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA. Science 2008, 322(5909):1843-1845.
3. Workman RE, Pammi T, Nguyen BTK, Graeff LW, Smith E, Sebald SM, Stoltzfus MJ, Euler CW, Modell JW: A natural single-guide RNA repurposes Cas9 to autoregulate CRISPR-Cas expression. Cell 2021, 184(3):675-688.
4. Deltcheva E, Chylinski K, Sharma CM, Gonzales K, Chao Y, Pirzada ZA, Eckert MR, Vogel J, Charpentier E: CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature 2011, 471(7340):602-607.
5. Heler R, Wright AV, Vucelja M, Bikard D, Doudna JA, Marraffini LA: Mutations in Cas9 Enhance the Rate of Acquisition of Viral Spacer Sequences during the CRISPR-Cas Immune Response. Molecular cell 2017, 65(1):168-175.
6. Modell JW, Jiang WY, Marraffini LA: CRISPR-Cas systems exploit viral DNA injection to establish and maintain adaptive immunity. Nature 2017, 544(7648):101-104.



