技术分享:小胶质细胞特异性研究的Hexb工具鼠
Tips:在“谱系示踪CD4+常规T细胞的小鼠模型构建”的技术分享中,我们介绍了特定免疫细胞CD4+常规T细胞的谱系示踪工具鼠,本期将分享小胶质细胞特异性研究的工具鼠。
存在于中枢神经系统(CNS)中的髓细胞是一类异质性的先天免疫细胞,对维持器官稳态至关重要。其中,小胶质细胞和中枢神经系统相关的巨噬细胞(CAMs),几乎与所有CNS疾病相关[1, 2]。它们所处位置不同且功能不同:脑实质小胶质细胞位于白质,对皮质神经元[3]和少突胶质细胞[4]起着支持作用;而CAMs位于CNS界面,负责维护边界的完整性。尽管如此,它们在个体遗传学上密切相关共享一些生理谱系特征,包括发育起源、细胞增殖过程以及髓细胞标志物如Cx3cr1的表达等[5, 6]。然而,由于缺乏合适的工具来区分,人们对小胶质细胞和CAMs的特异性细胞类型特征知之甚少。
2020年6月,Nature Immunology上发表了用于小胶质细胞特异性研究的Hexb工具小鼠[7]。研究者采用大规模平行性单细胞测序挖掘生理以及病理过程中的小胶质细胞和CAMs的关键特征,发现Hexb的表达既能高度局限于小胶质细胞,又能在4种不同疾病模型中稳定表达,同时在CAMs中不表达,因而选取Hexb作为小胶质细胞的核心基因。研究者后续基于Hexb开发了两种工具小鼠用于小胶质细胞特异性的研究。
首先是构建HexbtdTomato小鼠,研究者通过CRISPR/Cas9技术,将T2A-tdTomato基因盒定点插入在内源性Hexb基因的终止密码前,使得表达Hexb的细胞同时表达tdTomato(tdT)红色荧光蛋白(图一a)。在HexbtdT/tdT小鼠的生理状态下,免疫荧光染色及3D重构结果显示几乎所有CNS不同区域的Iba1+小胶质细胞都被标记成红色,且在非Iba1+细胞中没有检测到任何异位tdT表达(图一b-d)。相比之下,Cx3cr1GFP/+小鼠的GFP+细胞不仅标记了小胶质细胞,还标记了血管周围巨噬细胞(pvMΦ)和软脑膜下巨噬细胞(mMΦ)(图一e)。
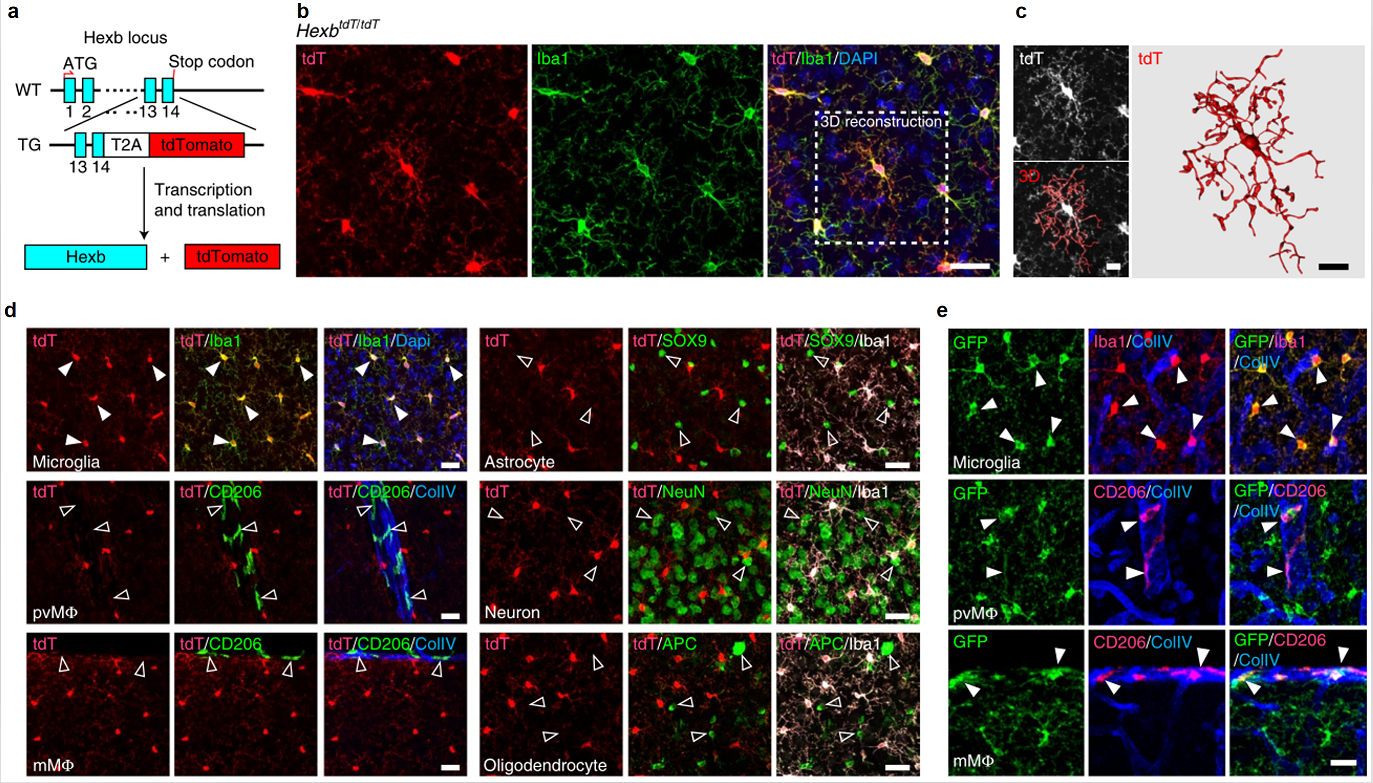
图一 HexbtdTomato小鼠的构建与小胶质细胞标记检测[7]
研究者进一步分析HexbtdTomato小鼠在CNS病理状态下tdT信号的稳定性与特异性。将HexbtdT/+Cx3cr1GFP/+小鼠实施单侧面神经轴突切断术模拟神经变性,结果显示损伤一周后,tdT信号仍然局限于小鼠脑实质小胶质细胞,且损伤区域的tdT阳性细胞增多(图二a-b,实心黄色三角形)。另外,在自身免疫性脑脊髓炎的HexbtdT/+小鼠中,tdT表达也仅限于Iba1+CD206–的脑实质小胶质细胞(图二c-d,黄色箭头);在炎症CNS中还发现tdT–Iba1+的细胞,经检测确认多数为Ly6C+细胞,推测是浸润的髓细胞(图二e)。以上结果表明,生理和病理条件下HexbtdTomato小鼠中的小胶质细胞均能高效且特异地被tdT标记,该小鼠模型可用于追踪研究小胶质细胞的在体行为轨迹。
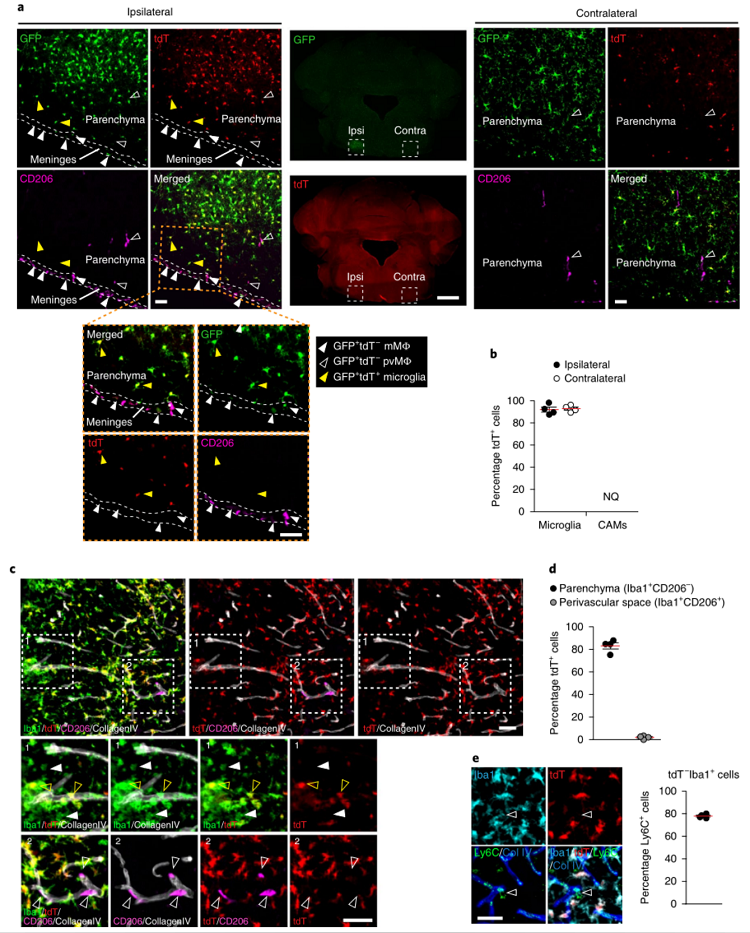
图二 病理条件下HexbtdTomato小鼠的小胶质细胞标记检测[7]
其次是构建HexbCreERT2小鼠,研究者通过CRISPR/Cas9技术,将CreERT2基因盒定点插入在内源性Hexb基因的终止密码前,使得表达Hexb的细胞同时表达CreERT2蛋白(图三a)。CreERT2通常定位于细胞质中,只有在他莫昔芬(TAM)诱导后CreERT2才会进入细胞核,从而识别loxP位点发生基因重组。因此HexbCreERT2小鼠可用于小胶质细胞的诱导型功能研究。将HexbCreERT2小鼠与报告基因小鼠R26yfp/yfp进行交配,在阳性子代出生后第一天和第三天(P1和P3)分别注射TAM,P42小鼠经检测发现仅有小胶质细胞表达YFP荧光蛋白(图三b)。结果表明TAM诱导的HexCrbeERT2小鼠可以在长时间内对小胶质细胞产生高频、稳定的遗传修饰,并且CAMs不受影响。
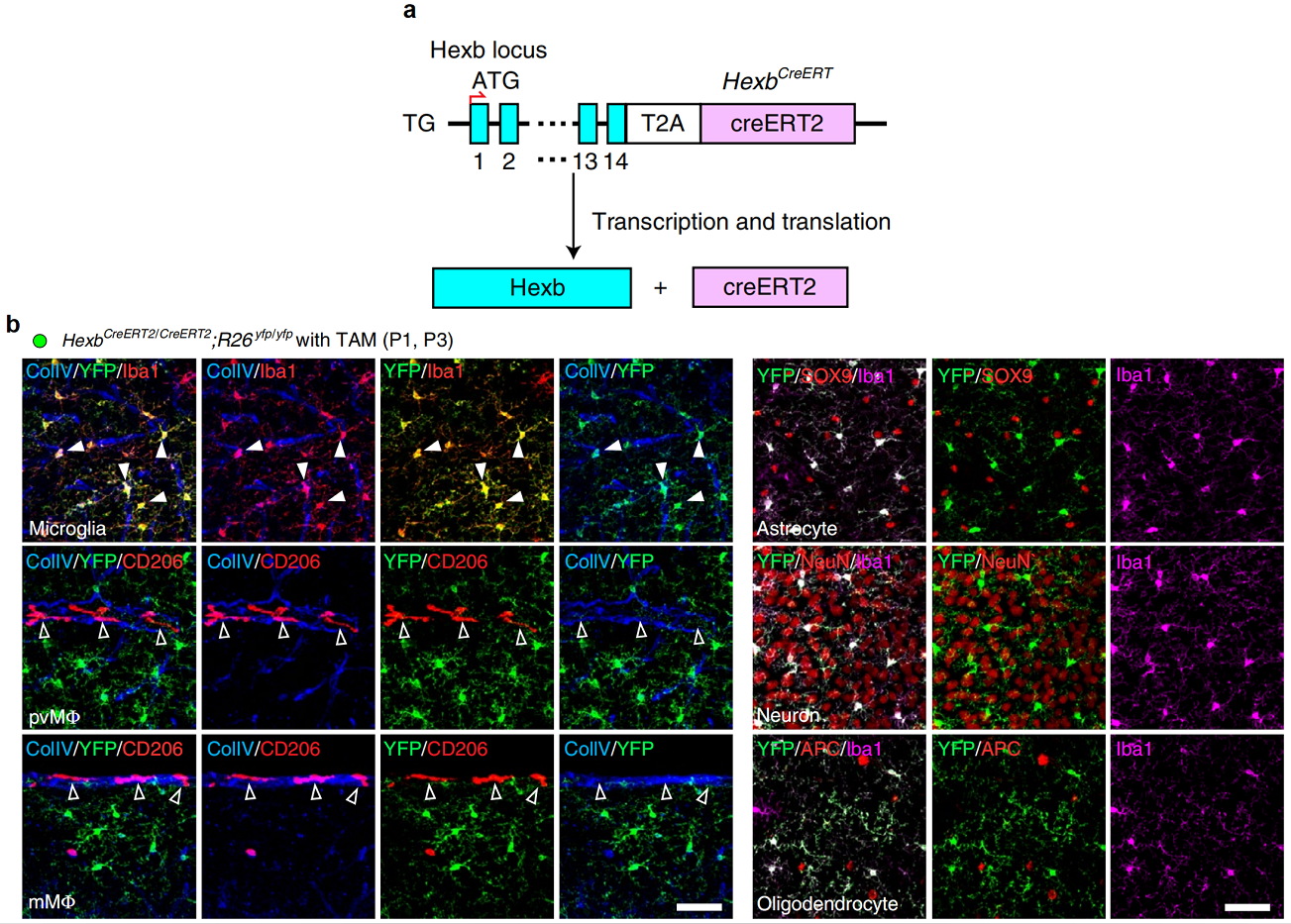
图三 HexbCreERT2小鼠的小胶质细胞特异性基因重组[7]
综上所述,在生理和病理状态下脑实质小胶质细胞均能特异性表达Hexb基因,使得HexbtdTomato小鼠和HexbCreERT2小鼠可分别用于小胶质细胞的特异性标记和基因重组,为探索小胶质细胞的特征开辟了新途径。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂的调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Priller J, Prinz M: Targeting microglia in brain disorders. Science 2019, 365(6448):32-33.
2. Prinz M, Jung S, Priller J: Microglia Biology: One Century of Evolving Concepts. Cell 2019, 179(2):292-311.
3. Ueno M, Fujita Y, Tanaka T, Nakamura Y, Kikuta J, Ishii M, Yamashita T: Layer V cortical neurons require microglial support for survival during postnatal development. Nat Neurosci 2013, 16(5):543-551.
4. Hagemeyer N, Hanft KM, Akriditou MA, Unger N, Park ES, Stanley ER, Staszewski O, Dimou L, Prinz M: Microglia contribute to normal myelinogenesis and to oligodendrocyte progenitor maintenance during adulthood. Acta Neuropathol 2017, 134(3):441-458.
5. Bruttger J, Karram K, Wörtge S, Regen T, Marini F, Hoppmann N, Klein M, Blank T, Yona S, Wolf Y et al: Genetic Cell Ablation Reveals Clusters of Local Self-Renewing Microglia in the Mammalian Central Nervous System. Immunity 2015, 43(1):92-106.
6. Goldmann T, Wieghofer P, Jordão MJ, Prutek F, Hagemeyer N, Frenzel K, Amann L, Staszewski O, Kierdorf K, Krueger M et al: Origin, fate and dynamics of macrophages at central nervous system interfaces. Nat Immunol 2016, 17(7):797-805.
7. Masuda T, Amann L, Sankowski R, Staszewski O, Lenz M, P DE, Snaidero N, Costa Jordao MJ, Bottcher C, Kierdorf K et al: Novel Hexb-based tools for studying microglia in the CNS. Nature immunology 2020, 21(7):802-815.



