技术分享:谱系示踪CD4+常规T细胞的小鼠模型构建
Tips:在“一个集合Vika、Flp、Dre和Cre重组系统的报告基因小鼠模型”的技术分享中,我们介绍了四种位点特异性重组酶(SSR)系统,本期将分享利用SSR系统的组合来进行特定免疫细胞的谱系示踪。
细胞谱系示踪是指利用各种方式来标记特定细胞群体,从而追踪观察该细胞群体及其后代所有细胞的生命活动。位点特异性重组酶(SSR)系统的开发,极大拓宽了细胞谱系示踪的应用范围及其研究。早期T细胞在胸腺的发育过程是由CD4和CD8双阴性(CD4-CD8-)细胞,分化成CD4和CD8双阳性(CD4+CD8+)细胞,最终分化为成熟的CD4或CD8单阳性(CD4+或CD8+)T细胞,从而进入外周血定居于外周免疫器官中[1]。在成熟的CD4+ T细胞中,包含常规T细胞(Tconv)和调节性T细胞(Treg)两种细胞亚群,其中调节性T细胞(Treg)可用Foxp3来特异性示踪[2],而Tconv由于缺乏特定标志物难以被谱系示踪。
2021年10月,Immunity杂志上报导了一种可用于CD4+ Tconv细胞谱系示踪的研究工具,即CD4conviCreERT2-hCD2小鼠模型,巧妙利用FlpO-Frt和Cre-loxP两种SSR系统,在标记了成熟CD4+ T细胞的基础上排除了Foxp3+ Treg细胞,从而实现特异性标记CD4+ Foxp3- 的Tconv细胞群体[3]。
首先,如何来标记成熟的CD4+ T细胞呢?由于CD4+ T细胞和CD8+ T细胞享有共同的发育通路,所以无法简单用CD4来特异性标记CD4+ T细胞。在定向分化为CD4+ T细胞的过程中需要一个关键的转录因子ThPOK,它由Zbtb7b基因编码,能促进CD4和CD8双阳性T细胞定向分化为CD4+ T细胞,同时抑制分化为CD8+ T细胞的基因表达[4]。另外,Zbtb7b沉默子是一种顺式调节元件,通过抑制Zbtb7b基因的表达来促进双阳性T细胞定向分化成CD8+ T细胞[5]。利用这一特点,前期有研究者开发了一种ThPOK-Cre工具鼠,仅在表达了ThPOK的CD4+ T细胞中才会启动Cre重组酶和人源CD2的过表达(图一)[5]。
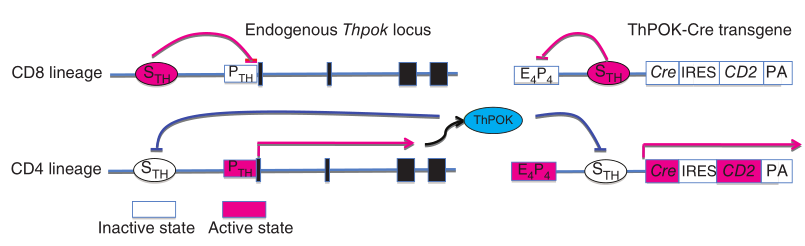
图一 ThPOK-Cre工具鼠的工作原理[5]
本文研究者将ThPOK-Cre工具鼠改造成ThPOKF/F.iCreERT2.hCD2,将Cre替换成他莫西芬诱导的iCreERT2元件,并在iCreERT2-hCD2元件的两侧插入Frt位点(图二B)[3]。ThPOKF/F.iCreERT2.hCD2小鼠在他莫西芬诱导下仅在CD4+ T细胞中启动Cre重组酶和人源CD2的过表达(图二C)。该小鼠为转基因小鼠,随机整合在13号染色体上。
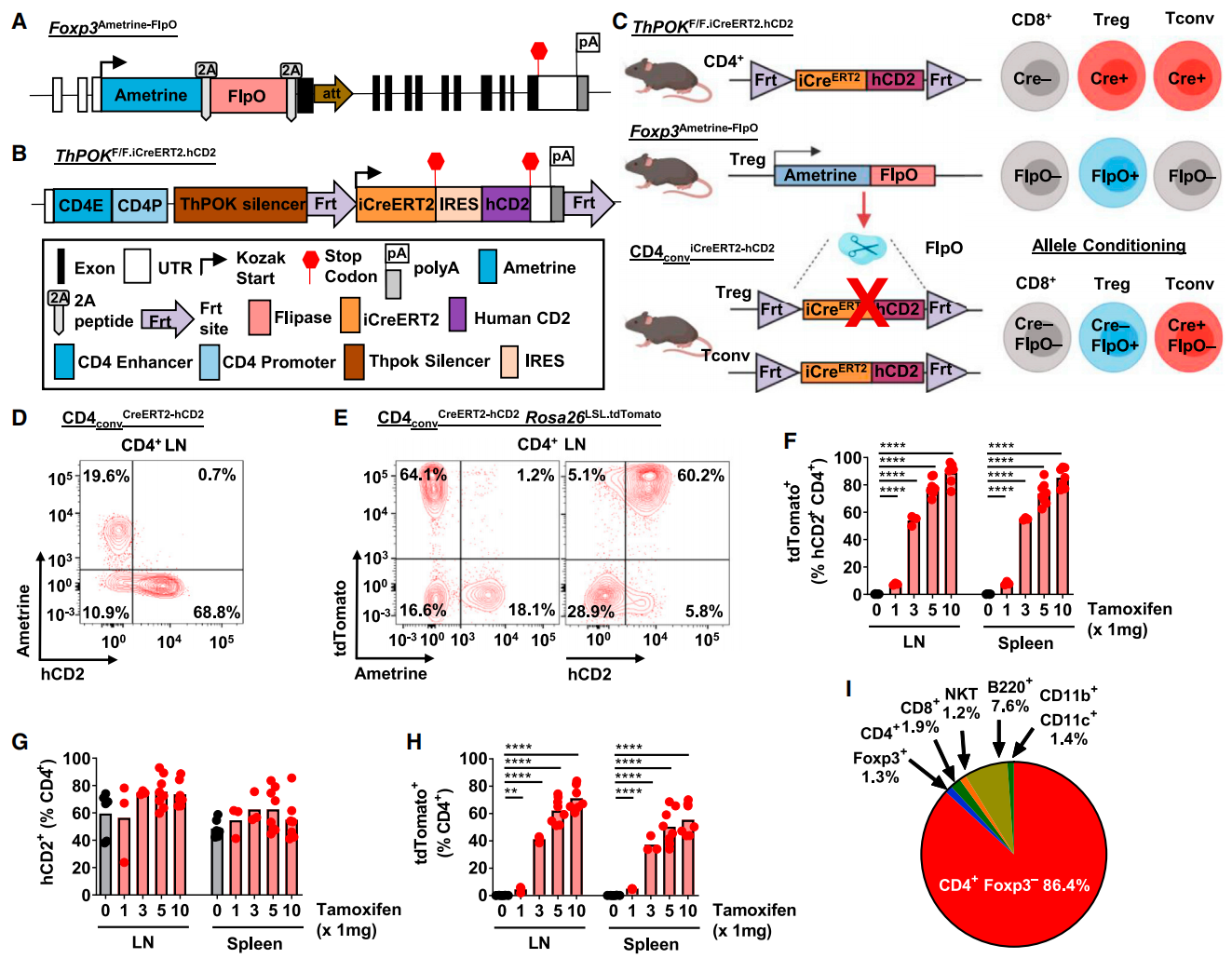
图二 CD4conviCreERT2-hCD2小鼠的构建与验证[3]
接着研究者构建了指示Foxp3+ Treg细胞的Foxp3Ametrine-FlpO小鼠,在Foxp3基因组上的启动子ATG后面插入Ametrine-2A-FlpO-2A元件,从而在Foxp3+ Treg细胞中启动Ametrine荧光蛋白和FlpO重组酶的表达(图二A和二C)。该小鼠模型是利用小鼠胚胎干细胞囊胚注射法获得的。
研究者将两个品系的小鼠交配,从而获得CD4conviCreERT2-hCD2小鼠模型(图二C)。在CD4+ Foxp3+ 的Treg细胞中,由于表达FlpO重组酶,从而在基因组上特异性切除iCreERT2-hCD2元件,因此仅有在CD4+ Foxp3- 的Tconv细胞中才会携带iCreERT2-hCD2元件(图二C)。经流式分析淋巴结(LN)的CD4+ T细胞,hCD2+的CD4+ T细胞确实不表达Ametrine荧光蛋白(图二D)。进一步检测CD4conviCreERT2-hCD2小鼠与Rosa26LSL.tdTomato报告基因小鼠杂交的子代,经他莫西芬给药后,可观察到tdTomato红色荧光蛋白主要在Ametrine-和hCD2+的CD4+ T细胞,即CD4+ Foxp3- 的Tconv细胞中表达,表明Cre重组酶活性主要在CD4+ Tconv细胞中(图二E和二I,86.4%)。另外,Cre重组酶活性表现为他莫昔芬剂量依赖(图二F-H)。需要注意的是,该模型仍有小部分13.6%的tdTomato表达在其他类群的免疫细胞中。
综上所述,CD4conviCreERT2-hCD2小鼠模型将他莫昔芬诱导的Cre重组酶活性主要限制在CD4+ Tconv细胞类群中,从而可以用于CD4+ Tconv细胞类群特异的基因重组,进行相关谱系示踪等研究。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。
多个重组酶与报告基因系统可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。“人造精子细胞”单倍体打靶效率更高,且无需漫长的嵌合体小鼠繁殖交配等待。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Taniuchi I: CD4 Helper and CD8 Cytotoxic T Cell Differentiation. Annu Rev Immunol 2018, 36:579-601.
2. Lio CWJQ, Hsieh CS: A two-step process for thymic regulatory T cell development. Immunity 2008, 28(1):100-111.
3. Andrews LP, Vignali KM, Szymczak-Workman AL, Burton AR, Brunazzi EA, Ngiow SF, Harusato A, Sharpe AH, Wherry EJ, Taniuchi I et al: A Cre-driven allele-conditioning line to interrogate CD4(+) conventional T cells. Immunity 2021, 54(10):2209-2217.
4. Wang L, Wildt KF, Castro E, Xiong Y, Feigenbaum L, Tessarollo L, Bosselut R: The Zinc Finger Transcription Factor Zbtb7b Represses CD8-Lineage Gene Expression in Peripheral CD4(+) T Cells. Immunity 2008, 29(6):876-887.
5. Mucida D, Husain MM, Muroi S, van Wijk F, Shinnakasu R, Naoe Y, Reis BS, Huang YJ, Lambolez F, Docherty M et al: Transcriptional reprogramming of mature CD4(+) helper T cells generates distinct MHC class II-restricted cytotoxic T lymphocytes. Nat Immunol 2013, 14(3):281-289.

