技术分享:全新蛋白质定向递送系统PVC
内共生细菌是一类寄生在宿主体内的特殊细菌,它们已进化出复杂的传递系统来递送可调节宿主的生物因子[1]。例如,细胞外可收缩注射系统(extracellular contractile injection system,eCIS),这是一类类似于噬菌体尾部的注射器状纳米机器[2],通过驱动“针头”穿过细胞膜从而将蛋白质有效载荷注入真核细胞中。研究发现eCIS可以靶向小鼠细胞[3],进而提高其作为蛋白质递送工具的可能性。然而,eCIS的活性尚未在人类细胞中得到证实,并且eCIS识别靶细胞的机制仍有待阐明。
2023年3月29日,Nature杂志上报道了通过工程化改造发光杆菌的细胞外可收缩注射系统(eCIS)PVC(Photorhabdus virulence cassette),研发出一种全新的蛋白质定向递送系统。研究者通过对PVC的改造,使其可以在体外成功递送不同类型的蛋白质有效载荷,并实现特异性靶向不同生物体的多种细胞类型。现已具备在活体小鼠体内特异性递送蛋白质的能力,且不诱发局部免疫反应[4]。
首先,研究者摸索PVC的表达纯化和蛋白质装载条件。PVC是发光杆菌Photorhabdus来源的eCIS,以内共生体的形式存在于昆虫致病线虫中[5]。PVC是由一个约20 kb的操纵子组成,包含16个核心基因pvc1-16(图一a,蓝色和紫色)、下游2个有效载荷基因Pdp1和Pnf(红色)以及4个推测的调控基因(橙色)。与所有的eCIS一样,Pdp1和Pnf是通过PVC鞘的收缩以及随后刺突管复合体的分解进入靶细胞(图一b)。研究者将PVC系统分成结构pPVC和有效载荷pPayload两个质粒,在大肠杆菌中表达PVC系统[6]。使用透射电子显微镜(TEM)观察,发现纯化后的PVC蛋白质复合物类似于经典的eCIS结构,包含完整的基板和鞘结构,长度约为116 nm(图一c)。将纯化的PVC复合物与Sf9昆虫细胞孵育后,可观察到PVC稳定结合在Sf9细胞表面(图一d),表明大肠杆菌内的PVC表达与纯化成功。为了将PVC开发成蛋白质递送工具,研究者接着研究PVC的装载方式,发现在有效载荷蛋白Pdp1和Pnf的N末端都有一段高度无序区域,该区域对于有效载荷是必需的,被称为包装结构域(packaging domain,PD)。将Pdp1的PD序列与其他蛋白GFP、Cre或者ZFN进行融合,发现在有效载荷装载器pvc15存在的情况下,三种新的蛋白都能被包装进PVC内(图一e),即成功建立了一种将目的蛋白质装载入PVC颗粒的通用方法。研究者将含有毒素有效载荷的天然PVC与Sf9细胞孵育,观察到其强大的细胞毒性,并且此过程需要推测的靶标识别基因(pvc13,编码尾纤维)和pvc15的存在(图一f)。此外,将Cre装载入PVC后,与表达有loxP-GFP的Sf9细胞孵育,也可观察到由Cre介导的GFP阳性信号(图一g)。以上结果表明,利用工程化改造的PVC可装载入目的蛋白质,并将其递送至靶细胞内发挥其生理功能。
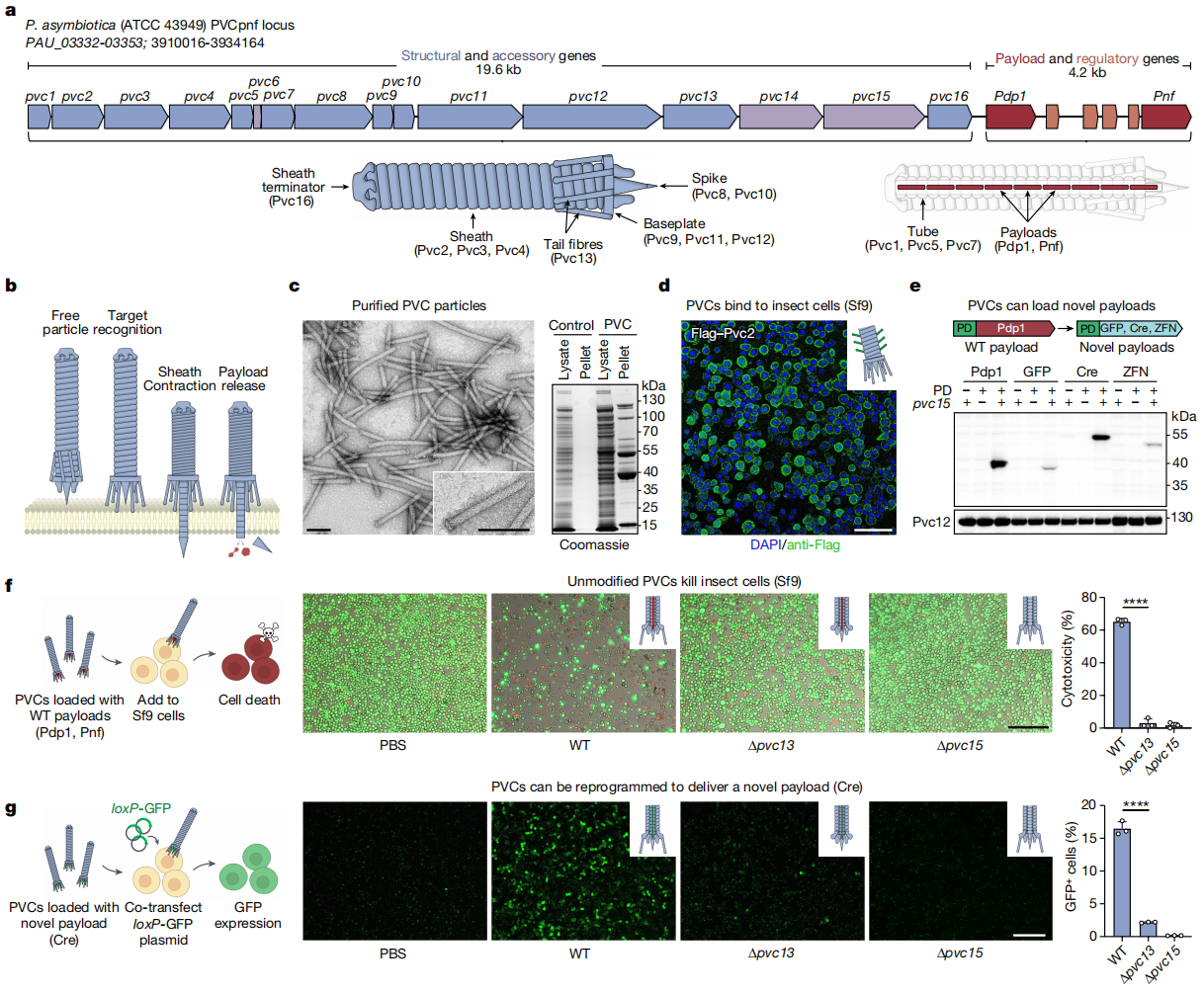
图一 重编程的PVC可实现真核细胞的蛋白质递送[4]
其次,研究者尝试改变PVC的细胞靶向性。虽然PVC与靶细胞结合的机制尚不清楚,但可收缩尾噬菌体的靶标识别方式已被了解[7],研究者提出使用类似的技术可能改变PVC的靶向特异性。根据预测结构域,推测PVC的尾纤维基因pvc13可能参与靶标识别。于是,研究者使用AlphaFold[8]来预测Pvc13的3D结构,推测其远端区域可能与靶细胞初始接触(图二a),预测在其C端形成一个具有球状尖端的螺旋管结构,可能是整个尾纤维的结合结构域。随即,研究者将推测的Pvc13靶标识别结构域(氨基酸403-476)删除,替换成可特异性结合人类细胞的结构域,分别构建了Pvc13-Ad5-knob和Pvc13-E01-DARPin(EGFR特异性设计的锚蛋白重复结合域(DARPin)E01)。以过表达EGFR且对Ad5感染敏感的A549人肺腺癌细胞作为模型细胞系,发现仅有携带Pvc13-Ad5-knob或Pvc13-E01-DARPin的天然毒素PVC可以有效地杀死A549细胞;且将装载蛋白替换为Pdp1-NTD–Cre后,可在A549 loxP-GFP细胞中观测到GFP表达(图二a)。值得注意的是,当PVC携带突变的Ad5(Δ491/492)或非靶向DARPin(抗溶菌酶DARPin A4)时,则表现出无细胞内活性(图二a)。利用Pvc13-Ad5-knob系统递送Cas9时,在RNA的引导下,PVC可靶向HEK 293FT细胞,实现递送的Cas9成功产生靶基因序列的插入和缺失(图二b)。此外,研究者还递送了锌指脱氨酶(ZFD),它由锌指结构域与分裂脱氨酶相连的系统组成[9],可以观察到靶向人类TRAC位点的目标碱基G-A替换(图二c)。受PVC递送毒素靶向杀伤的内源性生物功能的启发,研究者采用Pvc13-CD4-DARPin系统递送Pdp1和Pnf,此时PVC可特异性靶向CD4高表达的白血病T细胞Jurkat细胞产生细胞毒性(图二d)。以上数据表明,可通过改造PVC,使其递送特定的蛋白质,并特异性靶向不同人类细胞实现多种功能。
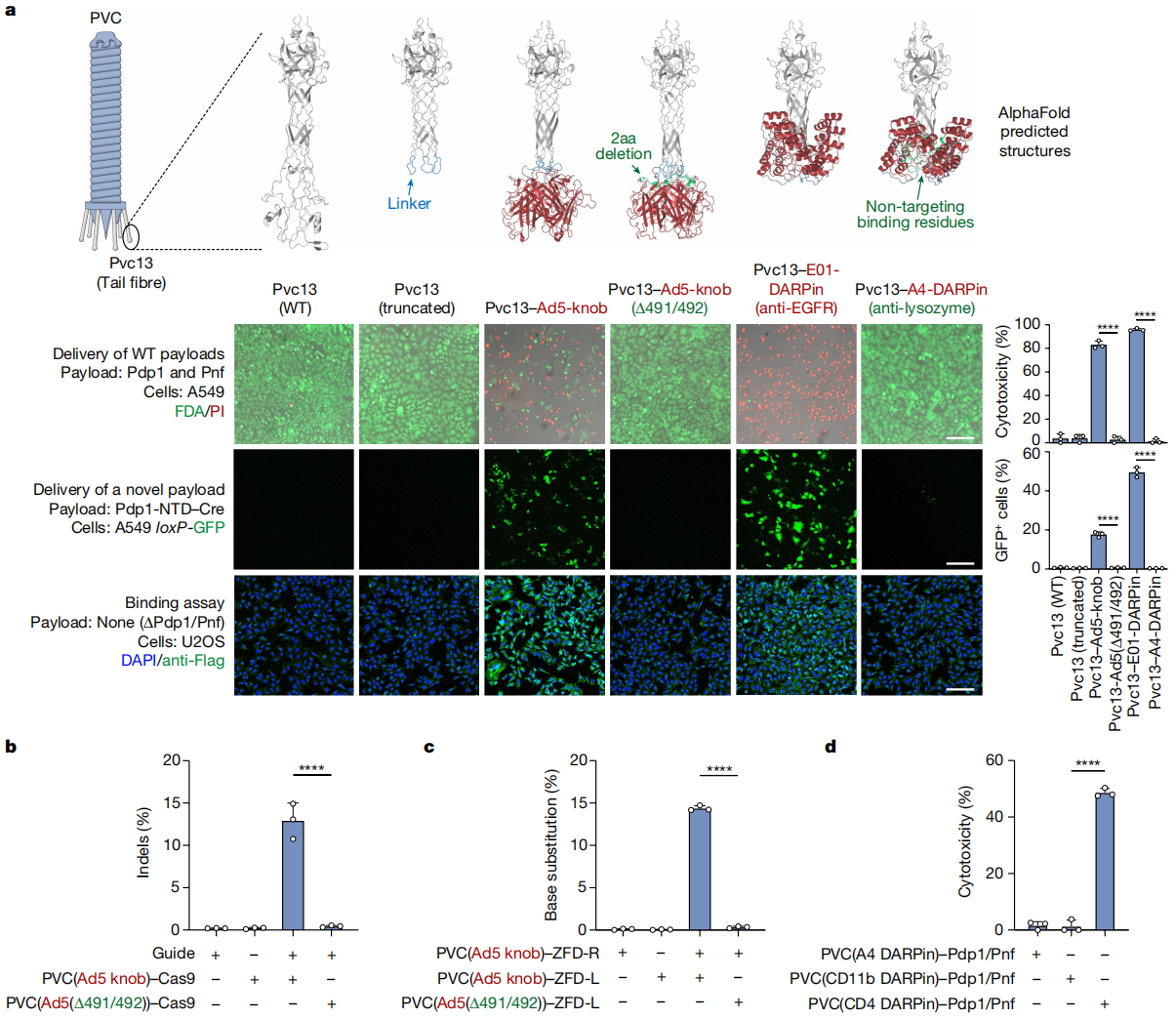
图二 重编程的PVC可特异性靶向人类细胞[4]
再次,研究者测试了PVC的细胞靶向特异性。构建了一组表达不同标签抗体的HEK 293FT衍生细胞,相应地将标签序列插入尾纤维Pvc13的远端结合域,并利用PVC系统递送Cre。仅有当PVC特异性结合到相应的靶细胞后,才能将Cre递送入含有loxP-GFP的细胞,激活GFP的表达(图三a和b),表明PVC的细胞靶向高特异性。此外,研究者评估了PVC对EGFR的靶向特异性,采用Pvc13-E01-DARPin系统递送Pdp1和Pnf时,发现PVC可以特异性杀死EGFR+细胞系(A549和A431),而不能杀死EGFR−细胞系(Jurkat和3T3)(图三c)。进一步将EGFR转染到EGFR−细胞系3T3后,发现PVC可以杀死3T3 EGFR+细胞(图三d)。以上数据表明,PVC介导的蛋白质递送系统具有高度特异性,这种依赖于受体识别的细胞靶向性将极大拓宽其应用范围。
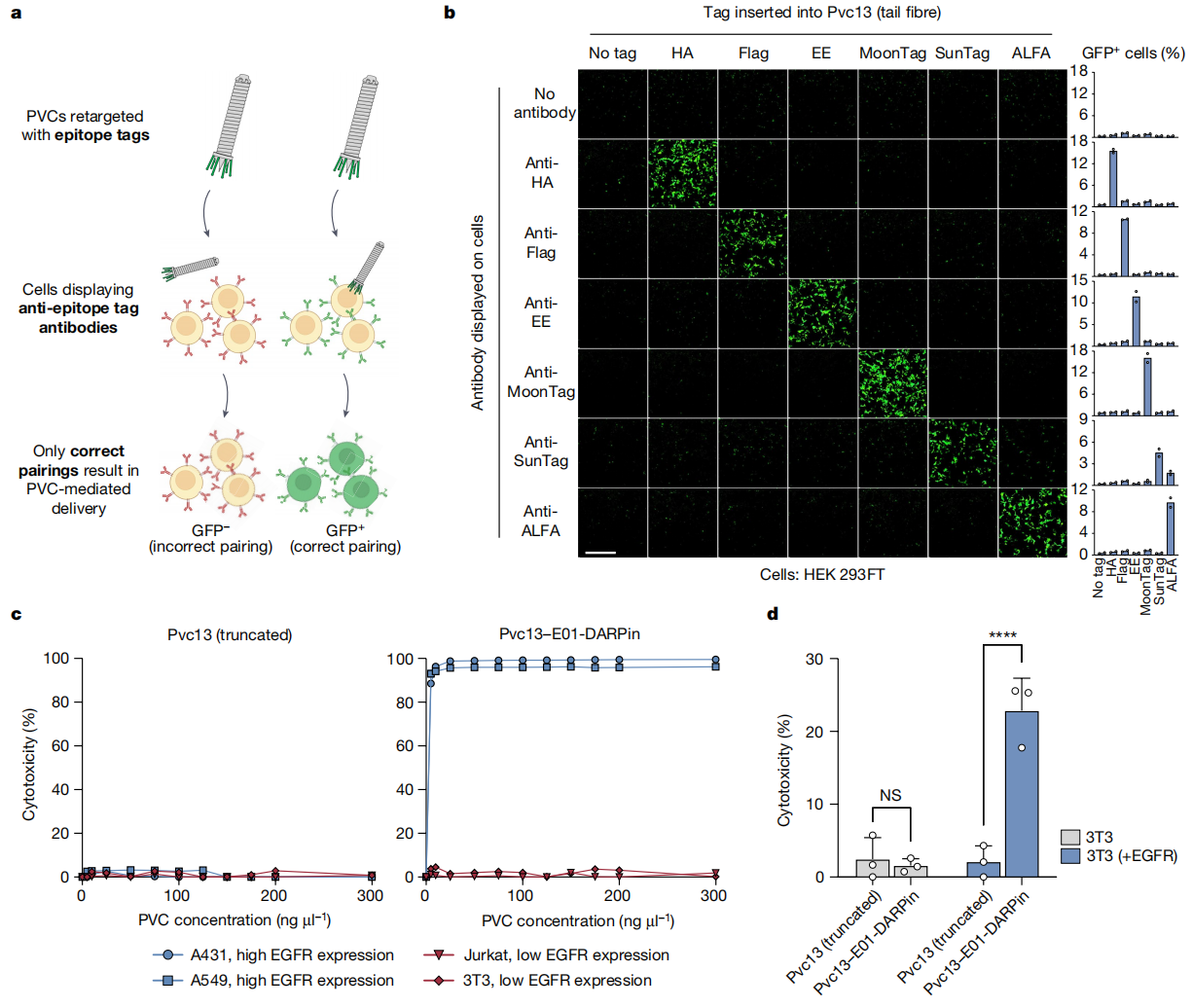
图三 PVC介导的蛋白质递送具有高度特异性[4]
最后,研究者测试了PVC的蛋白质在体递送能力。使用alphafold引导Pvc13的工程化改造,筛选出两个可用于小鼠的靶向结合域。其一是经修饰的Ad5 knob结构域Ad5-knob(RGD/PK7),可将Ad5的宿主范围扩大到小鼠组织;其二是针对小鼠MHC II类分子的纳米抗体[10](图四a)。经Pvc13改造后所产生的PVC可在小鼠细胞系以及原代细胞中显示出显著增强的活性(图四b)。于是,研究者采用Pvc13-Ad5-knob(RGD/PK7)系统递送Cre,并将PVC颅内注射到loxP-tdTomato报告小鼠中,可在海马中观察到Cre介导的tdTomato表达(图四c)。此外,从注射后的大脑中提取单细胞悬液,用流式细胞术定量神经元和小胶质细胞中的tdTomato信号,发现仅在神经元中显著富集(图四d),表明该PVC可以在体特异性靶向神经元。并且PVC注射后没有产生任何明显的免疫细胞激活(图四e)、炎症细胞因子产生、体重减轻或细胞毒性,表明PVC治疗在这个实验过程中没有产生免疫原性或毒性。注射7天后,在大脑中就无法分离出完整的PVC(图四f),表明PVC仅在体内短暂存在,因而非常适合于暂时或短期的治疗。以上数据表明,PVC可在体递送目的蛋白质,最终可能作为人类疾病治疗的递送工具。
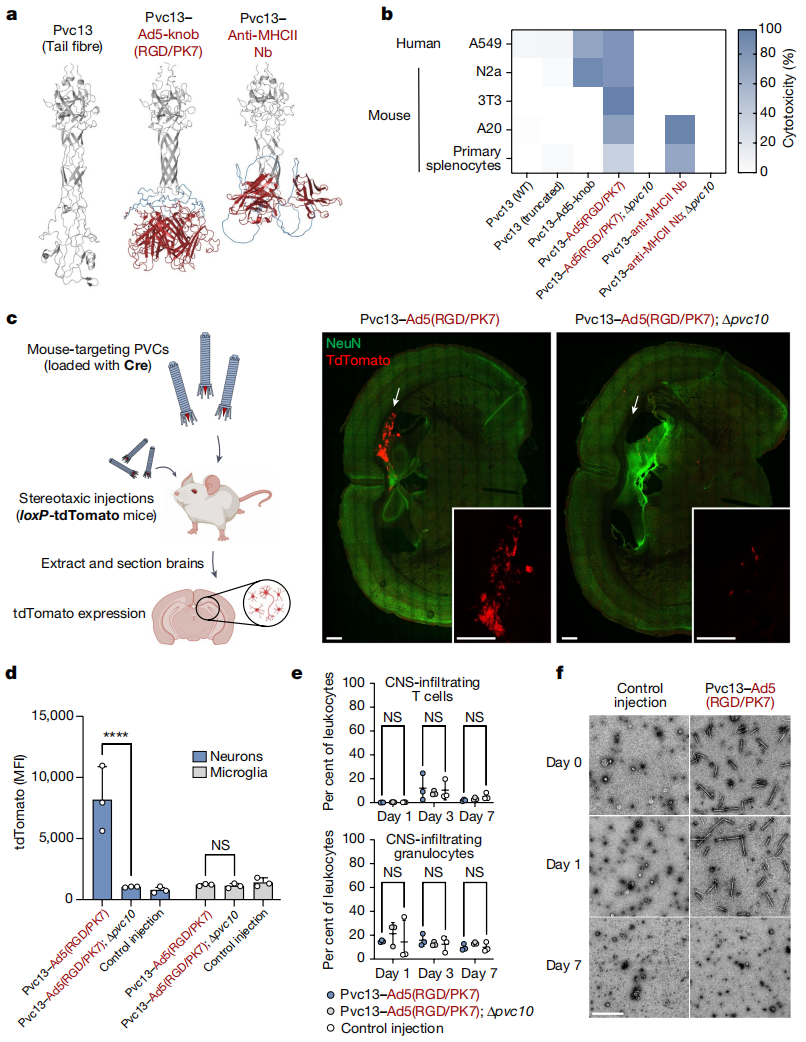
图四 重编程的PVC可在小鼠体内实现靶向递送[4]
综上所述,工程化改造后的PVC可作为新型蛋白质递送工具,既可以装载非天然的目的蛋白质,还可以靶向不同生物体及其细胞。PVC系统具有高度的靶向特异性,其活性取决于尾纤维与靶细胞上受体的成功结合,这种简便性的改造方法将极大地拓宽其应用范围。PVC现已实现将不同目的蛋白质精准地递送至昆虫细胞、人类细胞、原代细胞和小鼠体内,为后续基因治疗和癌症治疗提供了强有力的安全性工具和技术保障。其简易的生产工艺和灵活的多功能改造潜力,有望改变现有疗法的技术格局。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Rocchi I, Ericson CF, Malter KE, Zargar S, Eisenstein F, Pilhofer M, Beyhan S, Shikuma NJ: A Bacterial Phage Tail-like Structure Kills Eukaryotic Cells by Injecting a Nuclease Effector. Cell reports 2019, 28(2):295-301 e294.
2. Taylor NMI, van Raaij MJ, Leiman PG: Contractile injection systems of bacteriophages and related systems. Mol Microbiol 2018, 108(1):6-15.
3. Wang X, Cheng J, Shen J, Liu L, Li N, Gao N, Jiang F, Jin Q: Characterization of Photorhabdus Virulence Cassette as a causative agent in the emerging pathogen Photorhabdus asymbiotica. Science China Life sciences 2022, 65(3):618-630.
4. Kreitz J, Friedrich MJ, Guru A, Lash B, Saito M, Macrae RK, Zhang F: Programmable protein delivery with a bacterial contractile injection system. Nature 2023.
5. Yang G, Dowling AJ, Gerike U, ffrench-Constant RH, Waterfield NR: Photorhabdus virulence cassettes confer injectable insecticidal activity against the wax moth. J Bacteriol 2006, 188(6):2254-2261.
6. Jiang F, Li N, Wang X, Cheng J, Huang Y, Yang Y, Yang J, Cai B, Wang YP, Jin Q et al: Cryo-EM Structure and Assembly of an Extracellular Contractile Injection System. Cell 2019, 177(2):370-383 e315.
7. Islam MZ, Fokine A, Mahalingam M, Zhang Z, Garcia-Doval C, van Raaij MJ, Rossmann MG, Rao VB: Molecular anatomy of the receptor binding module of a bacteriophage long tail fiber. PLoS pathogens 2019, 15(12):e1008193.
8. Mirdita M, Schutze K, Moriwaki Y, Heo L, Ovchinnikov S, Steinegger M: ColabFold: making protein folding accessible to all. Nat Methods 2022, 19(6):679-682.
9. Lim K, Cho SI, Kim JS: Nuclear and mitochondrial DNA editing in human cells with zinc finger deaminases. Nature communications 2022, 13(1):366.
10. Rashidian M, Keliher EJ, Bilate AM, Duarte JN, Wojtkiewicz GR, Jacobsen JT, Cragnolini J, Swee LK, Victora GD, Weissleder R et al: Noninvasive imaging of immune responses. Proc Natl Acad Sci U S A 2015, 112(19):6146-6151.



