技术分享:发现新的铁死亡抑制因子ME1可改善肝脏缺血再灌注损伤
肝脏缺血/再灌注(ischemia/reperfusion,I/R)损伤是一种主要的肝脏损伤类型,经常发生在肝切除、肝移植等一系列临床手术中[1],是导致移植肝早期衰竭、组织损伤、器官排斥甚至肝功能衰竭的重要原因[2]。铁死亡(ferroptosis)是一种铁依赖性的,区别于细胞凋亡、坏死、自噬的新型细胞程序性死亡方式,被报道与越来越多人类疾病的发病机制有关[3]。铁死亡主要是由脂质过氧化物的过度积累引起的,谷胱甘肽/谷胱甘肽过氧化物酶4(GSH/ GPX4)信号轴是其经典信号通路。当细胞内谷胱甘肽(GSH)耗竭,引发谷胱甘肽过氧化物酶4(GPX4)活性下降,导致脂质过氧化物积累,达到一定程度即可诱发细胞死亡[3]。烟酰胺腺嘌呤二核苷酸磷酸(NADPH)是调节该反应的必要辅助因子[4],其丰度降低可作为检测肝脏铁死亡的生物标志物[5]。铁死亡已被报道与肝脏I/R损伤存在着密切的相关性[6],阻断铁死亡可显著减轻肝脏I/R造成的组织损伤[7, 8],但I/R诱导铁死亡的作用机制仍不清楚。
2023年2月,Advanced Science期刊报道了NADPH稳态在I/R诱导铁死亡中的作用,发现产生NADPH的代谢酶苹果酸酶1(ME1)是一种新的肝脏铁死亡抑制因子。在小鼠肝细胞中特异性敲除Me1,会导致I/R后的铁死亡易感性增强以及肝损伤加重。相反地,补充ME1的底物L-苹果酸,则可以增加NADPH的丰度,保护肝脏免受铁死亡和组织损伤[9]。
首先,研究者在小鼠肝脏I/R损伤模型中[7],检测铁死亡的重要生化特征。Slc7a11可将胱氨酸转运入细胞,用于合成GSH。GSH是Gpx4介导的脂质过氧化防御系统的必要辅助因子[3],Gpx4将GSH转化成氧化型谷胱甘肽(GSSG),并将细胞毒性脂质过氧化物(L-OOH)还原为相应的醇(L-OH)。Gpx4是铁死亡的核心调控蛋白,抑制Gpx4活性可导致脂质过氧化物的积累,进而引起铁死亡(图一E)。在I/R处理的小鼠肝脏中,检测到GSH的耗竭,GSSG的积累,导致GSH/GSSG的比值显著下调,以及半胱氨酸的耗竭(图一A-D),表现出经典的铁死亡特征。在NADPH存在的条件下,GSSG重新转化为GSH,胱氨酸转化为GSH合成所需的底物半胱氨酸(图一E)。于是,研究者进一步检测NADPH的丰度,发现I/R处理后肝脏的NADPH耗竭和NADPH/NADP+比值下降(图一F-H)。综上所述,NADPH稳态与I/R诱导的铁死亡具有相关性。
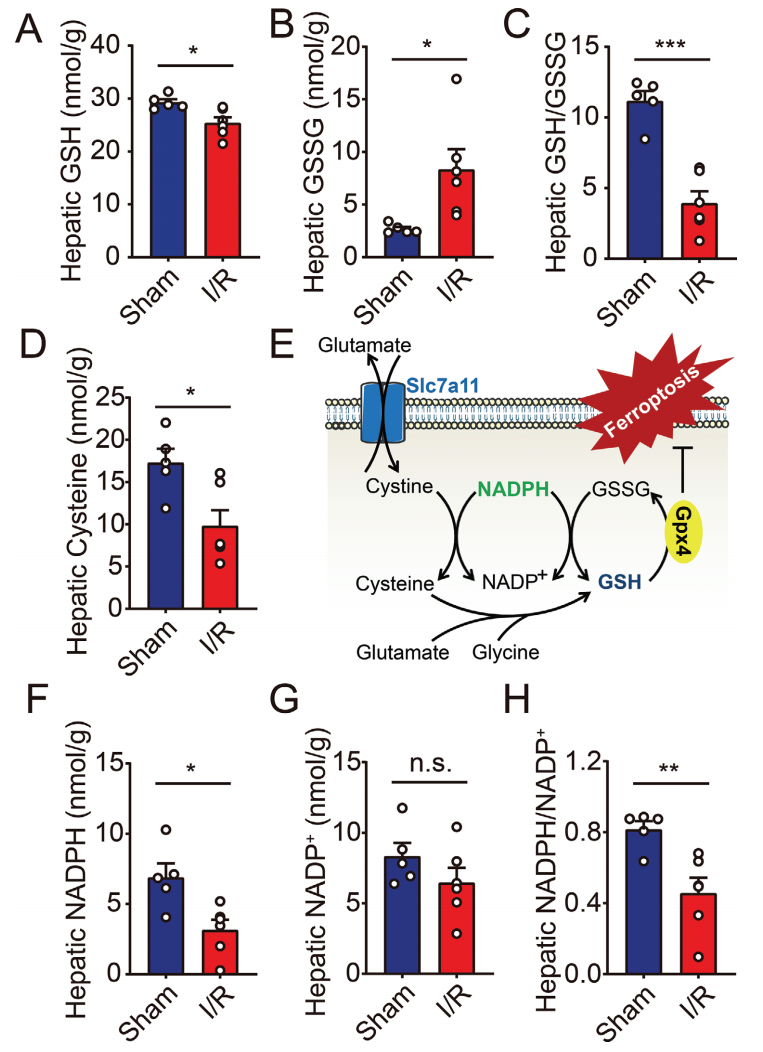
图一 小鼠肝脏I/R损伤导致GSH和NADPH耗竭[9]
于是,研究者筛选了参与维持NADPH代谢稳态的基因,发现只有产生NADPH的代谢酶Me1在肝脏I/R损伤后的表达显著下调(图二A)。ME1负责将苹果酸转化为丙酮酸,同时将NADP+还原为NADPH。与mRNA水平一致,肝脏I/R损伤后Me1蛋白表达明显降低(图二B),伴随着Me1的活性下降,导致苹果酸盐在肝脏中轻微积累(图二C和D)。此外,研究者也测定了NADPH氧化酶(NOXs)的表达,它们通过消耗NADPH产生活性氧(ROS)。结果显示,Nox1、Nox2、Nox4可在肝脏中检测到表达,但在sham对照组和I/R实验组之间未观察到表达差异(图二E),提示NOXs与NADPH的耗竭无关。
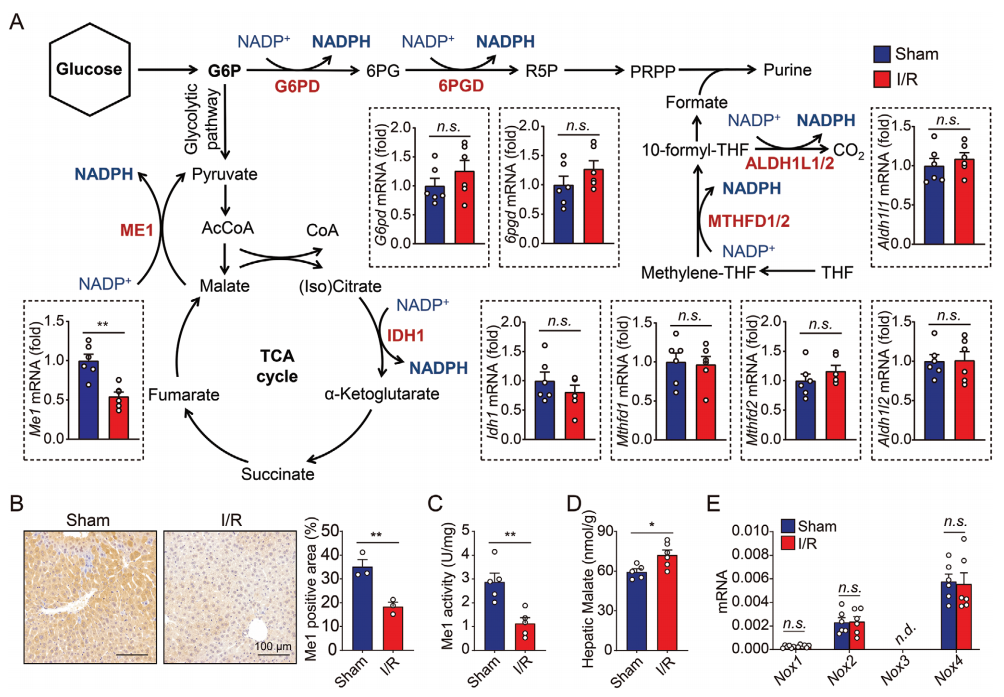
图二 小鼠肝脏I/R损伤中Me1的表达与活性被抑制[9]
接着,研究者构建了条件性敲除小鼠模型来评价Me1在肝脏I/R损伤中的具体作用。在血清白蛋白(Alb)启动子驱动Cre重组酶的介导下,删除Me1基因的第4号外显子,得到肝细胞特异性Me1缺失(Me1Alb/Alb)小鼠(图三A)。实时荧光定量PCR分析显示,Me1Alb/Alb小鼠肝脏的Me1表达降低了约90%(图三B),免疫印迹结果也证实了这一点(图三C)。但Me1Alb/Alb小鼠肝脏并没有出现病理变化,表明肝细胞特异性敲除Me1并不足以在体内诱导肝损伤。于是,研究者利用该小鼠模型与对照组小鼠进行肝脏I/R损伤实验,发现Me1Alb/Alb小鼠在I/R处理后血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和乳酸脱氢酶(LDH)表达显著增加,表明出现严重的肝损伤(图三D-F);对肝脏I/R损伤的易感性增加(图三G);出现肝细胞线粒体肿胀和嵴密度降低(图三H);NADPH/NADP+、GSH/GSSG和半胱氨酸显著降低(图三I-K)。虽然没有观察到肝脏铁含量的变化(图三L),但发现Me1Alb/Alb实验组小鼠肝脏的脂质过氧化反应最终产物丙二醛(MDA)和铁死亡在体生物标志物Ptgs2表达增多(图三M和N);氧化的花生四烯酸(AA)代谢物水平显著升高,特别是12-HETE和15-HETE(图三O和P)。以上数据表明,肝细胞特异性敲除Me1可显著性促进I/R诱导的铁死亡和肝损伤,提示ME1在肝脏I/R损伤中具有抑制铁死亡的作用。
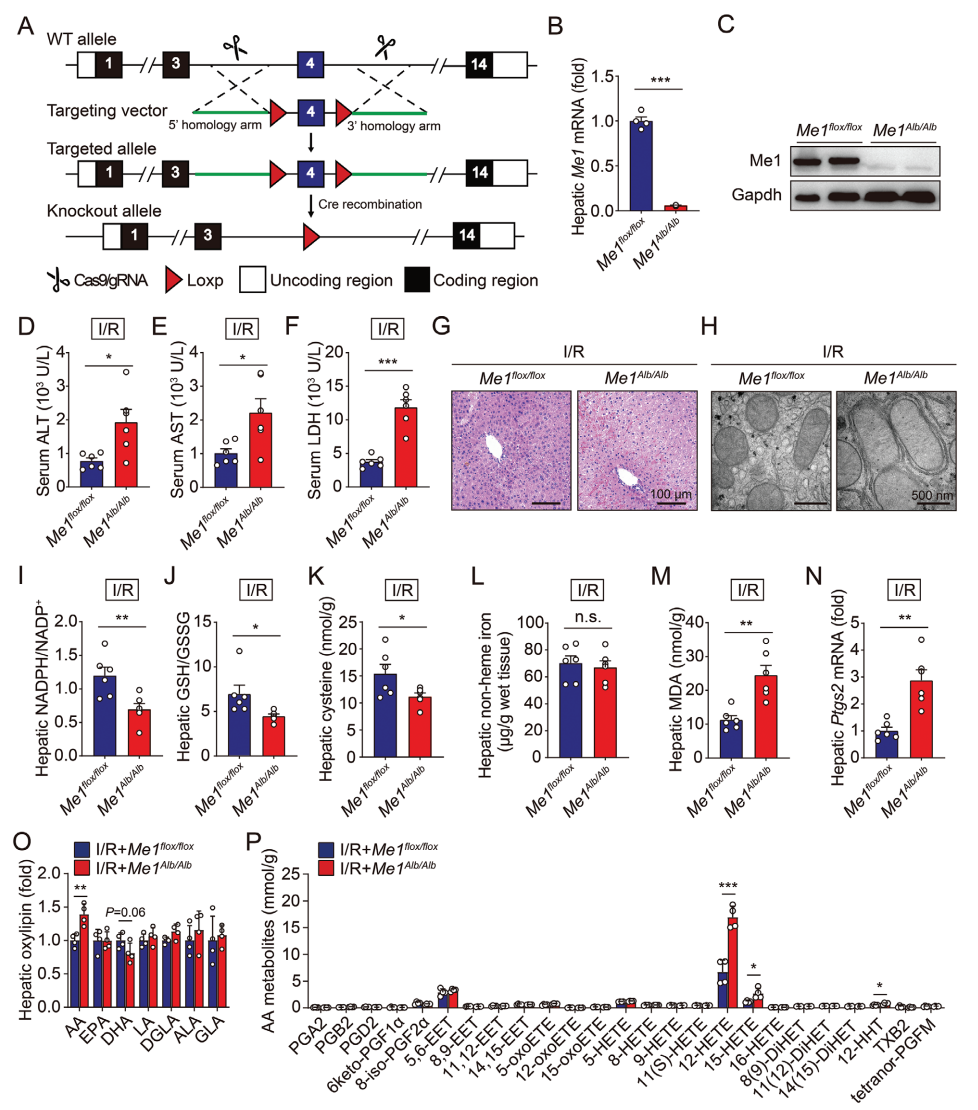
图三 Me1的肝脏缺失可促进I/R诱导的铁死亡和肝损伤[9]
随后,研究者测试了ME1的底物苹果酸能否保护I/R诱导的铁死亡和肝损伤。与预期的结果一致,补充L-苹果酸后,I/R处理小鼠的肝脏NADPH、GSH和半胱氨酸水平显著恢复(图四A-C),I/R诱导的铁死亡和肝损伤也被显著抑制(图四D-I)。但是补充L-苹果酸并不能改善I/R诱导Me1Alb/Alb小鼠的肝损伤,表明ME1的激活是主要作用靶点。以上数据表明,补充ME1的底物L-苹果酸对于治疗肝脏I/R损伤有着巨大的临床应用潜力。
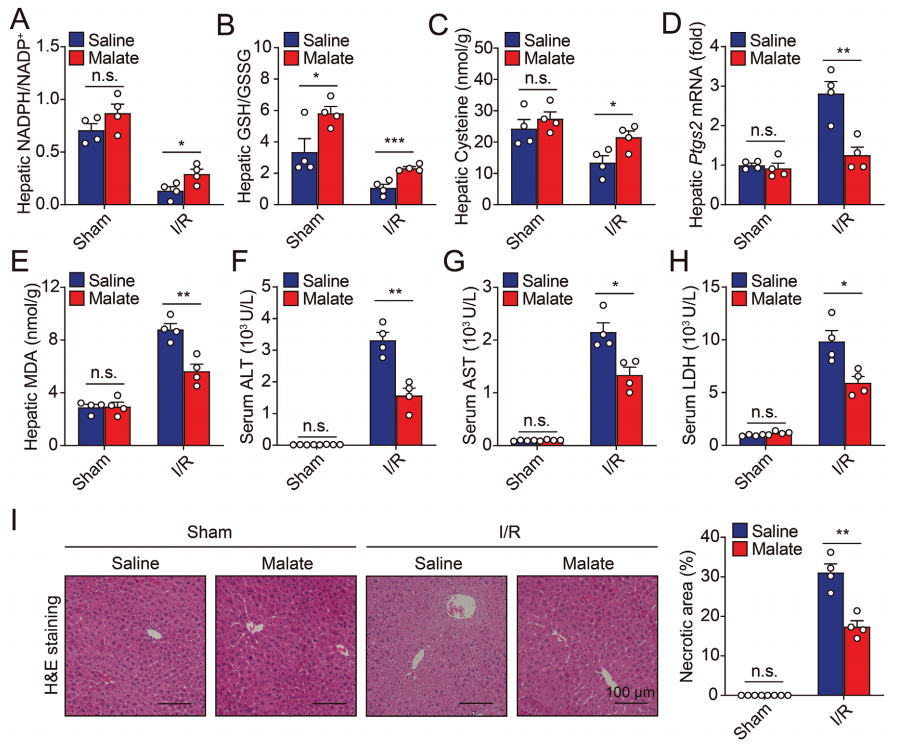
图四 补充L-苹果酸可以防止I/R损伤期间的铁死亡[9]
在之前的研究中,强调了磷酸酶与张力蛋白同源物(PTEN)信号通路在肝脏I/R损伤中的重要性[10]。为此,研究者在公共数据库中比较了野生型和肝细胞特异性Pten缺失(PtenAlb/Alb)小鼠的肝脏Me1 mRNA的表达水平,发现在大多数年龄组中,Pten缺失后Me1的肝脏表达显著增加(图五A)。PTEN可通过抑制Pl3K/AKT/mTOR通路,抑制细胞的增殖。经蛋白检测,I/R处理后小鼠肝脏的磷酸化Akt和磷酸化mTOR的表达降低(图五B)。为了进一步证实PTEN信号通路在I/R诱导铁死亡中的作用,野生型小鼠在接受肝脏I/R手术前分别用PTEN抑制剂(bpV)或mTOR激活剂(3BDO)进行预处理(图五C)。结果显示,bpV和3BDO的处理均能显著性增加I/R处理后肝脏Me1的表达(图五D),随后恢复了肝脏中NADPH、GSH和半胱氨酸的水平(图五E-G),并且改善了小鼠肝脏I/R诱导的铁死亡(图五H和I)和组织损伤(图五J-M)。
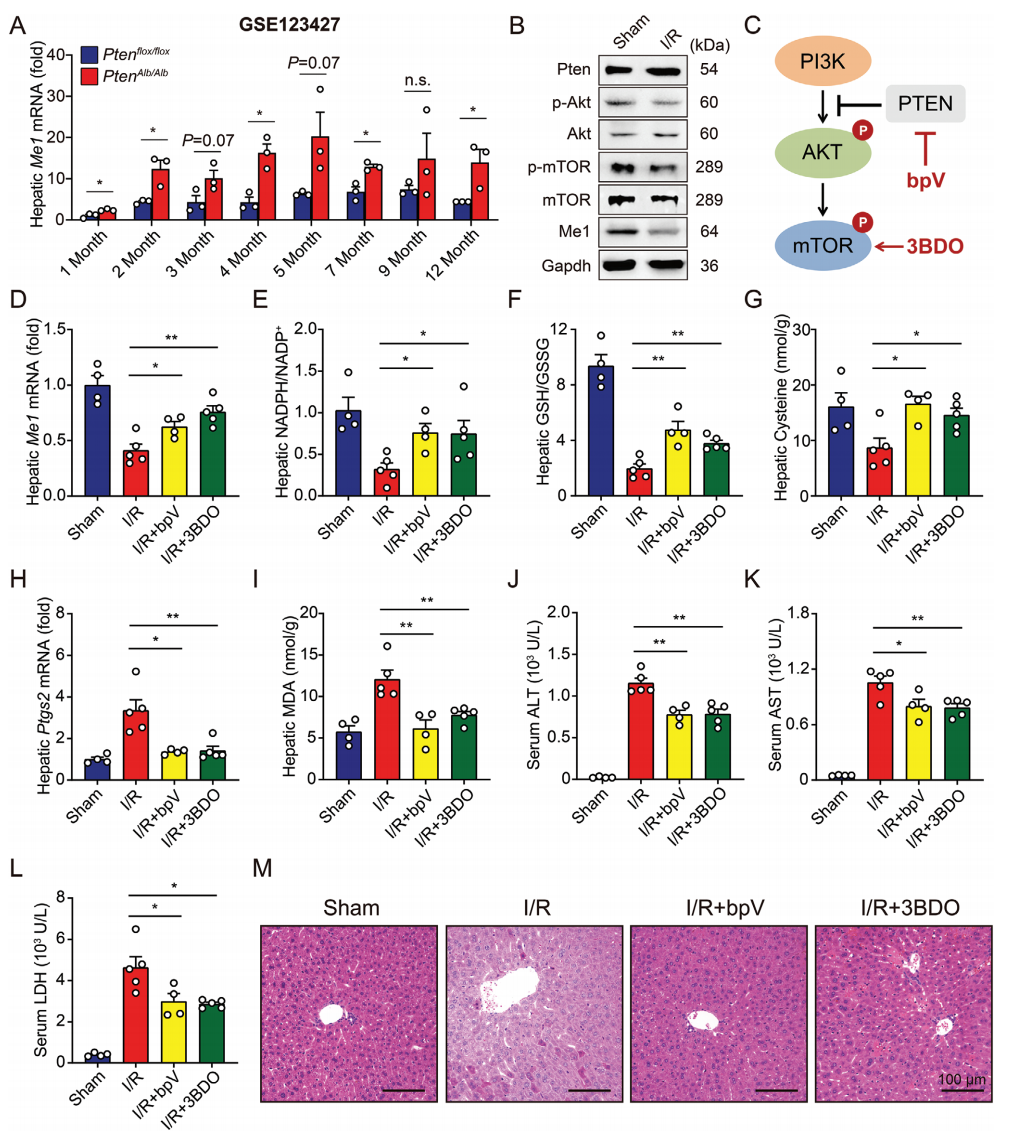
图五 Pten/Akt/mTOR信号通路可调节肝脏Me1的表达[9]
甾醇调节元件结合蛋白1(SREBP1)是脂肪生成的主要调节因子,也是Akt/mTOR信号通路的下游靶点。S6激酶1(S6K1)是mTOR的下游效应因子,也是肝细胞SREBP1前体的候选特异性蛋白水解激酶[11]。有趣的是,SREBP1转基因小鼠的肝脏Me1表达显著升高[12]。经蛋白检测,I/R处理后小鼠肝脏的Srebp1表达和磷酸化S6k1均显著降低,在添加PTEN抑制剂和mTOR激活剂后抑制解除(图六A)。染色质免疫共沉淀(ChIP)-qPCR分析发现,在HEK293细胞中,SREBP1可以直接与ME1启动子结合(图六B)。体外过表达SREBP1可强烈激活ME1启动子驱动的荧光素酶(图六C),进一步支持了mTOR信号下游的SREBP1可直接调控ME1的转录。随后,研究者将AAV8-Srebp1注射到野生型小鼠中,实现小鼠肝脏的Srebp1过表达(图六D)。同样地,Srebp1过表达可恢复I/R后肝脏中NADPH、GSH和半胱氨酸的水平,改善小鼠肝脏I/R诱导的铁死亡和组织损伤(图六E-M),但对Me1缺失小鼠没有保护作用(图六N-Q),进一步证实了SREBP1以ME1依赖的方式抑制铁死亡。
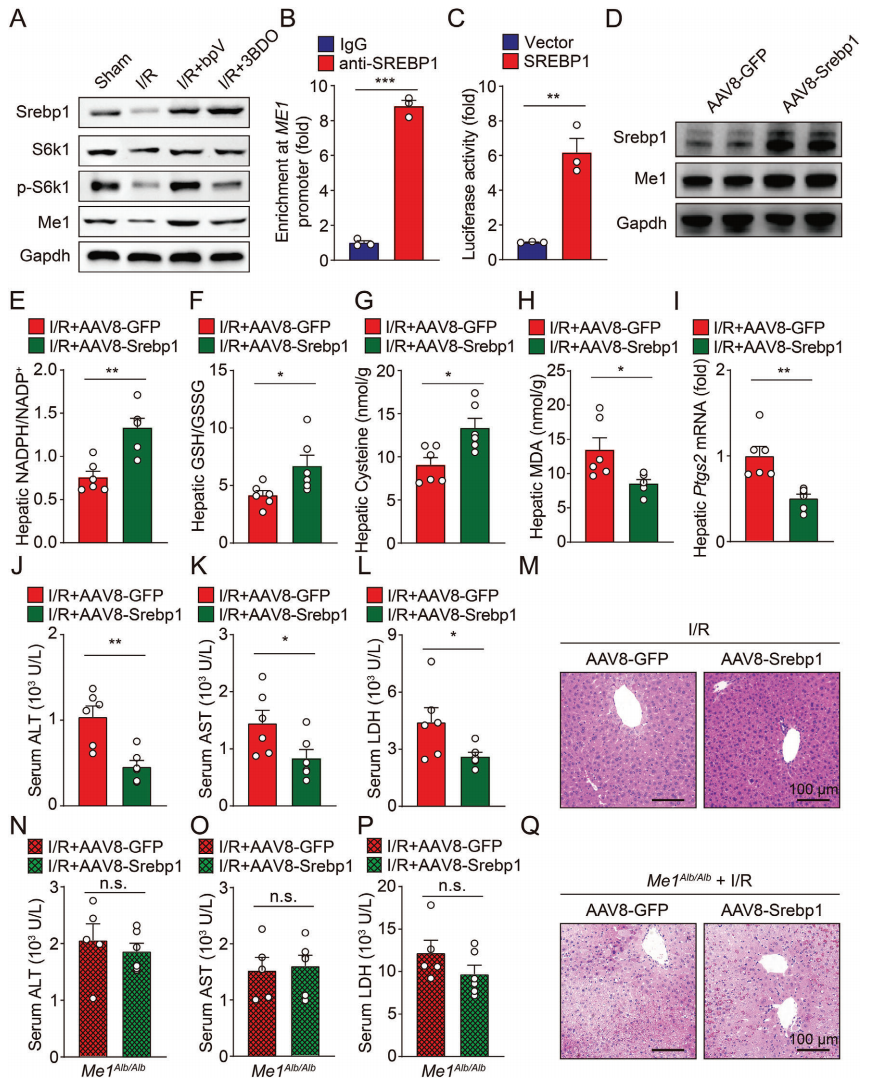
图六 肝脏中SREBP1对于mTOR激活Me1转录、维持NADPH稳态和抑制铁死亡至关重要[9]
综上所述,I/R诱导的铁死亡与ME1的表达和活性降低显著相关。肝细胞特异性敲除Me1的小鼠表现出严重的I/R诱导铁死亡和肝损伤;而补充ME1底物L-苹果酸可恢复NADPH和GSH水平,最终抑制I/R诱导的铁死亡和肝损伤。机制上,PTEN/mTOR/SREBP1信号通路在I/R诱导铁死亡的过程中可调控肝脏ME1的表达,并且PTEN抑制剂、mTOR激活剂或SREBP1过表达均能增加肝脏NADPH,抑制铁死亡,保护肝脏免受I/R损伤。因此,进一步筛选特异性ME1激活剂来作为铁死亡抑制剂,可为肝脏I/R损伤以及铁死亡相关疾病的临床治疗提供新的思路。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Peralta C, Jimenez-Castro MB, Gracia-Sancho J: Hepatic ischemia and reperfusion injury: effects on the liver sinusoidal milieu. Journal of hepatology 2013, 59(5):1094-1106.
2. Hirao H, Nakamura K, Kupiec-Weglinski JW: Liver ischaemia-reperfusion injury: a new understanding of the role of innate immunity. Nature reviews Gastroenterology & hepatology 2022, 19(4):239-256.
3. Stockwell BR, Friedmann Angeli JP, Bayir H, Bush AI, Conrad M, Dixon SJ, Fulda S, Gascon S, Hatzios SK, Kagan VE et al: Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell 2017, 171(2):273-285.
4. Koppula P, Zhuang L, Gan B: Cystine transporter SLC7A11/xCT in cancer: ferroptosis, nutrient dependency, and cancer therapy. Protein & cell 2021, 12(8):599-620.
5. Wang H, An P, Xie E, Wu Q, Fang X, Gao H, Zhang Z, Li Y, Wang X, Zhang J et al: Characterization of ferroptosis in murine models of hemochromatosis. Hepatology 2017, 66(2):449-465.
6. Chen J, Li X, Ge C, Min J, Wang F: The multifaceted role of ferroptosis in liver disease. Cell death and differentiation 2022, 29(3):467-480.
7. Friedmann Angeli JP, Schneider M, Proneth B, Tyurina YY, Tyurin VA, Hammond VJ, Herbach N, Aichler M, Walch A, Eggenhofer E et al: Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice. Nat Cell Biol 2014, 16(12):1180-1191.
8. Yamada N, Karasawa T, Wakiya T, Sadatomo A, Ito H, Kamata R, Watanabe S, Komada T, Kimura H, Sanada Y et al: Iron overload as a risk factor for hepatic ischemia-reperfusion injury in liver transplantation: Potential role of ferroptosis. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2020, 20(6):1606-1618.
9. Fang X, Zhang J, Li Y, Song Y, Yu Y, Cai Z, Lian F, Yang J, Min J, Wang F: Malic Enzyme 1 as a Novel Anti-Ferroptotic Regulator in Hepatic Ischemia/Reperfusion Injury. Advanced science 2023:e2205436.
10. Kamo N, Ke B, Busuttil RW, Kupiec-Weglinski JW: PTEN-mediated Akt/beta-catenin/Foxo1 signaling regulates innate immune responses in mouse liver ischemia/reperfusion injury. Hepatology 2013, 57(1):289-298.
11. Owen JL, Zhang Y, Bae SH, Farooqi MS, Liang G, Hammer RE, Goldstein JL, Brown MS: Insulin stimulation of SREBP-1c processing in transgenic rat hepatocytes requires p70 S6-kinase. Proc Natl Acad Sci U S A 2012, 109(40):16184-16189.
12. Shimomura I, Shimano H, Korn BS, Bashmakov Y, Horton JD: Nuclear sterol regulatory element-binding proteins activate genes responsible for the entire program of unsaturated fatty acid biosynthesis in transgenic mouse liver. The Journal of biological chemistry 1998, 273(52):35299-35306.



