技术分享:ABE靶向消除CaMKIIδ氧化可保护小鼠心脏缺血再灌注损伤
基于CRISPR-Cas9的基因编辑疗法逐步被开发用于治疗各种单基因突变造成的遗传性疾病[1],但因罕见病的患者人群基数较小,多侧重于纠正少量患者的特定基因突变[2]。心血管疾病是全球发病率和死亡率最高的疾病[3],若能开发相应的CRISPR-Cas9基因编辑疗法将使得更多患者受益。
钙/钙调蛋白依赖性激酶IIδ(CaMKIIδ)作为心脏信号与功能的中央调节因子[4],其慢性过度活化会导致多种心血管疾病,包括缺血/再灌注(IR)损伤、心力衰竭、心肌肥大和心律不齐等[5, 6]。因此,以CaMKIIδ为靶点治疗这些心血管疾病具有极佳的应用前景。尽管已有些CaMKII抑制剂的临床前研究被报道,然而实际治疗时会遇到一些麻烦,例如可能抑制其他离子通道或激酶、影响心脏以外其他组织的CaMKII而导致副作用、需要每天服药等[7]。研究发现,CaMKIIδ调节域上的Met281和Met282被氧化后,可阻止其催化结构域与自抑制区域的结合,导致其激酶活性的过度活化[8]。将这两个蛋氨酸换成其他氨基酸可防止CaMKIIδ的氧化及其过度活化,具有保护心脏的作用[9]。另外,这两个蛋氨酸都位于11号外显子上,它们的碱基改变并不影响CaMKIIδ的选择性剪接。因此靶向氧化激活位点会同时影响所有的CaMKIIδ剪接变体,如CaMKIIδB、δC和δ9[10]。
2023年1月,Science上报道了一种使用CRISPR-Cas9腺嘌呤碱基编辑器(ABE)靶向消除CaMKIIδ的氧化激活位点,以实现永久性治疗心血管疾病的先进性疗法。研究者先在人诱导性多能干细胞(iPSCs)及其体外分化的心肌细胞中,采用ABE编辑CaMKIIδ基因来高效替换氧化敏感的Met281和Met282,进而保护心肌细胞免受缺血/再灌注(IR)损伤。进一步在小鼠IR损伤实验中,通过AAV9介导心脏特异性的在体CaMKIIδ碱基编辑,使得心脏从严重损伤中恢复功能[11]。
根据CRISPR-Cas9腺嘌呤碱基编辑(ABE)的特性:允许在不引入双链DNA断裂的情况下将腺嘌呤精确转换为鸟嘌呤核苷酸[1, 2],研究者推断通过ABE将ATG转换成GTG,使得Val取代氧化敏感的Met,实现CaMKIIδ对氧化活化不敏感(图一A)。研究者首先设计6个sgRNA,各自覆盖了Met281(c.841A)和Met282(c.844A)的基因组区域(图一B)。ABE系统筛选了ABEmax和ABE8e,其中工程化的脱氨酶分别与SpCas9或其变体SpRY相融合。通过在HEK293细胞上组合筛选获得最佳的碱基编辑组分,并在iPSCs细胞中进行验证。Sanger测序结果显示,sgRNA1与ABE8e-SpCas9的组合在编辑c.A841G(p.M281V)时具有最高的编辑效率(图一C),而sgRNA6与ABE8e-SpRY组合显示了更宽的编辑窗口,包括c.A841G(p.M281V)、c.A844G(p.M282V)和c.A848G(p.H283R)(图一D),结果与HEK293细胞相同。研究者还分析了潜在的脱靶编辑,扩增子深度测序发现sgRNA6+ABE8e-SpRY组合没有对CaMKIIα或CaMKIIγ进行基因组编辑。尽管sgRNA6与人CaMKIIβ基因的序列一致,但是CaMKIIβ在人心肌细胞中并不表达[5],因此影响极小。通过CRISPOR确定的前八个潜在脱靶位点中,测序分析显示在DAZL基因PAM上游13位的A被编辑成G,而该编辑位点位于内含子区域[12],不会产生有害后果。其他预测脱靶位点的编辑小于0.2%,可被认为是非特异性背景。
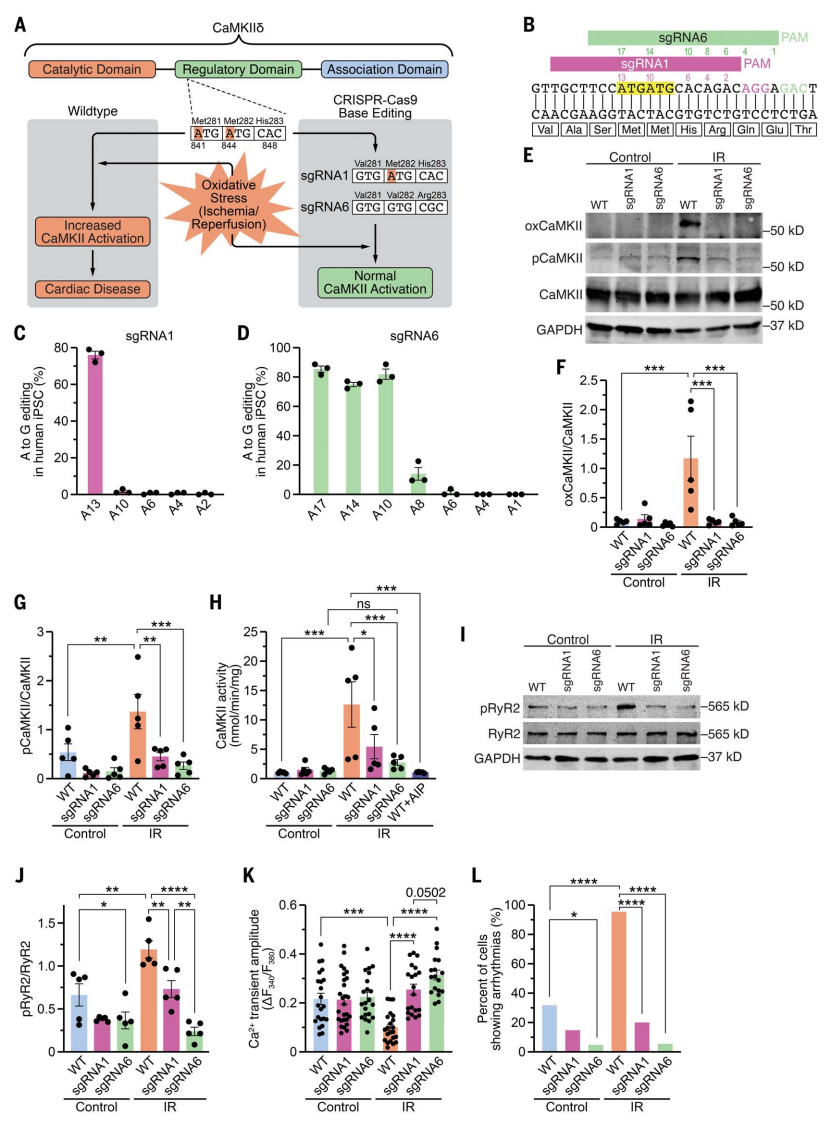
图一 人iPSCs及其分化心肌细胞中的CaMKIIδ基因组编辑[11]
接着,为研究这两种ABE编辑后的生理效果,研究者采用sgRNA1、sgRNA6或无sgRNA(野生型,WT)在人iPSC上进行ABE编辑,构建了三株基因型纯合的iPSC细胞系,并分化为心肌细胞(iPSC-CMs)。使用缺氧室模拟IR损伤,经Western blot(WB)检测显示,三株iPSC-CMs中CaMKII的蛋白总量没有差异。IR损伤后,WT组出现CaMKII氧化、自磷酸化以及酶活性的增加,而这些在sgRNA1和sgRNA6实验组中均显著减少(图一E-H)。IR损伤后,CaMKII活性依赖的2型赖氨酸受体(RyR2)的S2814磷酸化在WT组中同样增加,但在sgRNA1和sgRNA6 实验组中显著下调(图一I和J)。IR损伤后,WT组显示舒张期Ca2+水平升高,Ca2+瞬时振幅降低以及心律不齐;相比之下,sgRNA1和sgRNA6实验组可保护心肌细胞免遭有害Ca2+变化的影响(图一K和L)。
鉴于sgRNA6的ABE编辑对人iPSC-CMs的保护作用大于sgRNA1,研究者使用小鼠sgRNA6与ABE8e-SpRY组合在12周龄雄性C57BL/6小鼠体内进行ABE编辑,以消除CaMKIIδ氧化激活位点(图二A)。将ABE拆成两个部分装载在两个AAV9中,双AAV9递送系统在split-intein的介导下可在体内恢复ABE的活性,并用心脏特异性心肌肌钙蛋白T(cTnT)启动子来驱动ABE的表达。小鼠心脏IR损伤后,直接将AAV9-ABE-sgRNA6注射到心脏损伤区域,IR对照组小鼠注射对照AAV9或不注射,假手术组小鼠仅接受45分钟的开胸手术(图二A)。在IR损伤之前,超声心动图显示所有小鼠均表现出正常的心脏功能和组间相似的缩短分数。IR手术后24小时,所有实验组小鼠的心脏功能都出现了类似程度的下降,而AAV9-ABE-sgRNA6(IR+Edit)实验组小鼠在2周后开始恢复功能,3周后显示出进一步的心脏改善,缩短分数水平与假手术组小鼠相当(图二 B和C)。IR对照组小鼠在IR损伤后观察到左心室舒张末期扩张,这是心力衰竭的一个标志性特征,但并没有在IR+Edit实验组小鼠中观察到(图二D)。对IR损伤后4周的小鼠进行心脏磁共振成像,发现对照组小鼠的心脏功能受损,而IR+Edit实验组小鼠的心脏功能恢复,结果与超声心动图相似(图二E)。以上数据表明,靶向CaMKIIδ氧化激活位点的碱基编辑可改善小鼠IR损伤后的体内心脏功能
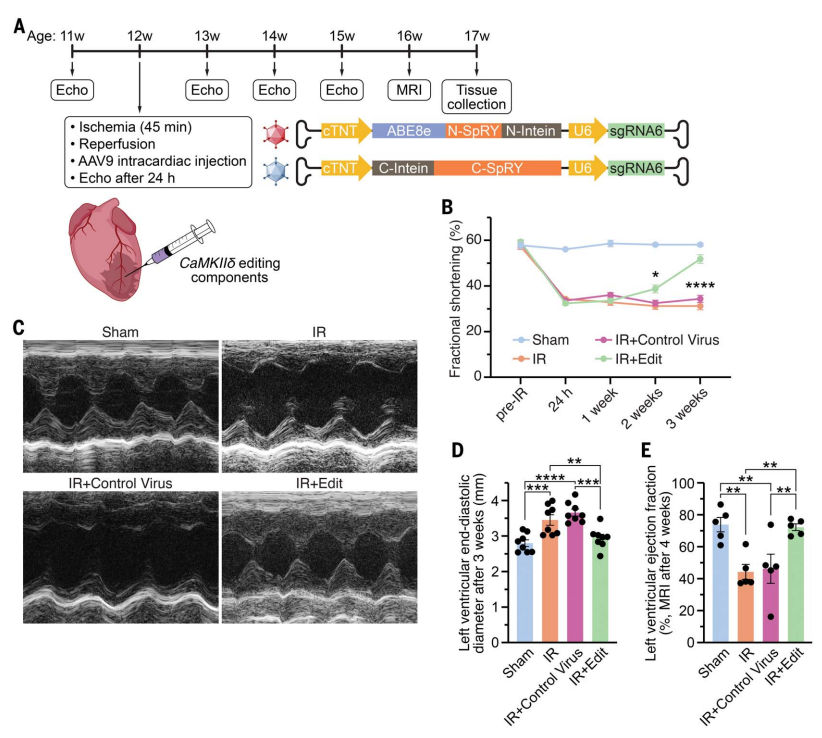
图二 靶向CaMKIIδ的碱基编辑可在体改善IR损伤后的小鼠心脏功能[11]
进一步地,研究者对IR损伤处理5周后的小鼠心脏组织进行分子水平分析。扩增子深度测序显示,IR+Edit实验组的A•G编辑效率在DNA和cDNA水平上显著不同(图三A),这种差异可以解释为大多数心脏CaMKIIδ在心肌细胞中表达,而心肌细胞是cTnT驱动的ABE系统唯一靶向的细胞类型[13]。在cDNA水平上检测到心脏前壁的编辑效率很高(图三B和C),表明在损伤区域的几乎所有心肌细胞中,两个Met都被有效替换。各组小鼠心肌转录组范围内的A•I编辑效率相当(图三D),表明没有脱靶编辑。WB分析显示,IR对照组小鼠的CaMKII氧化水平在IR损伤后增加了4.4倍,CaMKII自身磷酸化和活性也都增加;相应地,IR+Edit实验组小鼠的CaMKII水平均保持正常(图三E-H)。另外,CaMKII依赖的RyR2磷酸化也在IR损伤后的对照组小鼠中增加,但IR+Edit实验组没有变化(图三I和J)。经RNA测序发现,IR+Edit实验组小鼠的心脏相比IR对照组有101个特异性上调基因和108个下调基因(图三K)。进一步GO分析显示,与心脏功能和疾病相关的通路在IR对照组中失调,但在IR+Edit实验组中得到挽救(图三L-M)。
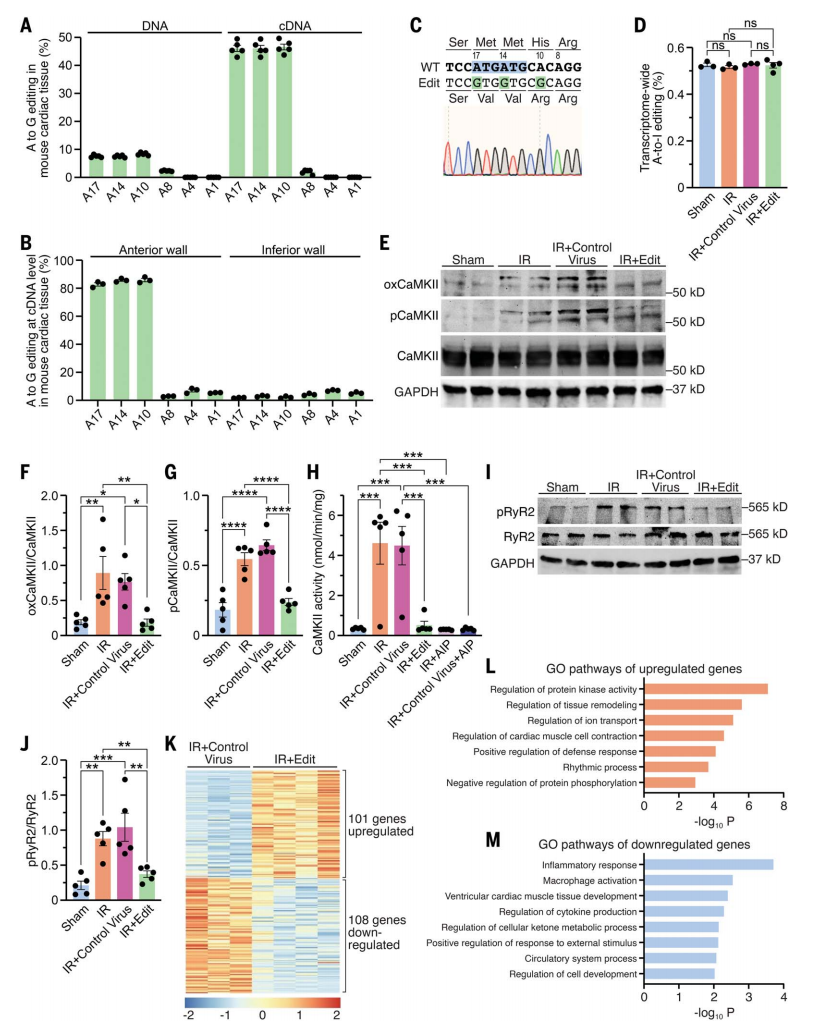
图三 IR+Edit实验组小鼠的心脏CaMKIIδ基因组编辑分析[11]
最后,研究者将各组小鼠的心脏切片经TUNEL染色后发现,IR损伤后凋亡细胞的百分比显著增加,而IR+Edit实验组的凋亡细胞比例与假手术组小鼠相当(图四A和B)。IR损伤后心脏的纤维化组织面积增加了2.7倍,而IR+Edit实验组对纤维化具有保护作用(图四C和D)。以上数据表明,靶向CaMKIIδ的碱基编辑可防止IR损伤后心肌细胞死亡和纤维化。此外,研究者还对出生第5天的小鼠腹腔注射AAV9-ABE-sgRNA6,长期观测260天后,小鼠表型没有出现异常。
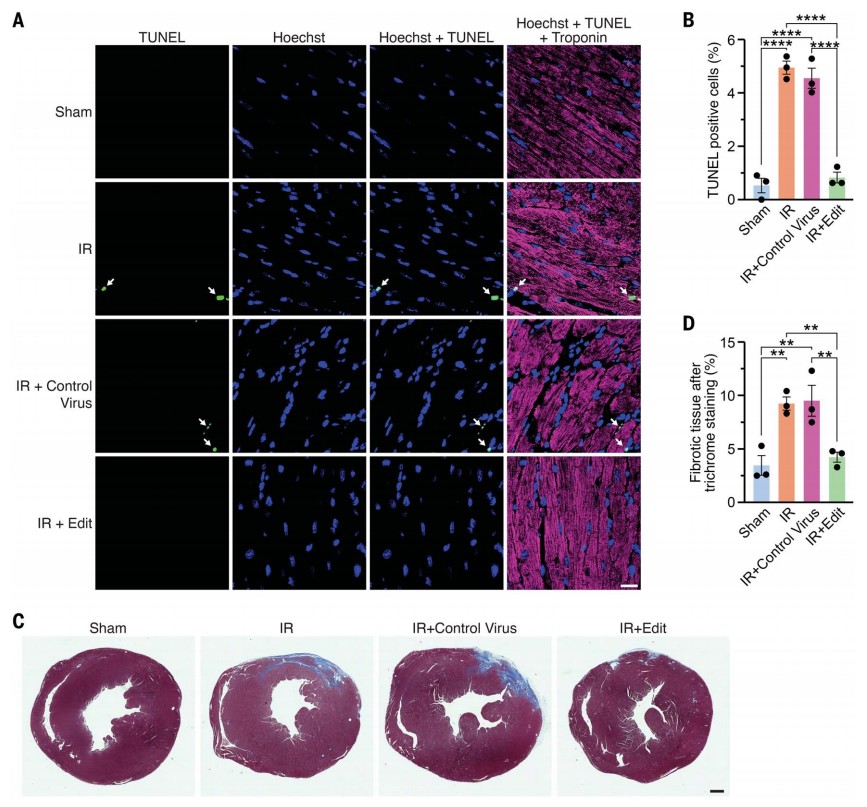
图四 靶向CaMKIIδ的碱基编辑可防止IR损伤后的心肌细胞死亡和纤维化[11]
综上所述,研究者开发的AAV9递送心脏特异性CRISPR-Cas9腺嘌呤碱基编辑器,可以实现永久性改变心肌细胞的CaMKIIδ基因组,消除氧化敏感的Met,进而保护心肌细胞免受缺血/再灌注损伤,有效地克服了现有CaMKIIδ抑制剂治疗心血管疾病的许多限制。通过进一步安全性及有效性评价,该碱基编辑疗法有望用于心肌梗塞等心血管疾病的联合辅助治疗。这种通过破坏病理信号通路的基因疗法策略,可为治疗其他人类疾病提供普适性借鉴意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Liu N, Olson EN: CRISPR Modeling and Correction of Cardiovascular Disease. Circ Res 2022, 130(12):1827-1850.
2. Amoasii L, Hildyard JCW, Li H, Sanchez-Ortiz E, Mireault A, Caballero D, Harron R, Stathopoulou TR, Massey C, Shelton JM et al: Gene editing restores dystrophin expression in a canine model of Duchenne muscular dystrophy. Science 2018, 362(6410):86-91.
3. Virani SS, Alonso A, Aparicio HJ, Benjamin EJ, Bittencourt MS, Callaway CW, Carson AP, Chamberlain AM, Cheng S, Delling FN et al: Heart Disease and Stroke Statistics-2021 Update: A Report From the American Heart Association. Circulation 2021, 143(8):e254-e743.
4. Beckendorf J, van den Hoogenhof MMG, Backs J: Physiological and unappreciated roles of CaMKII in the heart. Basic Res Cardiol 2018, 113(4):29.
5. Zhang T, Brown JH: Role of Ca2+/calmodulin-dependent protein kinase II in cardiac hypertrophy and heart failure. Cardiovasc Res 2004, 63(3):476-486.
6. Lebek S, Pichler K, Reuthner K, Trum M, Tafelmeier M, Mustroph J, Camboni D, Rupprecht L, Schmid C, Maier LS et al: Enhanced CaMKII-Dependent Late I(Na) Induces Atrial Proarrhythmic Activity in Patients With Sleep-Disordered Breathing. Circ Res 2020, 126(5):603-615.
7. Nassal D, Gratz D, Hund TJ: Challenges and Opportunities for Therapeutic Targeting of Calmodulin Kinase II in Heart. Frontiers in pharmacology 2020, 11:35.
8. Erickson JR, Joiner ML, Guan X, Kutschke W, Yang J, Oddis CV, Bartlett RK, Lowe JS, O'Donnell SE, Aykin-Burns N et al: A dynamic pathway for calcium-independent activation of CaMKII by methionine oxidation. Cell 2008, 133(3):462-474.
9. Luo M, Guan X, Luczak ED, Lang D, Kutschke W, Gao Z, Yang J, Glynn P, Sossalla S, Swaminathan PD et al: Diabetes increases mortality after myocardial infarction by oxidizing CaMKII. The Journal of clinical investigation 2013, 123(3):1262-1274.
10. Zhang M, Gao H, Liu D, Zhong X, Shi X, Yu P, Jin L, Liu Y, Tang Y, Song Y et al: CaMKII-delta9 promotes cardiomyopathy through disrupting UBE2T-dependent DNA repair. Nat Cell Biol 2019, 21(9):1152-1163.
11. Lebek S, Chemello F, Caravia XM, Tan W, Li H, Chen K, Xu L, Liu N, Bassel-Duby R, Olson EN: Ablation of CaMKIIdelta oxidation by CRISPR-Cas9 base editing as a therapy for cardiac disease. Science 2023, 379(6628):179-185.
12. Concordet JP, Haeussler M: CRISPOR: intuitive guide selection for CRISPR/Cas9 genome editing experiments and screens. Nucleic Acids Res 2018, 46(W1):W242-W245.
13. Uhlen M, Fagerberg L, Hallstrom BM, Lindskog C, Oksvold P, Mardinoglu A, Sivertsson A, Kampf C, Sjostedt E, Asplund A et al: Proteomics. Tissue-based map of the human proteome. Science 2015, 347(6220):1260419.



