技术分享:细胞外囊泡递送CRISPR/CasRx可作为一种新型RNA编辑工具
CRISPR/Cas基因编辑系统是操纵DNA和RNA的有力工具[1]。但由于装载大小的限制,CRISPR/Cas系统的递送成为限制其广泛应用的一个主要障碍[2]。细胞外囊泡(extracellular vesicles,EVs)是介导细胞间和器官间通讯的媒介,它广泛存在于各种体液中,可携带蛋白质、脂类、DNA、mRNA、miRNA等物质。EVs与细胞及器官的生物调节、合成和代谢密切相关,并且在各种疾病的进程中也发挥着重要作用[3]。来自细胞的各种RNA、DNA、蛋白质和代谢物等,都可以被EVs包裹并运送到邻近或远处的细胞内。随着生物技术和研究方法的发展,天然的EVs已经不能满足人们的需求。近几年已报道利用EVs成功递送CRISPR/Cas9系统进行高效的DNA基因编辑,然而EVs递送的RNA编辑工具还未见报道。
2023年2月,Advanced Science期刊报道了一种采用工程化EVs递送的RNA编辑系统,实现了更简单、更有效的CRISPR/CasRx递送。这种EVs递送的CasRx/gRNA复合物可以快速且短暂地破坏外源性基因和内源性基因的RNA,并最终降低了靶蛋白的表达。这一多功能的RNA编辑工具对于短暂干预治疗急性疾病十分有用[4]。
CasRx是一种可在体内和体外高效编辑RNA的蛋白。首先,为了更好地将CasRx装载入EVs,研究者选择tPA、小鼠Ig重链、人胰岛素三种信号肽等分别与CasRx的N末端融合,C末端与HA标签融合,构建了六组质粒(图一a)。随后将其转染至HEK293T细胞中,并使用已建立的方法从细胞中提取工程化EVs,发现从转染了CAG-tPA-CasRx-HA-pA-CMV-mCherry的 tPA实验组分离得到的EVs包含有最多的CasRx蛋白(图一b和c,编号4)。免疫细胞化学(ICC)染色表明CasRx确实装载在EVs中。与携带核定位信号(NLS)的对照组相比,tPA实验组的CasRx与EVs标志物CD63的共定位最强(图一d-f,编号4),以及CasRx+和mCherry–的比值最高(图一d和g)。酶联免疫吸附试验(ELISA)发现超过三分之二的CasRx被EVs包裹(图一h)。以上数据表明,携带tPA的CasRx可以被有效地包装到EVs中。由于其序列短,tPA可以作为工程化EVs中更简单的靶蛋白传递配体。
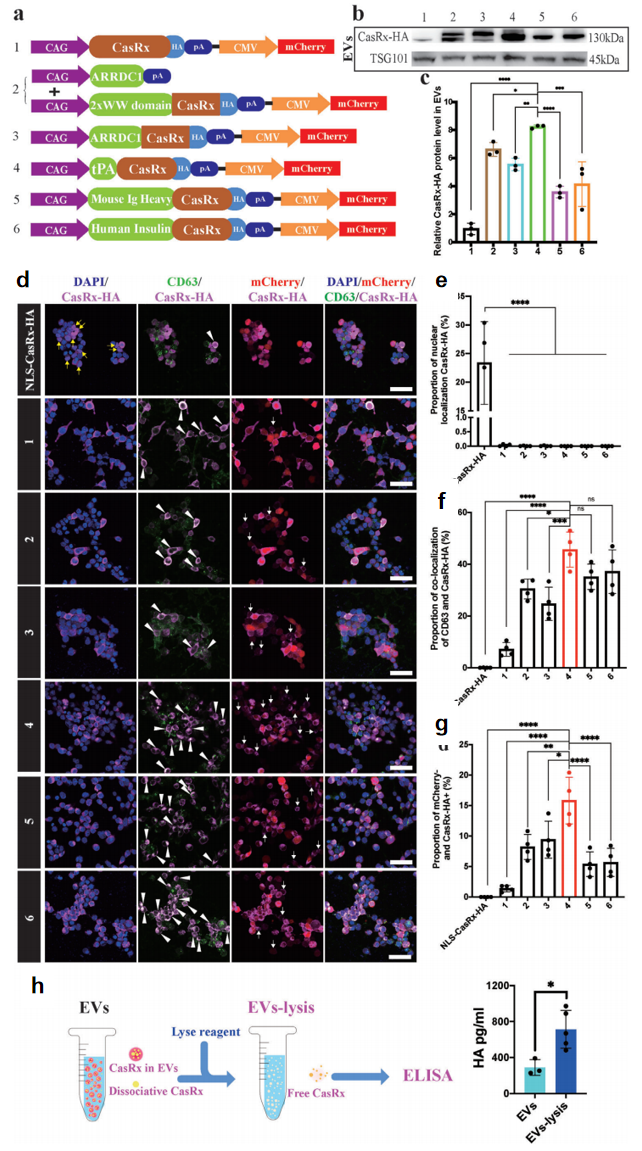
图一 EVs介导的CasRx细胞递送[4]
研究者进一步将携带CasRx以及靶向mCherry gRNA的EVs(EVs-mCherry)和对照组EVs(EVs-ctrl)分别进行细胞膜远红外荧光探针DiD标记,并添加到过表达mCherry的HEK293T细胞培养基中(图二a)。ICC结果显示,EVs-mCherry实验组以剂量依赖的方式抑制了mCherry的表达(图二b和c)。EVs递送的蛋白质是在其进入靶细胞后立即发挥作用,随后CasRx蛋白和/或靶向mCherry的gRNA被靶细胞降解(图二d)。因此,利用EVs递送CasRx是一种相对短效程的RNA干扰方法。在同时过表达mCherry和Zsgreen荧光蛋白的Neuro-2a细胞系中加入EVs(图二e),发现与EVs-ctrl和无添加EVs对照组相比,在EVs-mCherry实验组中mCherry的表达显著减少,但Zsgreen的表达没有变化(图二f)。为了测试递送CasRx/gRNA的EVs是否可以降低不同细胞系中血管内皮生长因子A(VEGFA)的表达,研究者将靶向小鼠和人VEGFA的双gRNAs通过一个直接重复序列(DR)连接起来[5]。经EVs-VEGFA处理后,293T、N2a、GL261和Bend.3细胞中的VEGFA mRNA水平显著降低(图二g-j)。以上数据表明,EVs递送的CasRx/gRNA系统能够快速且短暂地减少外源性基因和内源性基因的表达。
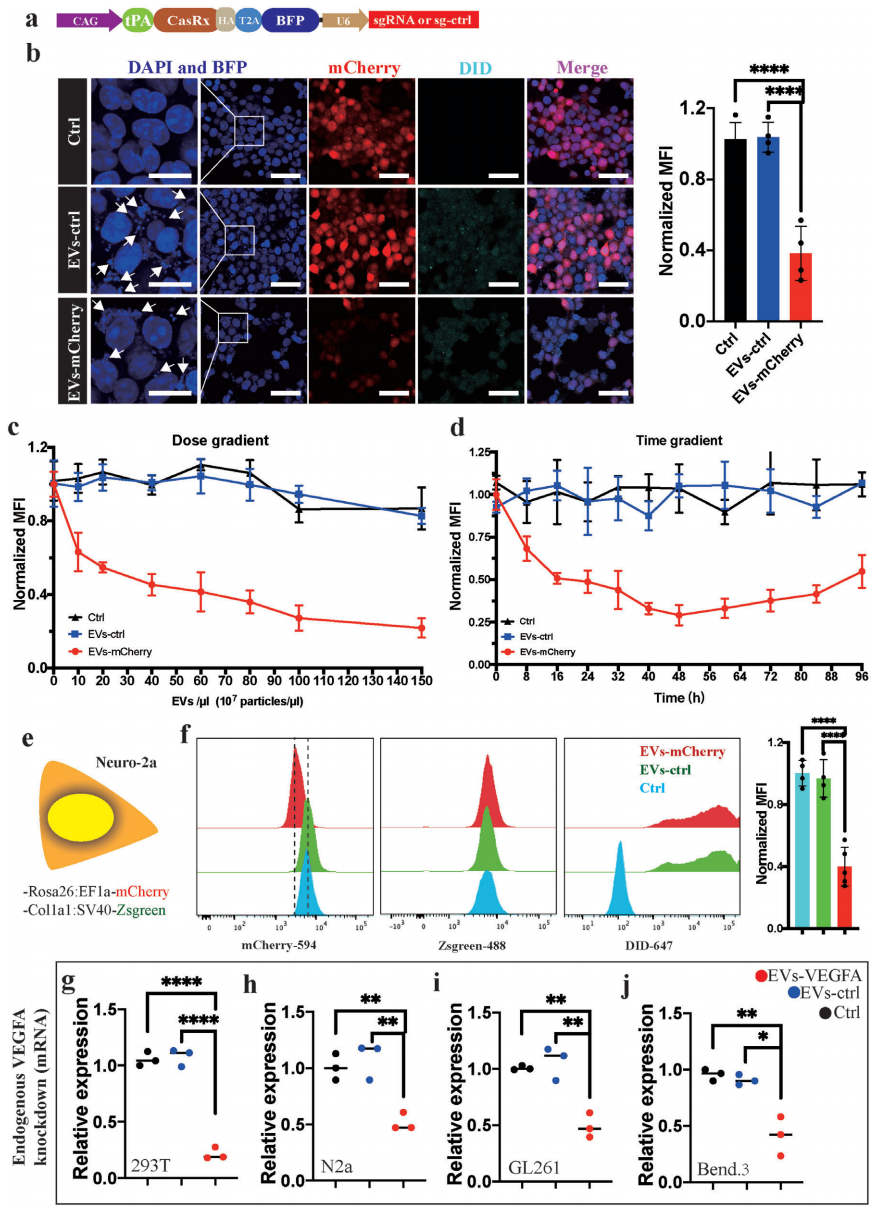
图二 EVs-CasRx/gRNA系统可在体外抑制外源性和内源性基因的表达[4]
急性炎症疾病是典型的常见临床疾病,经常需要紧急干预治疗。研究者采用脂多糖(LPS)诱导急性炎症模型来评价体外治疗效果,分离出小鼠骨髓源性巨噬细胞(BMDM),并在LPS刺激的同时添加了EVs(图三a)。EVs包括EVs-1、EVs-2和EVs-3,其主要成分基本相同,但携带不同的sgRNA,不同组合地靶向细胞因子IL-6、TNF和IL-1β(图三b)。处理2天后,发现EVs实验组的巨噬细胞标志物一氧化氮合酶2(NOS2)的表达显著低于对照组,其中EVs-3实验组显示出最佳的抑制效率(图三c)。流式细胞术分析发现EVs实验组的M1型巨噬细胞的标志物CD86+细胞比例低于对照组,且EVs-3实验组最低(图三d)。此外,ICC染色和RNA测序的结果也证实了这一点(图三e-g)。因此,研究者选择EVs-3进行后续实验。以上数据表明,携带CasRx和靶向细胞因子gRNA复合物的EVs能够在体外抑制巨噬细胞的M1表型极化,并减轻急性炎症反应。
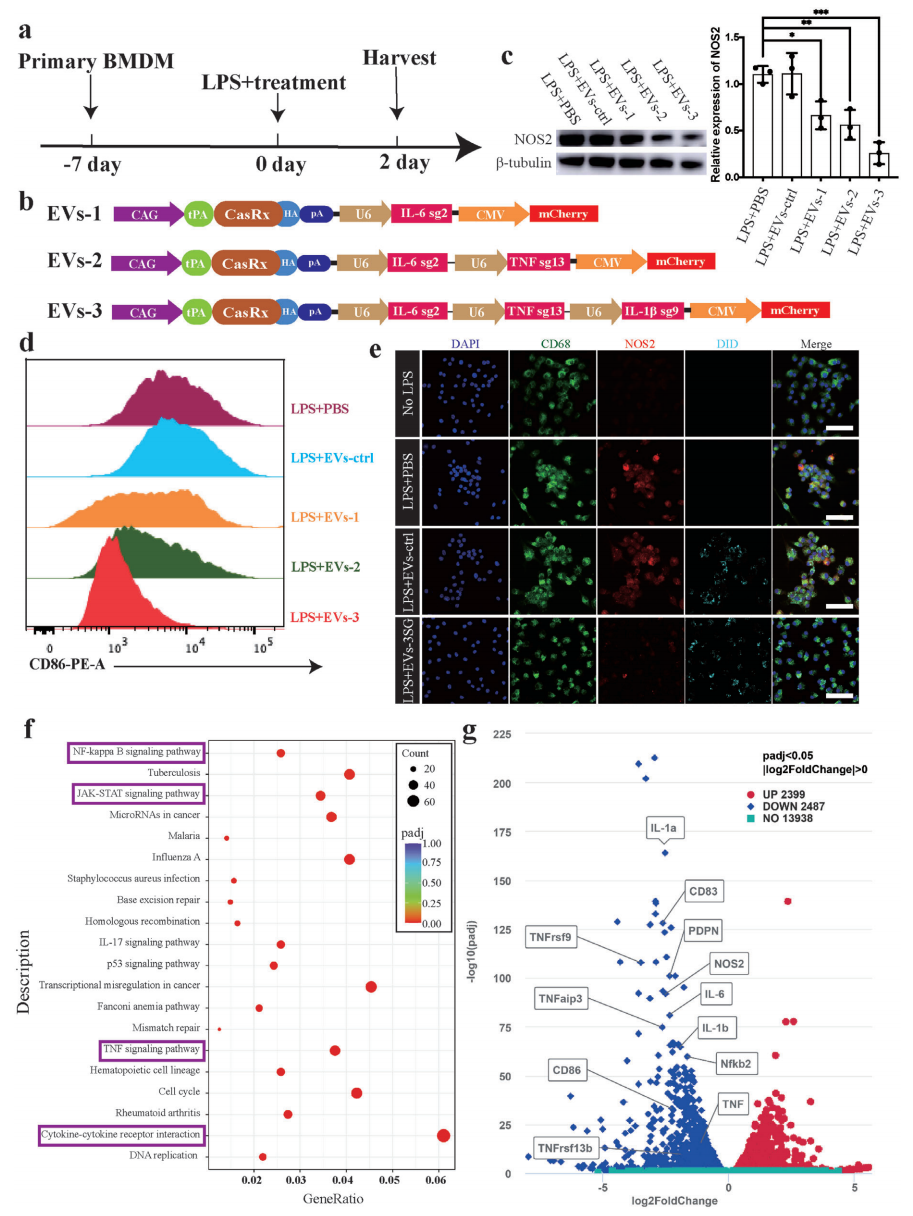
图三 EVs-3可体外抑制巨噬细胞极化[4]
接着,研究者检测EVs-3能否减轻LPS诱导的急性肺损伤(ALI)。在LPS诱导的ALI小鼠模型中,进行4次支气管内注射EVs(图四a),发现EVs-3实验组能显著降低肺部组织的细胞因子IL-6、TNF和IL-1β mRNA表达(图四b)。随后收集支气管肺泡灌洗液(BALF),使用ELISA检测细胞因子水平,也发现EVs-3实验组降低了这三种细胞因子的水平(图四c),改善了肺组织损伤(图四e),以及减少了细支气管与肺泡中单核细胞和中性粒细胞的浸润(图四d和f-g)。以上数据表明,EVs-3的给药处理可以改善LPS诱导ALI模型中的肺损伤。
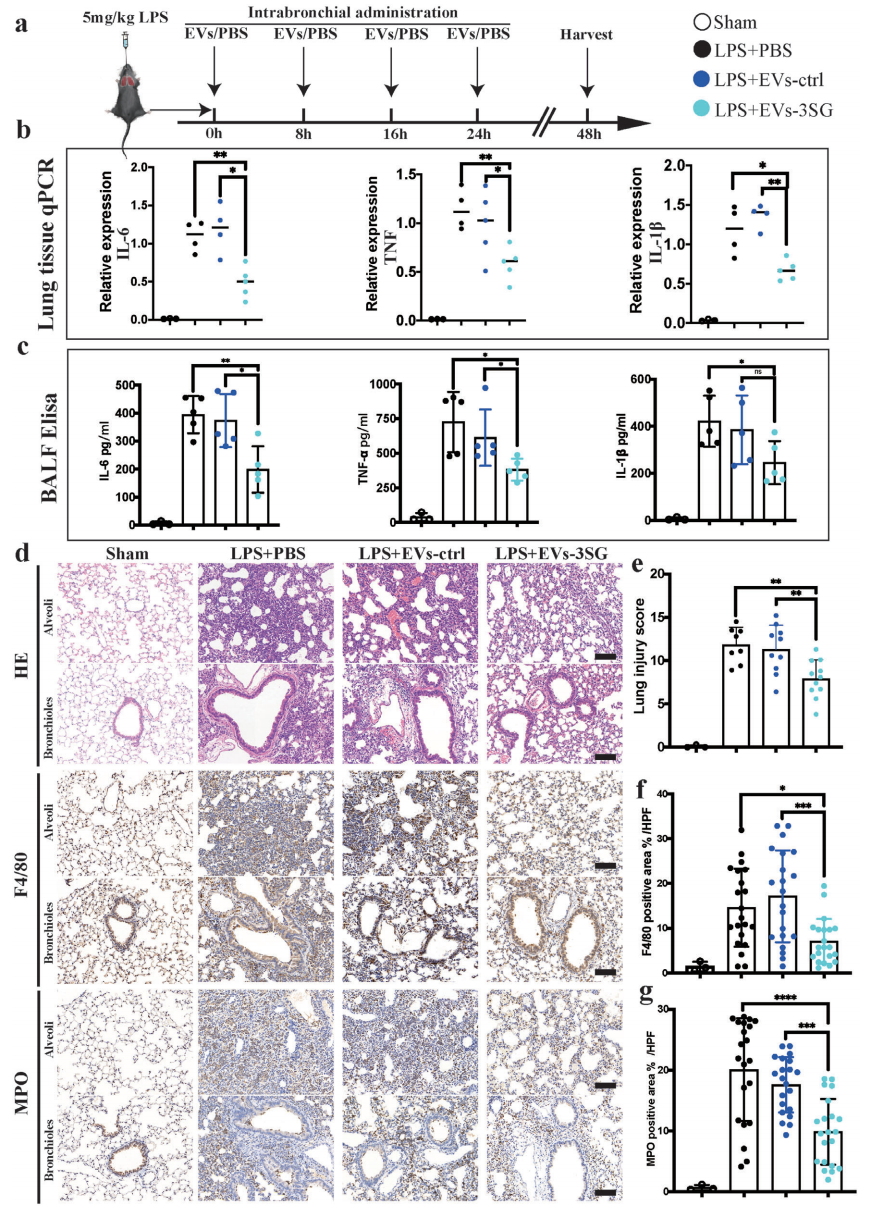
图四 EVs-3给药可改善LPS诱导ALI模型中的肺损伤[4]
最后,研究者检测EVs-3能否阻止LPS诱导败血症模型中的严重免疫反应。通过腹腔注射致死剂量的LPS(C57BL/6小鼠40 mg/kg,BALB/c小鼠30 mg/kg)建立小鼠败血症模型,并注射4次EVs-3进行治疗(图五a)。结果显示,接受EVs-3治疗的C57BL/6和BALB/c小鼠生存时间延长,其中2只C57BL/6小鼠存活到实验结束(图五b和c)。接着,研究者通过腹腔注射亚致死剂量的LPS(C57BL/6小鼠25 mg/kg)观测EVs-3治疗对败血症模型的保护作用(图五d)。在LPS造模48小时后收集小鼠组织,并对肺、肝、肾、脾、心进行组织学检查。与ALI模型的结果类似,EVs-3治疗明显减轻了肺损伤(图五e和f),气管内LPS给药引起的组织损伤明显比全身LPS给药引起的组织损伤更严重(图五b和e)。此外,EVs-3治疗减少了肝脏内炎症细胞的聚集(图五e和h),以及脾脏的生发中心异常(图五e和i)。急性肾损伤是败血症常见的并发症[6],EVs-3治疗也能减轻肾小管细胞的损伤,减少炎症细胞聚集和管型形成(图五e和g)。而该模型的心脏炎症反应并不严重(图五e和j)。以上数据表明,在LPS诱导的败血症模型中,EVs-3治疗能够显著减轻急性期的器官损伤。
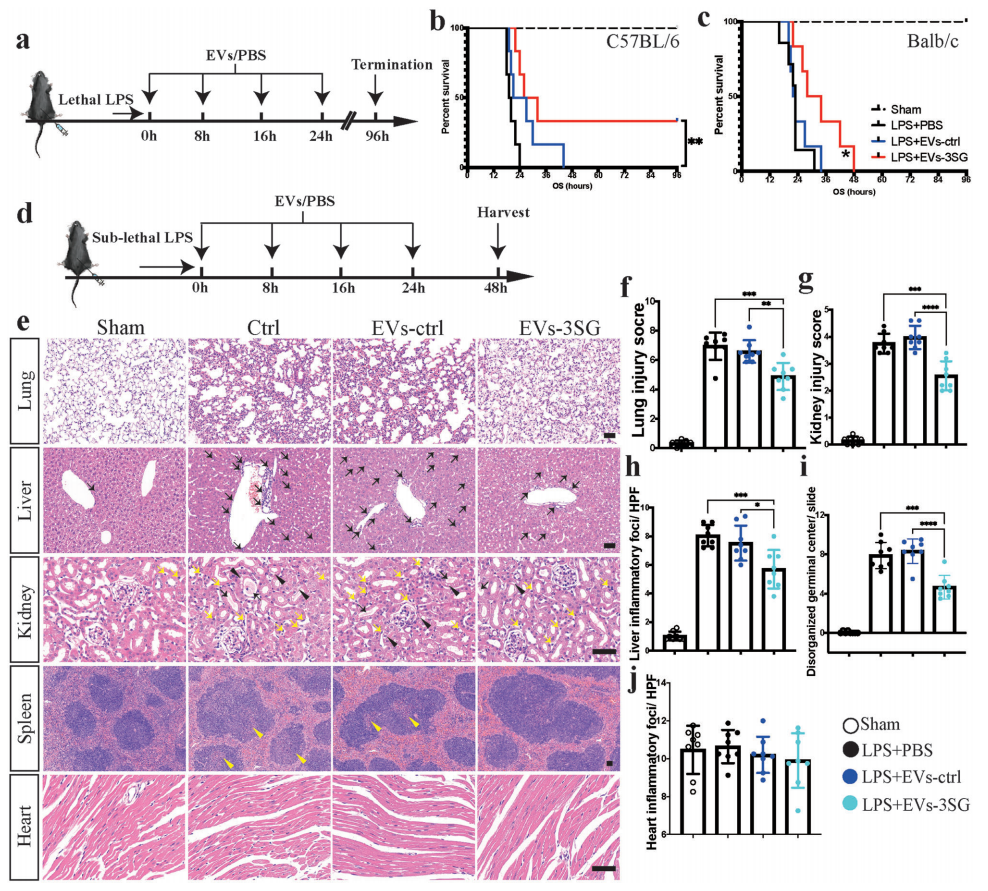
图五 EVs -3治疗可减轻败血症模型的死亡率和器官损伤[4]
综上所述,研究者开发了一种利用细胞外囊泡(EVs)递送CRISPR/CasRx和gRNA复合物的RNA编辑工具,能够快速抑制靶基因表达,并在执行功能后被快速分解代谢,具有迅速效应性和短时效性。相比DNA编辑系统,是一种更为安全的编辑工具。该工具可同时靶向多个细胞因子,特别适用于急性炎症疾病的治疗,可在急性期改善LPS诱导的急性肺损伤和败血症反应,为其他急性疾病的短期干预治疗提供了潜在的可能。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Knott GJ, Doudna JA: CRISPR-Cas guides the future of genetic engineering. Science 2018, 361(6405):866-869.
2. van Haasteren J, Li J, Scheideler OJ, Murthy N, Schaffer DV: The delivery challenge: fulfilling the promise of therapeutic genome editing.Nature biotechnology 2020, 38(7):845-855.
3. Kalluri R, LeBleu VS: The biology, function, and biomedical applications of exosomes. Science 2020, 367(6478).
4. Li T, Zhang L, Lu T, Zhu T, Feng C, Gao N, Liu F, Yu J, Chen K, Zhong J et al: Engineered Extracellular Vesicle-Delivered CRISPR/CasRx as a Novel RNA Editing Tool. Advanced science 2023:e2206517.
5. Zhou C, Hu X, Tang C, Liu W, Wang S, Zhou Y, Zhao Q, Bo Q, Shi L, Sun X et al: CasRx-mediated RNA targeting prevents choroidal neovascularization in a mouse model of age-related macular degeneration. National science review 2020, 7(5):835-837.
6. Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, Schetz M, Tan I, Bouman C, Macedo E et al: Acute renal failure in critically ill patients: a multinational, multicenter study. Jama 2005, 294(7):813-818.



