技术分享:MESP1-RING1A复合物在心脏分化中的重要作用
先天性心脏病(congenital heart disease,CHD)是新生儿最常见的出生缺陷,也是婴幼儿死亡的主要病因,发病率约为1%。心脏发育过程由转录因子(transcription factor,TF)和表观遗传调节因子组成的复杂网络调控。在不同类型的CHD患者中发现了发育关键TF MESP1的突变。MESP1是一种碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)TF,在小鼠中胚层瞬时表达[1],不仅控制着产生第一和第二心区的最早心脏中胚层群体的细胞命运,还促使中胚层形成造血或骨骼肌肌源性祖细胞[2]。除转录因子外,染色质调节因子如多梳抑制复合体1(PRC1)、p300和黏连蛋白(cohesin)复合物也参与发育和干细胞命运决定的过程[3],它们在CHD患者中也存在致病的基因突变。PRC1包含有E3连接酶RING1A/RING1和RING1B/RNF2/RING2,可催化H2AK119位点的单泛素化修饰 (H2AK119ub1) [4]。然而,MESP1、PRC1、p300和cohesin在心脏分化过程中的功能机制尚不清楚。
2022年11月,Developmental Cell上报道了一项MESP1调控早期心脏发育的功能和分子机制研究,发现MESP1与PRC1核心蛋白RING1A存在相互作用,协同激活早期心脏发生基因,从而驱动中胚层形成和心脏谱系特化,该过程涉及增强子-启动子相互作用和p300介导的组蛋白乙酰化。CHD患者中发现的几个MESP1致病突变都削弱了与RING1A的相互作用,扰乱了心肌细胞的正常分化,揭示该机制对于心脏发育的重要性[5]。
研究者首先筛选了一个酵母双杂交cDNA文库,发现MESP1和RING1A存在相互作用。进而在HEK293T细胞中过表达HA和FLAG标记的蛋白,通过免疫共沉淀(co-IP)实验证明FLAG-MESP1与HA-RING1A相结合,但不与RING1B相结合(图一A和B)。在人类胚胎干细胞(hESC)体外分化第四天的心脏祖细胞中过表达FLAG-MESP1,也能检测到与内源性RING1A的共沉淀(图一C)。在hESC心肌细胞分化过程中,观察到RING1A在心脏发育基因上的染色质占据增强,并且分化到第四天时RING1A基因组结合区域的62%也被FLAG-MESP1共同结合,特别是二者共同占据的启动子区占80%(图一D和E)。研究者进一步构建了6个已报道的CHD相关MESP1突变[6](图一F),通过体外co-IP实验,发现这些致病突变均减弱了MESP1和RING1A之间的相互作用,其中突变E11D和L147Pfs*9的削弱作用最为明显(图一G)。以上数据表明,MESP1与RING1A存在相互作用,心肌细胞分化过程中共同染色质占据在心脏发生基因上,而MESP1致病突变会损害MESP1-RING1A之间的相互作用。
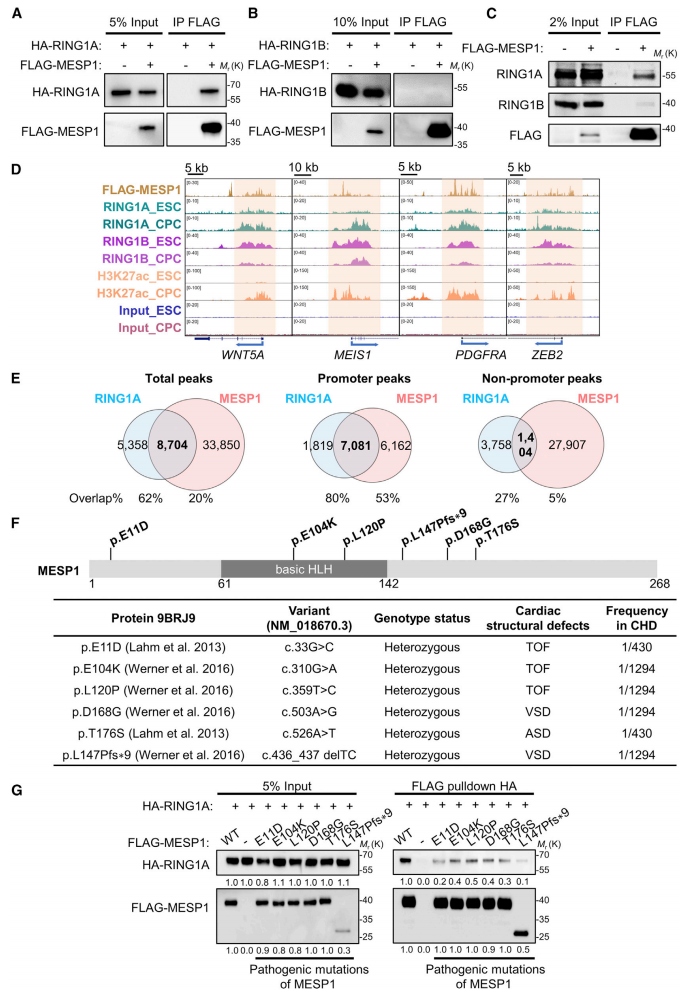
图一 MESP1-RING1A在心肌细胞分化过程中共同染色质占据心脏发生基因[5]
之前Ring1A-/-小鼠仅被报道出现中轴骨骼的发育异常[7],基于MESP1-RING1A的相互作用,研究者观测其心脏发育表型。与野生型(WT)小鼠相比,发现Ring1A-/- E8.75胚胎心管中的肌原纤维基因Tnnt2、Myh6、Myh7、Myl2和Myl7表达显著减少(图二A);透射电镜超微结构显示Ring1A-/- E16.5胚胎的心肌细胞出现肌丝紊乱和不规则的Z盘(图二B);心脏组织学分析还发现心脏发育迟缓、致密心肌层变薄、室间隔缺损(VSD)、主动脉骑跨、肺动脉狭窄等CHD患者表型(图二C-F)。以上数据表明,Ring1A在小鼠心脏发育过程中具有重要作用,Ring1A缺失导致小鼠心脏发育缺陷。
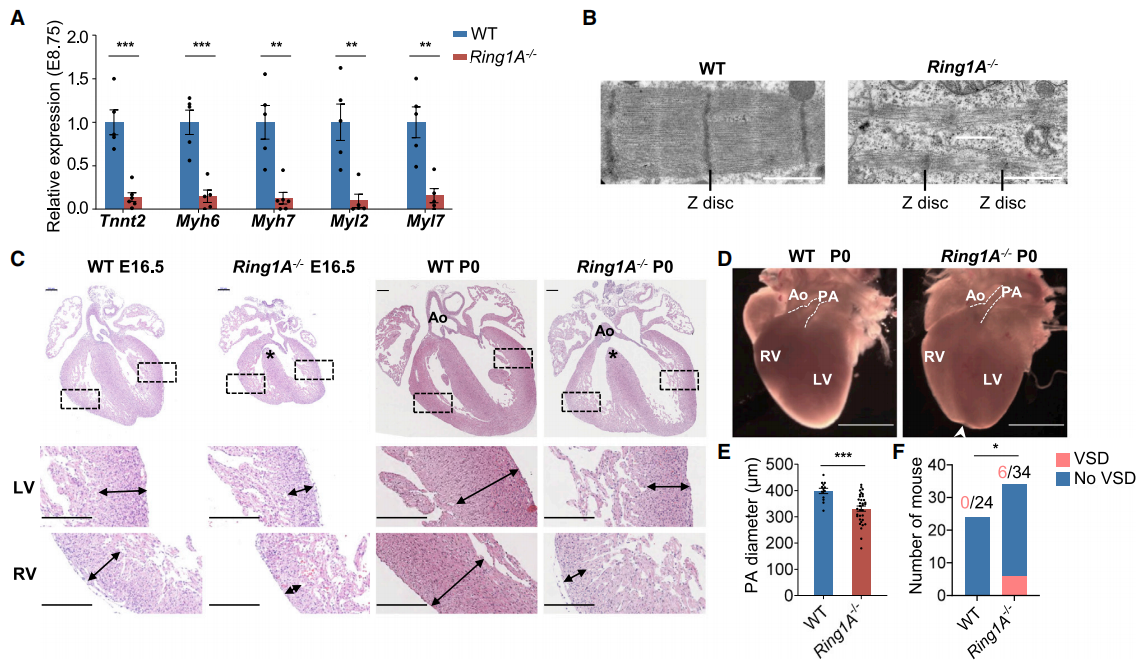
图二 Ring1A缺失损害小鼠正常心脏发育和心脏基因表达[5]
为了研究RING1A对人心肌细胞分化与功能的影响,研究者利用CRISPR系统获得RING1A KO hESC。正常情况下hESC分化第8天起可以观察到自发收缩的心肌细胞,而RING1A KO心肌细胞则表现出不规则且较慢的跳动速率(图三A),以及心肌肌钙蛋白T(cTnT)表达显著降低(图三B)。分化到第35天时,免疫荧光显示RING1A KO心肌细胞尺寸变大,且50%的细胞出现紊乱的肌节结构(图三C和D);同时肌纤维特异性结构基因和收缩调节基因的表达显著降低,但是缝隙连接基因CX43没有明显变化(图三E);自发钙瞬变出现波形异常(图三F和G),表明心肌收缩功能异常;虽然钙调节基因CAMK2D、CALM2和CALR的表达没有显著变化,但是钙调节基因CASQ2以及钙释放、再摄取和内流所必需的RYR2、SERCA2a和CACNA1C表达显著减少(图三H)。以上数据表明,Ring1A缺失破坏了心肌细胞肌原纤维基因、收缩调节基因和钙处理基因的表达,损害了人心肌细胞分化及其功能,这与Ring1A在小鼠心脏发育中的重要作用相一致。此外,研究者在hESC分化过程中过表达CHD相关MESP1突变蛋白,也观察到类似的心肌细胞分化异常现象。
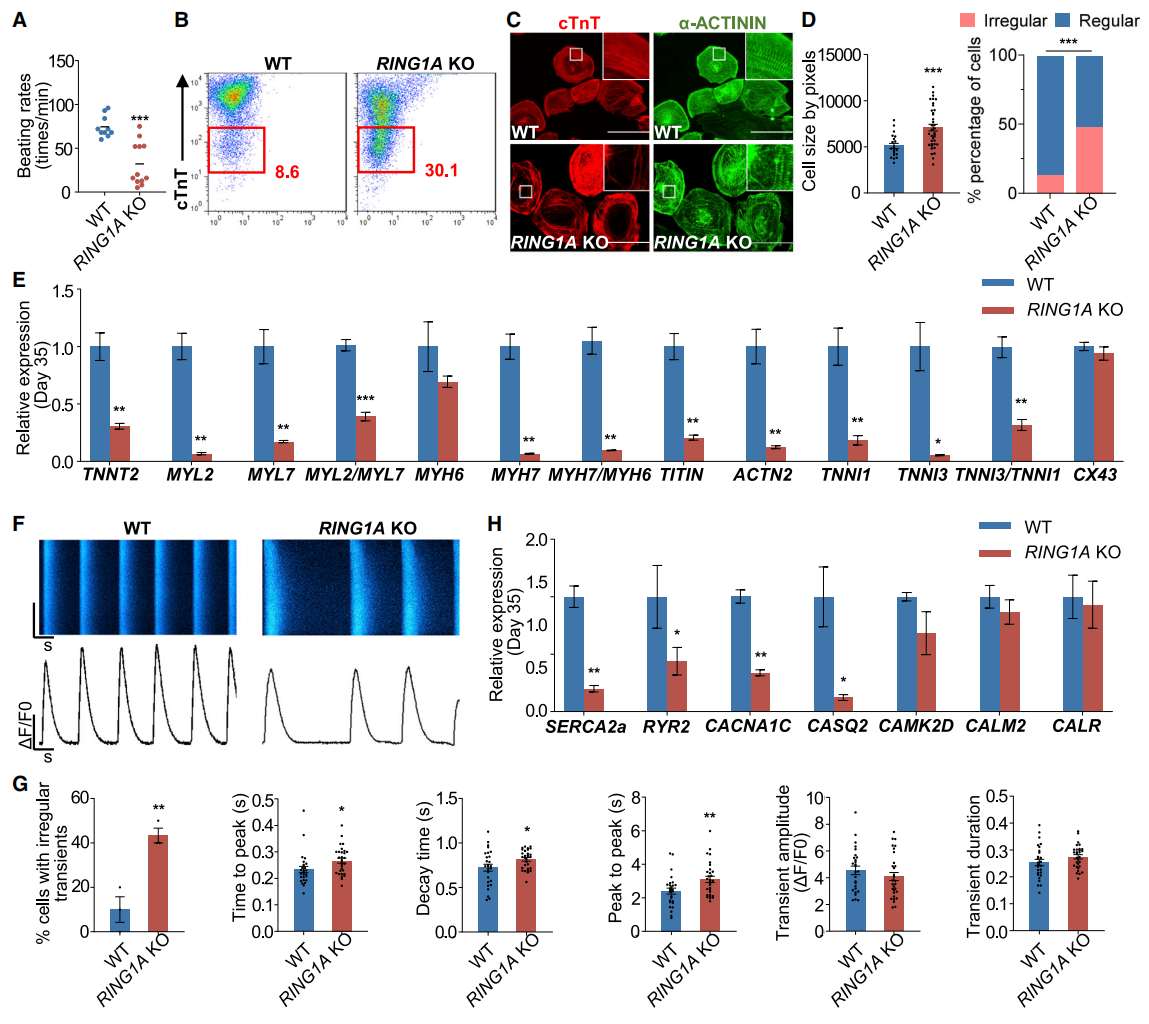
图三 RING1A是人心肌细胞分化及其功能所必需的[5]
由于MESP1的bHLH结构域直接结合DNA,研究者推测MESP1与RING1A的相互作用可能帮助了RING1A与靶基因的结合。于是,构建了MESP1 KO hESC,分化到心脏祖细胞阶段进行RING1A的ChIP-seq分析,发现MESP1 KO后造成RING1A在原MESP1-RING1A基因组共同结合区的80%都发生了显著性减少(图四A,cluster 1和2),这些靶基因主要富集在心血管系统发育,例如NCAM1, LEF1和MECOM基因(图四B)。进一步结合RNA-seq分析,发现RING1A结合的靶基因在RING1A KO后有1741个基因表达下调,1408个上调;而MESP1结合的靶基因在MESP1 KO后有1523个表达下调,1019个上调(图四C);两者交集的下调基因有358个(图四D),其中68个在早期中胚层祖细胞特化中起作用,75个与心肌病有关(图四E);部分重要靶基因的表达变化也通过RT-qPCR得到证实(图四F)。另外,研究者在hESC分化过程中过表达CHD相关MESP1突变蛋白,也观察到类似的RING1A在共同靶基因上的结合减弱(图四G),以及共同靶基因的激活表达受损(图四H)。以上数据表明,RING1A和MESP1的互作协同激活一群心脏分化关键基因的表达。
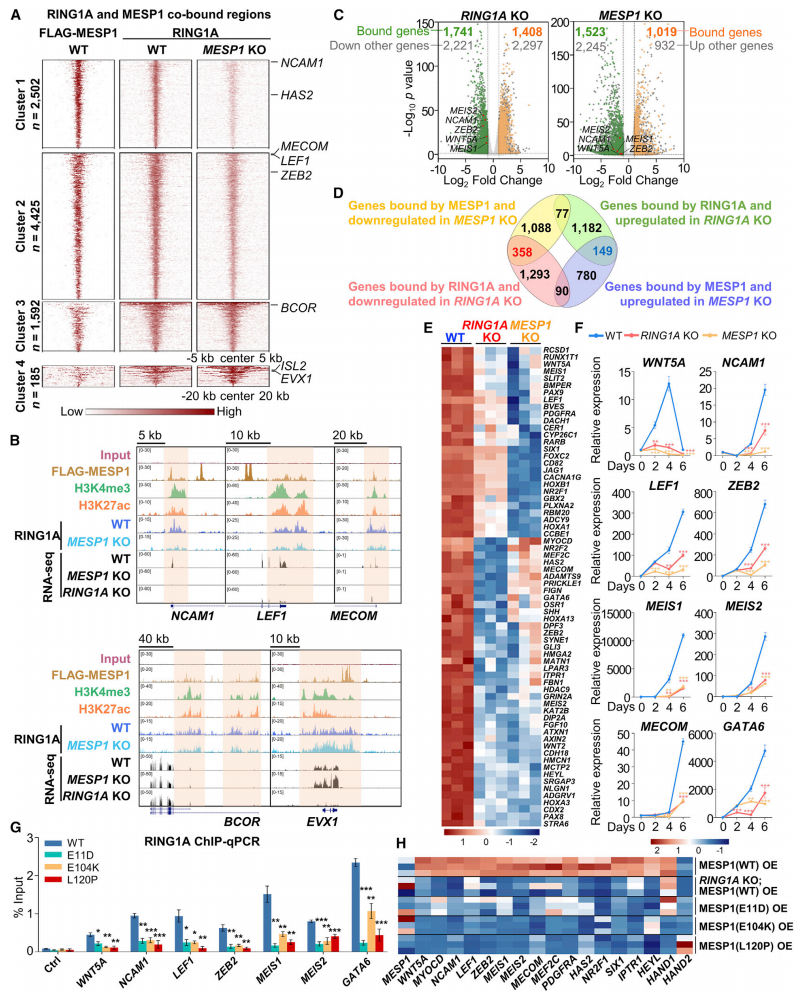
图四 RING1A-MESP1在心脏祖细胞阶段协同激活心脏发生基因的表达[5]
PRC1多被描述为转录抑制因子,主要通过染色质压缩来促进谱系定型,在分化过程中抑制多能性基因和其他谱系基因的表达[8]。那么PRC1复合体的核心蛋白RING1A又是如何与MESP1互作协同激活下游心脏发育基因的表达?研究者发现RING1A缺失后,其调控的下游靶基因启动子和增强子上H3K27ac水平下降(图五A和B)。Co-IP实验证明了FLAG-RING1A与组蛋白乙酰转移酶p300、cohesin组分(SMC1A、SMC3和RAD21)和CTCF的相互作用(图五C);FLAG-MESP1也与它们有着相互作用,并且随着RING1A KO相互作用减弱(图五D);过表达CHD相关MESP1突变蛋白后,这种相互作用也会随之减弱(图五G)。进一步地,研究者通过Hi-C和Virtual-4C检测到RING1A KO后心脏发生基因的增强子-启动子相互作用强度减弱(图五E和F)。以上数据表明, MESP1-RING1A可与p300、cohesin复合体相结合,通过影响组蛋白乙酰化、增强子-启动子染色质相互作用,协同激活下游心脏发生基因的表达。
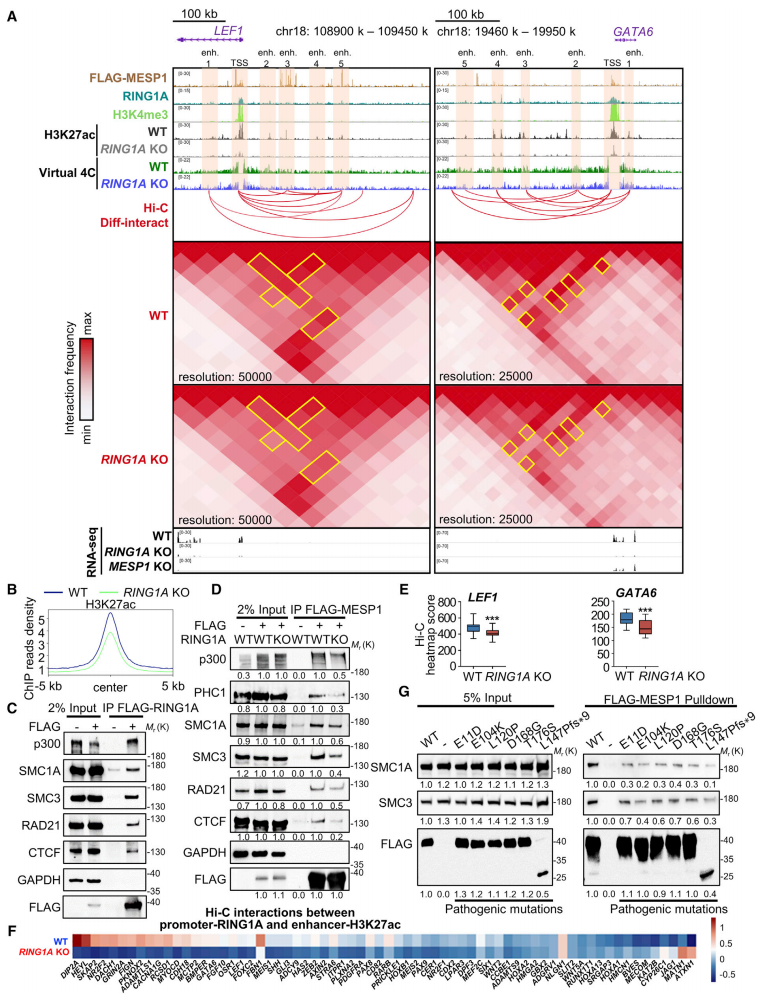
图五 RING1A通过影响H3K27ac和增强子-启动子互作激活心脏发生基因[5]
综上所述,利用人类胚胎干细胞心脏谱系分化和小鼠遗传模型,结合表观基因组学和3D基因组学方法,研究者发现MESP1-RING1A复合物通过与p300、cohesin和CTCF相互作用,介导组蛋白乙酰化和染色质互作,激活心脏发育所必需的下游靶基因表达。并且MESP1-RING1A对于心肌细胞分化及其正常功能是必需的,MESP1致病突变会损害MESP1-RING1A之间的相互作用,影响心脏发生基因的表达以及心肌的正常分化。该研究不仅揭示了MESP1-RING1A复合物在早期心脏发育中的重要功能,而且还为深入了解MESP1、PRC1、P300和cohesin突变导致先天性心脏病的致病机制提供了一种可能性解释。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Kitajima S, Takagi A, Inoue T, Saga Y: MesP1 and MesP2 are essential for the development of cardiac mesoderm. Development 2000, 127(15):3215-3226.
2. Chan SS, Shi X, Toyama A, Arpke RW, Dandapat A, Iacovino M, Kang J, Le G, Hagen HR, Garry DJ et al: Mesp1 patterns mesoderm into cardiac, hematopoietic, or skeletal myogenic progenitors in a context-dependent manner. Cell Stem Cell 2013, 12(5):587-601.
3. Brand M, Nakka K, Zhu J, Dilworth FJ: Polycomb/Trithorax Antagonism: Cellular Memory in Stem Cell Fate and Function. Cell Stem Cell 2019, 24(4):518-533.
4. Pierce SB, Stewart MD, Gulsuner S, Walsh T, Dhall A, McClellan JM, Klevit RE, King MC: De novo mutation in RING1 with epigenetic effects on neurodevelopment. Proc Natl Acad Sci U S A 2018, 115(7):1558-1563.
5. Liang Q, Wang S, Zhou X, Li Y, Xing S, Sha Y, Yang F, Huang W, Liu N, Li Z et al: Essential role of MESP1-RING1A complex in cardiac differentiation. Dev Cell 2022, 57(22):2533-2549 e2537.
6. Werner P, Latney B, Deardorff MA, Goldmuntz E: MESP1 Mutations in Patients with Congenital Heart Defects. Hum Mutat 2016, 37(3):308-314.
7. del Mar Lorente M, Marcos-Gutierrez C, Perez C, Schoorlemmer J, Ramirez A, Magin T, Vidal M: Loss- and gain-of-function mutations show a polycomb group function for Ring1A in mice. Development 2000, 127(23):5093-5100.
8. Laugesen A, Helin K: Chromatin repressive complexes in stem cells, development, and cancer. Cell Stem Cell 2014, 14(6):735-751.



