技术分享:视网膜色素变性Prpf31敲除小鼠构建及其基因替代疗法可行性验证
视网膜色素变性(retinitis pigmentosa,RP)主要是由光感受器退化造成的遗传性视网膜疾病,具有高度遗传异质性。PRPF31杂合突变导致的视网膜色素变性(PRPF31-RP)呈不完全外显的常染色体显性遗传。PRPF31是一个高度保守的基因,编码一种普遍存在的剪接因子, 在mRNA剪接过程中发挥着重要作用[1, 2]。Prpf31纯合敲除(KO)小鼠表现为胚胎致死[3]。当PRPF31杂合突变携带者的野生型(WT)等位基因产生足够的PRPF31用于正常视网膜功能,则表现为无症状。因此,PRPF31-RP具有不完全外显性,是一种单倍剂量不足的现象[4]。已报道的PRPF31突变包括移码、剪接位点、错义和无义突变,以及重复和大片段插入或缺失,其中大多数是功能丧失性突变[5, 6]。基因治疗有望治疗PRPF31-RP,但迄今为止还没有合适的动物模型用于开发AAV介导的PRPF31基因替代疗法。
2022年12月,Nature Communications上报道了一种Prpf31敲除造成视网膜色素变性的模型小鼠,研究者测试了三种AAV注射方式进行RP疾病造模,其中视网膜下注射AAV的造模小鼠病理学特征与PRPF31-RP最为相似。进一步地,研究者利用该小鼠模型,回补PRPF31的表达有效改善了RP疾病表型,首次概念性证明了AAV介导的PRPF31基因替代治疗RP的可行性[7]。
化脓性链球菌Cas9(SpCas9)和金黄色葡萄球菌Cas9(SaCas9)已被广泛用于在体基因组编辑[8]。SaCas9相比SpCas9更小,可以被单个AAV递送。为了构建PRPF31-RP疾病小鼠模型,研究者针对两个系统分别筛选靶向Prpf31基因组编码外显子的最优gRNA,用于测试三种AAV递送方式的Prpf31 KO疾病造模情况。
第一种采用视网膜下注射造模,注射部位位于颞侧视网膜,形成覆盖约一半视网膜的水泡。研究者将AAV 7m8-CMV-SaCas9-U6-gRNAg/h注射到4-5周龄WT小鼠的视网膜下腔,对照眼中注射PBS或者携带非靶向(Nt)gRNA的AAV 7m8-CMV-SaCas9-Nt gRNA(图一a)。AAV注射后5周,解剖KO眼视网膜的注射区域提取基因组DNA 进行深度测序,Prpf31突变效率为57.29±23.24%(图一b),大多表现为gRNAg和gRNAh切割位点之间约184 bp缺失(图一c)。眼底图像显示,AAV注射后5周,KO眼的颞侧视网膜出现苍白色斑块(图一d,白色箭头),与注射泡的位置重叠;而对照眼中未观察到该现象,表明不是注射操作造成的。视网膜苍白区域在10周时进一步扩大,形成点状黑色色素沉着,类似于PRPF31-RP患者的特征性色素沉着(图一d,黑色箭头)。此外在注射区域发现了视网膜血管衰减(图一d,红色箭头),这是RP的另一个眼底标志。光学相干断层扫描(OCT)成像显示,AAV注射后5周,KO眼颞侧视网膜明显变薄,内节段/外节段(IS/OS)丢失,外核层(ONL)厚度减少,OS和视网膜色素上皮(RPE)层之间的边界不清,并观察到RPE向内侧视网膜迁移;注射后10周,KO眼颞侧视网膜明显更薄,IS、OS和ONL完全丧失,无法识别RPE层(图一e)。远离注射部位的鼻侧视网膜在10周时也显示IS、OS和ONL的变薄消失,表明视网膜退化区域进一步扩大(图一e)。
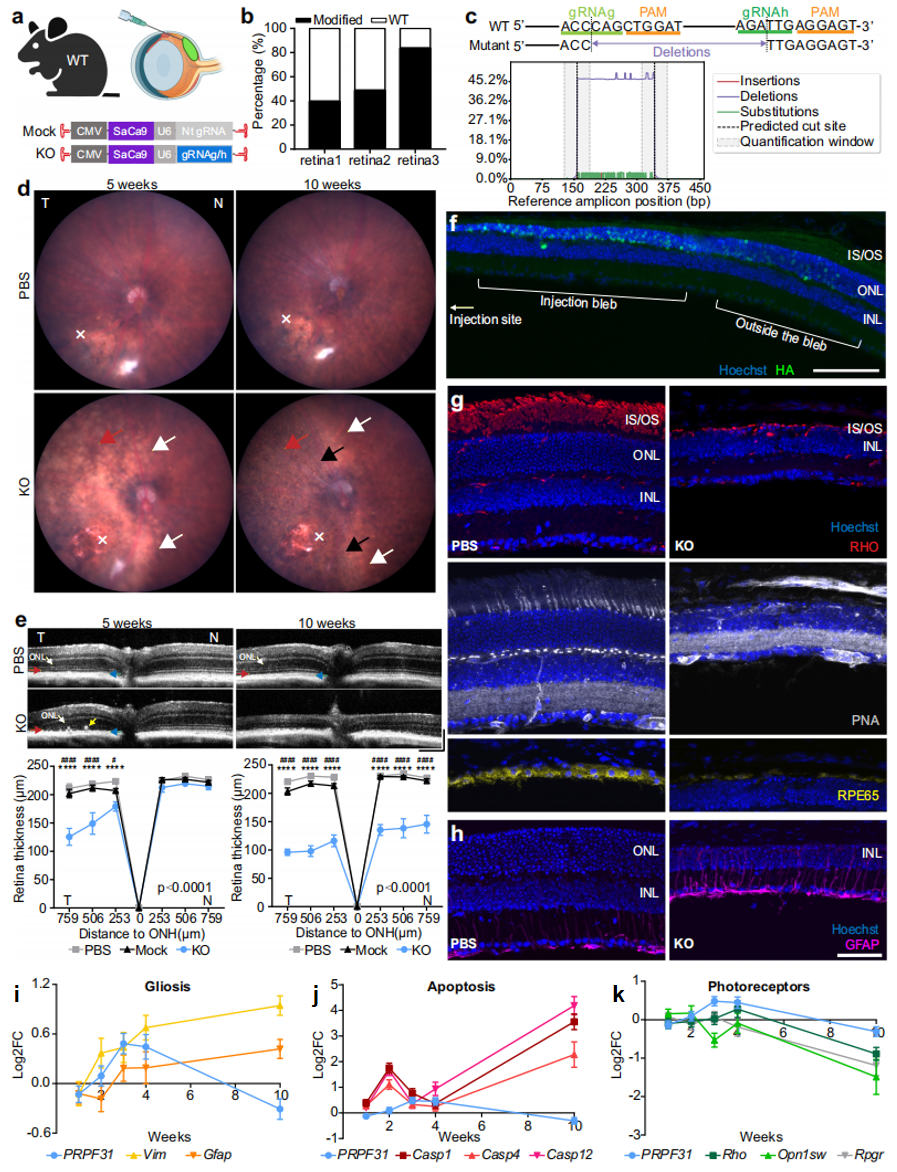
图一 视网膜下注射Prpf31-KO AAV导致外侧视网膜结构发生严重变化[7]
为进一步确定Prpf31 KO造成的眼部组织结构变化,研究者使用HA抗体检测HA标记的Cas9,结果显示Cas9在KO眼注射泡位置的外侧视网膜表达最强,并向注射泡边缘降低(图一f)。由于Prpf31 KO细胞的死亡,在注射部位的中心观察到HA标记的Cas9减少以及ONL变薄(图一f)。视紫红质(RHO)、花生凝集素(PNA)和RPE65的表达在KO眼显著减少,表明视杆细胞、视锥细胞和RPE的丢失,与OCT成像观察结果一致(图一g)。Müller细胞活化标志物GFAP在KO眼视网膜中增加,表明胶质细胞增生,出现视网膜退化现象(图一h)。mRNA定量结果显示,与PBS注射的对照眼相比,KO眼中Prpf31的表达在最初3周内增加,随后在4-10周显著减少(图一i–k);Müller细胞活化标志基因Vim和Gfap在10周内稳步增加(图一i);凋亡标志基因Casp1、Casp4和Casp12起初增加,随着Prpf31表达的短暂增加而短暂减少,随后在第4-10周显著增加(图一j);光感受器标志基因Rho、Opn1sw和Rpgr的表达在1-3周时略有下降,然后随着Prpf31表达的下降,从4-10周急剧下降(图一k)。此外,视网膜电图(ERG)评估视网膜功能表明KO眼的光感受器和RPE功能显著丧失。以上数据表明,Prpf31 KO载体的视网膜下递送造成外侧视网膜的实质性结构和功能损伤,导致光感受器和RPE退化,这与PRPF31-RP患者的典型临床特征一致。
第二种采用玻璃体内注射造模,研究者将AAV 7m8-U6-gRNA2-CAG-GFP经玻璃体内递送至4-5周龄表达SpCas9的小鼠,对照眼中注射AAV 7m8-CAG-GFP(图二a)。视网膜基因组DNA深度测序显示AAV注射后5周Prpf31的突变效率为3.73±0.19%(图二b),大多表现在gRNA2切割位点处添加了单个腺苷(图二c)。眼底图像显示,AAV注射后15周KO眼的血管旁观察到视网膜出现苍白色斑块,与GFP表达区域重叠(图二d),证实在gRNA表达区域出现视网膜病变。OCT成像显示KO眼的内丛状层(IPL)和内核层(INL)明显变薄(图二e)。与对照眼相比,KO眼表现出双极细胞标记物PKCα以及神经节细胞/无长突细胞标记物PAX6的表达降低(图二f)。ERG评估显示AAV注射15周后KO眼的b波振幅显著降低,而a波适度降低(图二g和h),表明KO眼在双极细胞中的功能障碍比在光感受器中的更严重。以上数据表明,Prpf31 KO载体的玻璃体内递送主要导致小鼠内侧视网膜的结构和功能损害。
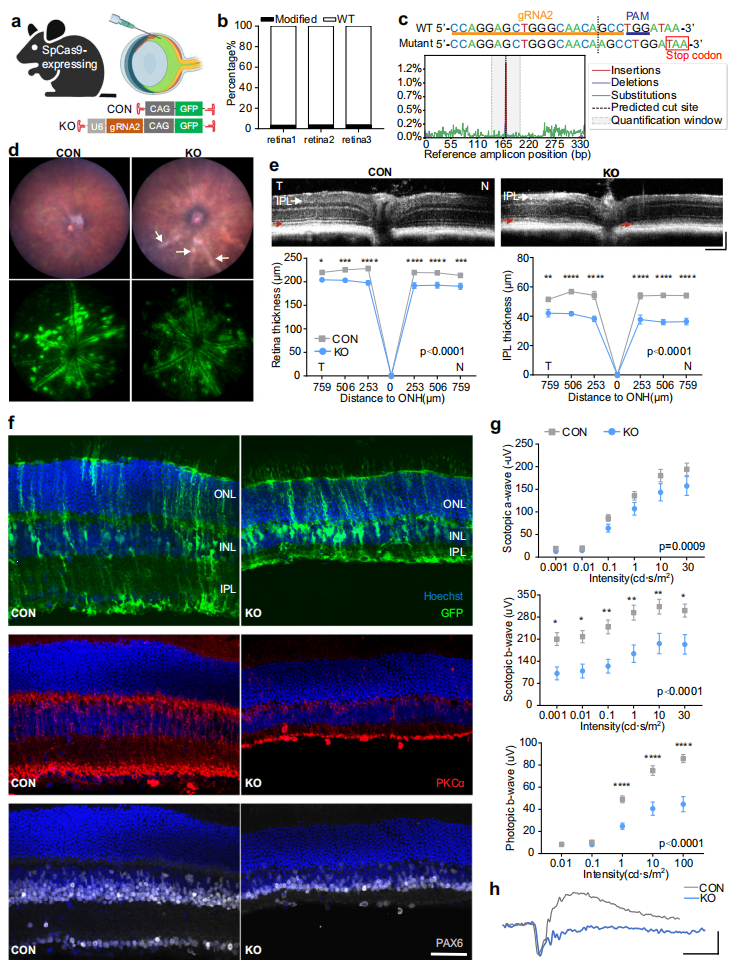
图二 玻璃体内注射Prpf31-KO AAV导致内侧视网膜结构和功能改变[7]
第三种采用面部静脉注射造模,是一种新生小鼠全身给药方式。AAV 92YF已被证明在全身给药后可在视网膜中实现有效的转基因表达[9]。将AAV 92YF-CMV-SaCas9-U6-gRNAg/h通过面部静脉注射递送至新生WT小鼠(图三a)。Prpf31的全身KO导致幼崽体重降低,4周内早期死亡率高(图三b-d)。KO小鼠身体虚弱,无法在麻醉中存活,不能进行OCT和ERG评估视网膜结构和功能。收集肝组织提取基因组DNA用于PCR扩增gRNAg/h靶位点,结果显示KO鼠的Prpf31 DNA被截短,长度与gRNAg和gRNAh之间的184 bp距离相对应(图三e)。Western blotting显示KO鼠肝脏中PRPF31蛋白表达显著降低(图三f–g)。以上数据表明Prpf31对小鼠出生后的发育和生存至关重要,全身注射Prpf31 KO载体导致发育异常和早期死亡。
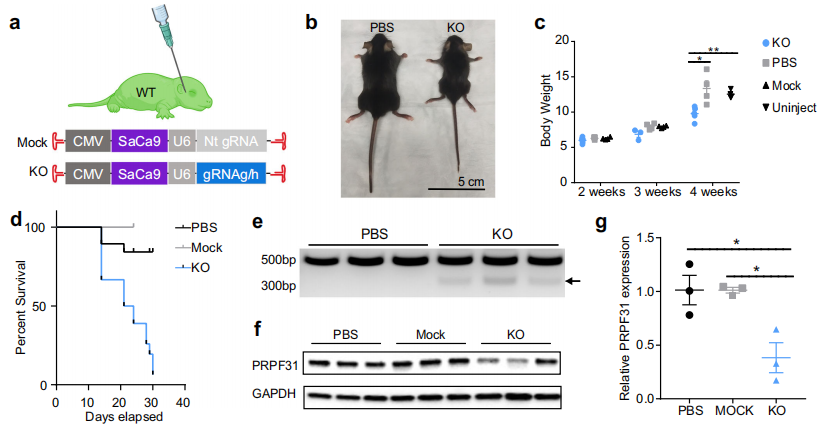
图三 全身性注射Prpf31-KO AAV导致小鼠发育异常[7]
以上三种AAV递送方式都实现了小鼠在体基因组编辑,其中视网膜下注射得到的模型小鼠病理生理学与PRPF31-RP最为相似。因此研究者运用第一种疾病模型在体内测试AAV介导人PRPF31基因替代治疗RP的可行性。向WT小鼠的眼颞侧视网膜处共注射KO AAV 7m8-CMV-SaCas9-U6gRNAg/h和基因替代AAV 7m8-CAG-hPRPF31,对照眼只注射相同剂量的KO AAV和PBS(图四a)。注射后10周qPCR确认了基因替代眼中hPRPF31的表达;深度测序显示,与KO眼相比,基因替代眼的Prpf31编辑效率更高,达到38.02±12.66%(图四b),表明由于hPRPF31的过表达,Prpf31-KO细胞仍存活在基因替代眼的视网膜中。眼底图像显示,与KO眼相比,基因替代眼的视网膜更健康,没有观察到明显的视网膜苍白斑块,色素沉着减少(图四c)。OCT扫描显示,基因替代眼的视网膜厚度保持不变,结构正常(图四d)。视网膜厚度热图显示,KO眼颞侧视网膜明显变薄,而基因替代眼的视网膜厚度有所改善,损伤仅限于注射部位(图四e)。通过SaCas9、光感受器和RPE标志基因的免疫荧光证实了基因替代眼中ONL和OS/IS的结构保留,视杆细胞、视锥细胞和RPE的存活(图四f)。对不同操作后的视网膜进行差异基因表达分析(图四g),发现与KO眼相比,基因替代眼的总PRPF31表达显著增加,细胞死亡标志基因Casp12和胶质细胞激活标志基因Vim和Gfap表达显著降低,光感受器特异性标志基因Rho,Opn1sw和Pde6c表达显著提高,表明基因替代治疗通过回补hPRPF31的表达,减少了细胞死亡和胶质增生,同时保持了光感受器细胞存活。以上数据表明,AAV介导的hPRPF31基因替代治疗改善了Prpf31敲除疾病模型小鼠的视网膜组织结构和视觉功能。
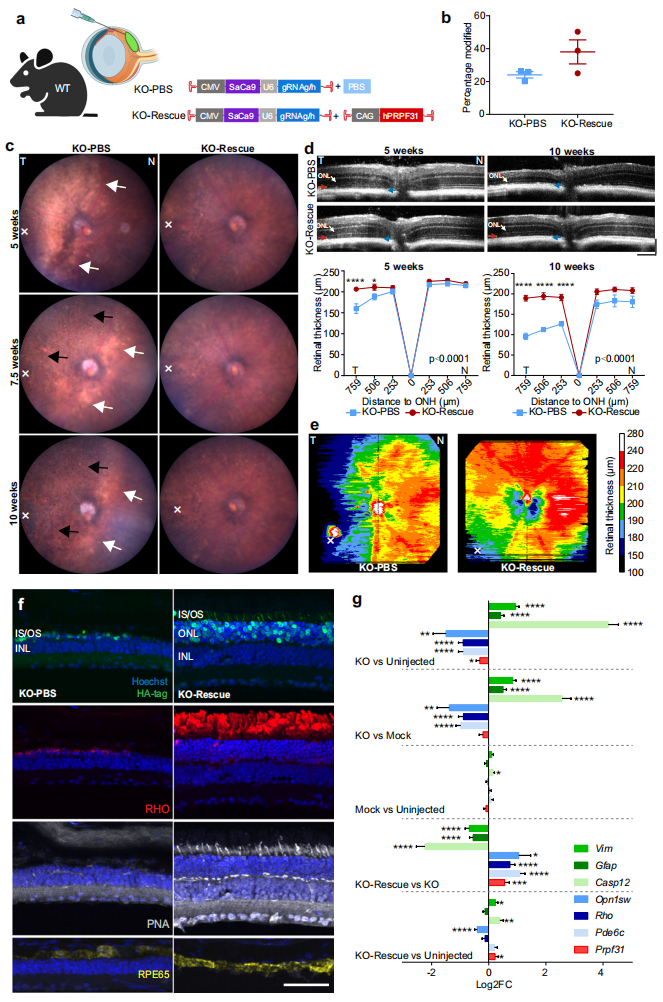
图四 基因替代治疗有效改善Prpf31敲除小鼠的视网膜结构和视觉功能[7]
综上所述,研究者使用视网膜下注射、玻璃体内注射和全身性注射三种AAV递送方式敲除Prpf31,都实现了有效性小鼠在体基因组编辑。其中第一种造模方式获得的疾病小鼠模型可较好模拟PRPF31-RP患者的疾病表型。利用视网膜下注射的疾病造模小鼠,研究者体内证明AAV介导的hPRPF31基因替代治疗RP的可行性。此外,研究者在非人灵长类和人类视网膜外植体中也相似地实现PRPF31敲除,为建立非人灵长类PRPF31-RP动物模型奠定了基础。该研究推进了对PRPF31-RP的认识,为进一步研究PRPF31致病机制以及未来在非人灵长类动物模型中开发PRPF31-RP治疗方法提供了有效的小鼠模型,并且概念验证性结果表明PRPF31基因替代治疗的可行性,具有潜在的临床应用价值。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Liu S, Li P, Dybkov O, Nottrott S, Hartmuth K, Lührmann R, Carlomagno T, Wahl MC: Binding of the human Prp31 Nop domain to a composite RNA-protein platform in U4 snRNP. Science 2007, 316(5821):115-120.
2. Makarova OV, Makarov EM, Liu S, Vornlocher HP, Lührmann R: Protein 61K, encoded by a gene (PRPF31) linked to autosomal dominant retinitis pigmentosa, is required for U4/U6*U5 tri-snRNP formation and pre-mRNA splicing. The EMBO journal 2002, 21(5):1148-1157.
3. Graziotto JJ, Farkas MH, Bujakowska K, Deramaudt BM, Zhang Q, Nandrot EF, Inglehearn CF, Bhattacharya SS, Pierce EA: Three Gene-Targeted Mouse Models of RNA Splicing Factor RP Show Late-Onset RPE and Retinal Degeneration. Invest Ophth Vis Sci 2011, 52(1):190-198.
4. Rose AM, Shah AZ, Waseem NH, Chakarova CF, Alfano G, Coussa RG, Ajlan R, Koenekoop RK, Bhattacharya SS: Expression of PRPF31 and TFPT: regulation in health and retinal disease. Human molecular genetics 2012, 21(18):4126-4137.
5. Wheway G, Douglas A, Baralle D, Guillot E: Mutation spectrum of PRPF31, genotype-phenotype correlation in retinitis pigmentosa, and opportunities for therapy. Experimental eye research 2020, 192:107950.
6. Xie D, Peng K, Yi Q, Liu W, Yang Y, Sun K, Zhu X, Lu F: Targeted Next Generation Sequencing Revealed Novel PRPF31 Mutations in Autosomal Dominant Retinitis Pigmentosa. Genetic testing and molecular biomarkers 2018, 22(7):425-432.
7. Xi Z, Vats A, Sahel JA, Chen Y, Byrne LC: Gene augmentation prevents retinal degeneration in a CRISPR/Cas9-based mouse model of PRPF31 retinitis pigmentosa. Nature communications 2022, 13(1):7695.
8. Knott GJ, Doudna JA: CRISPR-Cas guides the future of genetic engineering. Science 2018, 361(6405):866-869.
9. Dalkara D, Byrne LC, Lee T, Hoffmann NV, Schaffer DV, Flannery JG: Enhanced gene delivery to the neonatal retina through systemic administration of tyrosine-mutated AAV9. Gene therapy 2012, 19(2):176-181.



