技术分享:高蛋白饮食可预防节食后的体脂反弹
自1970年代中期以来,全球肥胖症的患病率增加了两倍,大幅增加了2型糖尿病、脂肪肝、心血管疾病及多种癌症的患病风险[1]。肥胖产生的根本原因是能量平衡失调,可影响能量稳态的环境和遗传因素都会助力肥胖的发展[2]。饮食限制(dietary restriction, DR)或称为节食,被认为是一种改善哺乳动物脂质代谢和减少脂量的重要策略[3]。常见的节食类型如限制热量摄入和间歇性断食,可通过减少脂肪,显著性降低标准以及轻度超重成年人的体重。由于大多数人难以坚持长期节食,短期节食(SDR)和间歇性断食的体重控制方式更受欢 迎。然而,健康体重的人群在节食结束后恢复正常饮食,会出现减轻的体重再次增加的现象[4]。因此,亟需探索新的干预策略来防止节食后的体重反弹。
节食这种特殊的饮食方式会造成肠道微生物群的组成变化[5]。由肠道菌群产生的大量代谢产物(如短链脂肪酸、胆汁酸、氨基酸及其衍生物)影响着宿主的代谢,包括食物摄入、消化、吸收和能量消耗[6]。关于节食后的体重反弹机制仍不清楚,而肠道菌群及其代谢物又在其中发挥着怎样的作用,还有待进一步研究。
2022年12月,Nature Metabolism上报道了一项节食后恢复正常饮食导致体脂反弹的机制研究。研究者测试了多种节食方式都在恢复正常饮食后出现小鼠体内脂肪快速累积的现象,发现该过程引起了肠道乳酸杆菌及其代谢产物的丰度增加,促使肠道脂质吸收增强,最终导致脂肪量增加。而节食后的高蛋白饮食可以抑制肠道乳酸杆菌的生长,进而减少肠道脂质吸收,预防节食后的体脂反弹[7]。
首先,研究者设计了十种不同节食方式来研究节食后恢复饮食对小鼠脂肪量的影响。短期节食(SDR)周期的设计包括3天内梯度或均等限制喂食正常1天的食物量,以及6天内均等喂食正常4天的食物量,小鼠在节食周期后恢复自由饮食(图一a)。结果显示,3天分别喂食10%、25%和65%食物的SDR(10-25-65%)实验组在节食期间脂肪量迅速下降,并在自由饮食后出现快速的脂肪累积(图一b),伴随着腹股沟白色脂肪组织(iWAT)体积和重量的增加(图一f和g),以及iWAT脂肪细胞体积的增加(图一h)。此外,其他不同的节食方式实验组也出现了类似的节食期体脂量下降,恢复自由饮食后体脂量快速增加的现象,最高可达原体脂量的两倍左右(图一c–e和i-n)。
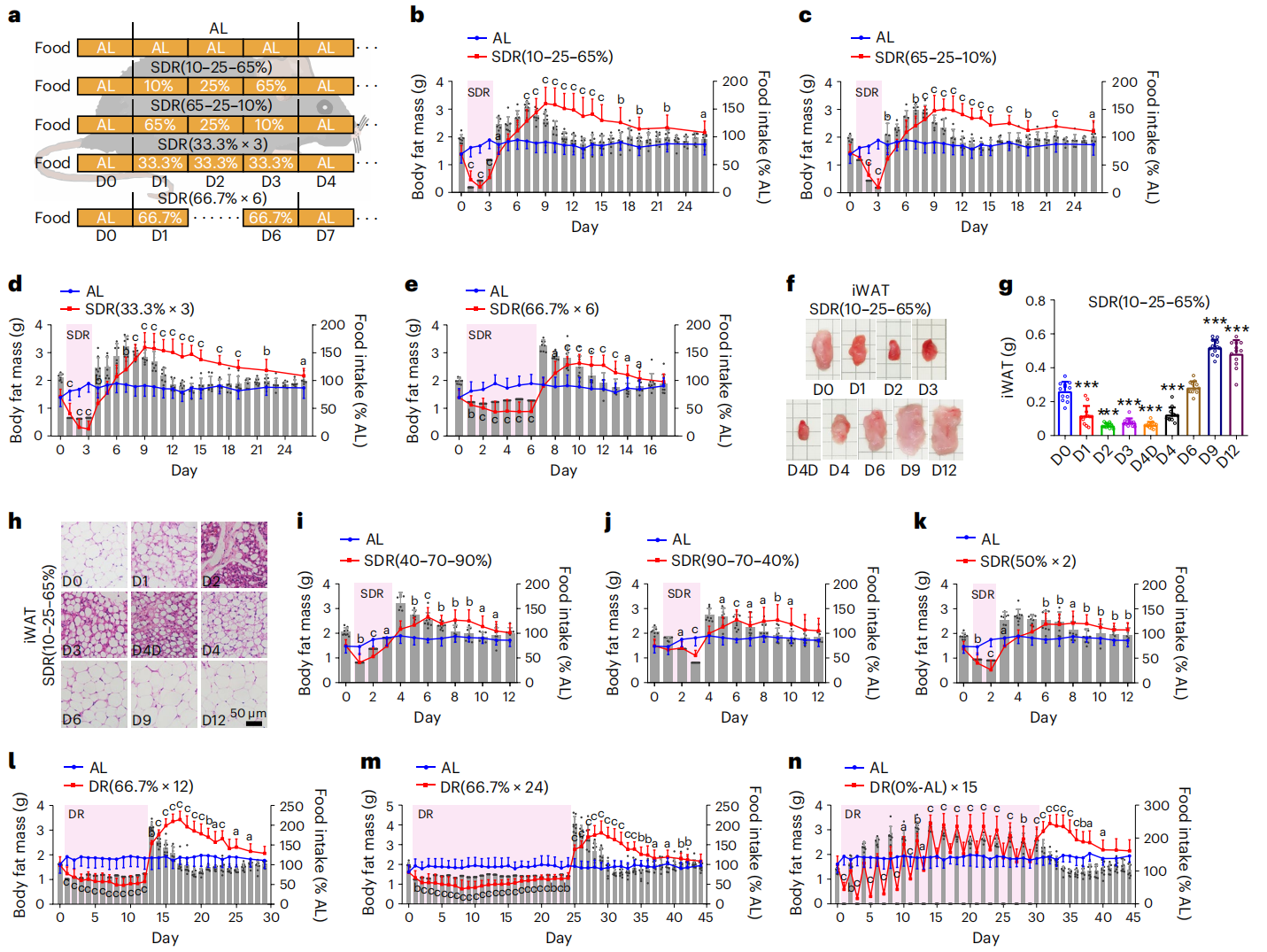
图一 节食后恢复饮食会导致快速脂肪累积[7]
研究者进一步分析节食后体脂反弹的原因。其一分析能量消耗,发现短期节食(SDR)后的能量消耗(EE)没有显著变化(图二a和b),表明节食后的快速脂肪累积并不是由于能量消耗的减少。其二分析食物摄入,发现节食后恢复饮食显著增加了食欲基因Agrp和Npy的mRNA水平,并降低了厌食基因Pomc和Cart的mRNA水平(图二c)。尽管节食后恢复饮食的前几天食物摄入量显著增加,但SDR组累积食物摄入量与自由饮食对照组小鼠相似甚至更低(图二d)。并且节食后喂食正常食物量(100%),仍会导致快速脂肪累积(图二e-f),其累积食物摄入量也显著低于对照组小鼠(图二g),表明食物摄入量的增加并不是节食后快速脂肪累积的主要原因。其三分析肠道脂质吸收,发现节食后的粪便甘油三酯(TG)显著降低(图二h),小肠TG显著增加(图二i和j),肠道脂质吸收增强(图二k)。通过喂食BODIPY标记脂肪酸的橄榄油监测肠道脂质吸收,发现节食后小鼠粪便BODIPY水平显著降低(图二l),近端空肠绒毛的荧光强度显著增加(图二m),肠道和血清BODIPY水平也显著增加(图二n和o)。以上数据表明,肠道脂质吸收能力的增强是造成节食后快速脂肪累积的主要原因。
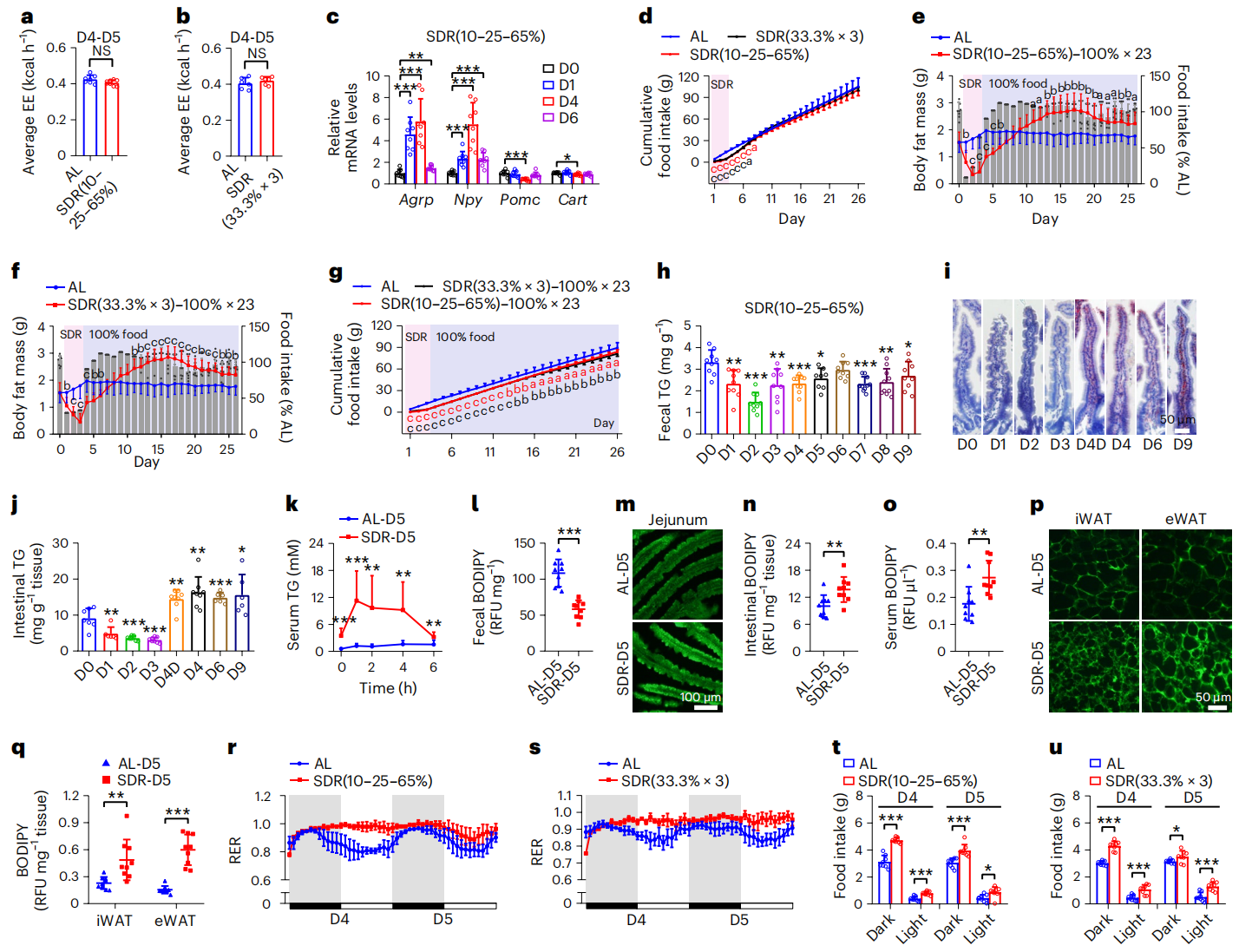
图二 节食后小鼠肠道脂质吸收增强以及WAT脂肪酸摄取和脂质合成增加[7]
为了研究肠道脂质吸收的增加是如何导致节食后快速脂肪累积,研究者分析了WAT中的脂肪酸摄取和脂质合成。给小鼠灌胃BODIPY标记的脂肪酸,发现节食后iWAT和eWAT的荧光强度和BODIPY水平显著增加(图二p和q)。还观察到节食后小鼠呼吸交换率的增加(图二r和s),表明节食后小鼠的脂质氧化总量减少[8]。节食后小鼠夜晚和白天的食物摄入量都显著增加(图二t和u)。以上数据表明,WAT脂肪酸摄取和脂质合成的增加以及脂质氧化总量的减少导致了节食后脂肪量的快速累积。
接下来,研究者探索防止节食后脂肪量增加的潜在饮食干预措施。通过非靶向代谢组学检测节食之前、期间和之后的血清代谢物,发现差异代谢物主要富集在蛋白质消化吸收、氨基酸代谢、氨基酸生物合成相关途径(图三a-b)。经液相色谱−串联质谱(LC-MS/MS)定量血清氨基酸,发现必需氨基酸(EAA)水平在节食期间和之后显著增加(图三c)。为了观测氨基酸的影响,研究者在10-25-65%节食3天后分别用高蛋白(HP)、低蛋白(LP)或补充EAA的正常蛋白(NP)喂食小鼠(图三d),发现三种饮食都能减弱节食后的脂肪累积,特别是高蛋白饮食甚至部分维持了节食引起的脂肪减少(图三e)。iWAT体积和重量以及脂肪细胞体积的减少都证实了高蛋白饮食减少了脂肪累积(图三f-h)。其他三种不同节食方式后的高蛋白饮食也都可以防止节食后的体脂反弹(图三i-k)。以上数据表明,节食后出现的脂肪量增加可以通过饮食干预来预防,特别是高蛋白饮食。
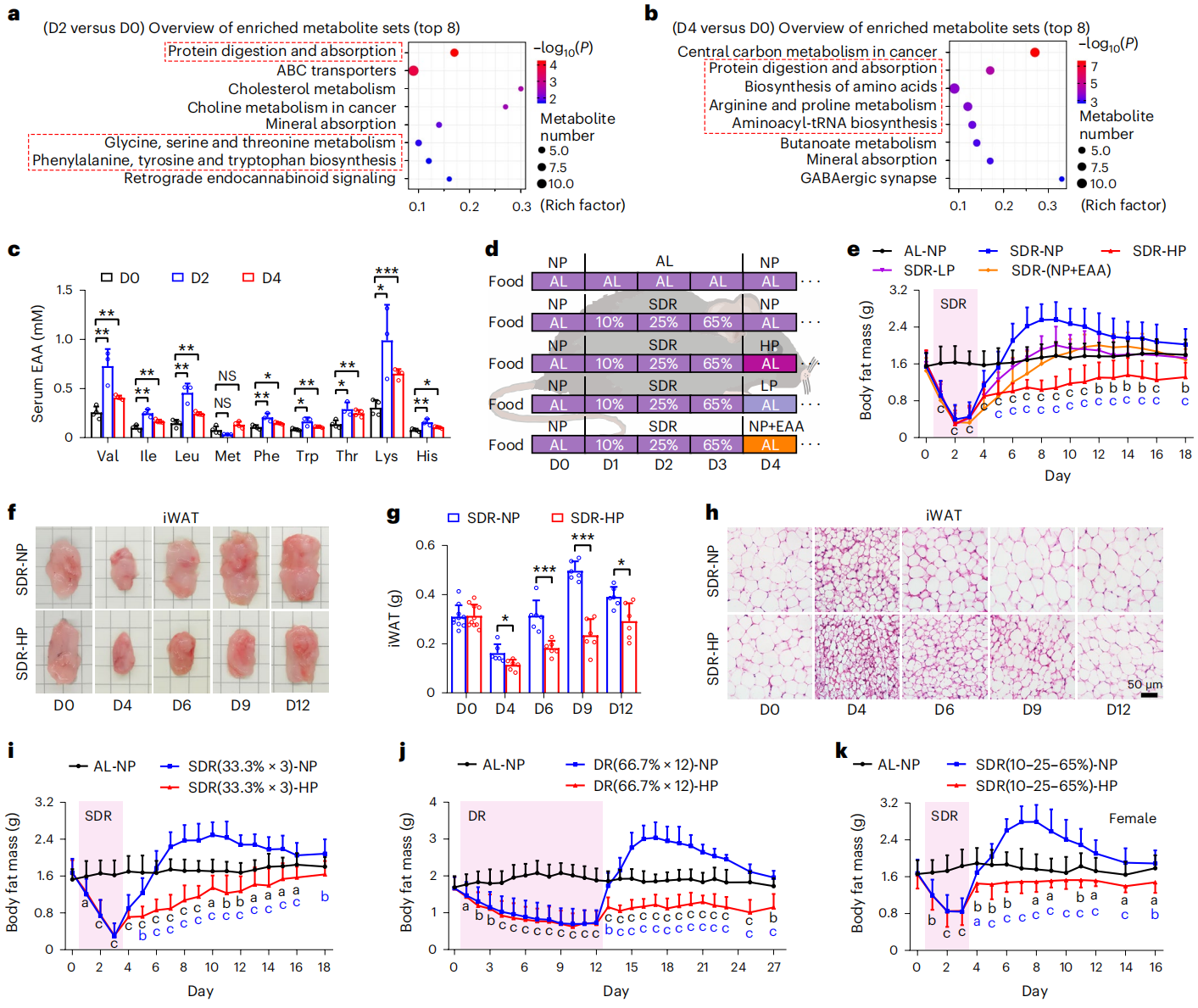
图三 高蛋白饮食可预防节食后脂肪量的增加[7]
饮食是决定肠道微生物群结构的关键因素,而肠道菌群可以影响肠道的脂质吸收与代谢[9]。于是,研究者进一步分析肠道菌群在其中的作用,收集10-25-65% SDR小鼠盲肠粪便,进行16S rRNA基因测序分析菌群组成及多样性。主坐标分析(PCoA)结果显示,正常饮食、节食后正常饮食(SDR-NP)和节食后高蛋白饮食(SDR-HP)三组之间的肠道菌群存在明显的聚类差异(图四a)。细菌α多样性在SDR-NP组第4天降低,但在SDR-HP组第4天恢复正常水平(图四b)。分析细菌类群分布,发现SDR-NP组第4天芽孢杆菌纲、乳酸杆菌科和乳酸杆菌属的数量急剧增加,幅度高达约50%,而在SDR-HP组的相对丰度显著降低(图四c-e)。线性判别分析和Songbird分析均显示SDR-NP组的乳酸杆菌最为丰富(图四f和g)。研究者从10-25-65%节食第4天的小鼠盲肠粪便中分离并测序了8个菌落,在进化树上与鼠乳杆菌(NR_112689)最为接近,并随机挑选其中一个菌落,将其命名为Lam-1(图四h)。经qPCR定量证实,SDR-NP组显著增加了Lam-1的丰度,而这种增加在高蛋白饮食时被显著抑制(图四i和j)。期间所有小鼠盲肠粪便的总细菌量相似(图四k)。以上数据表明,节食后恢复饮食显著改变了肠道菌群的组成,造成了乳酸杆菌的显著富集。
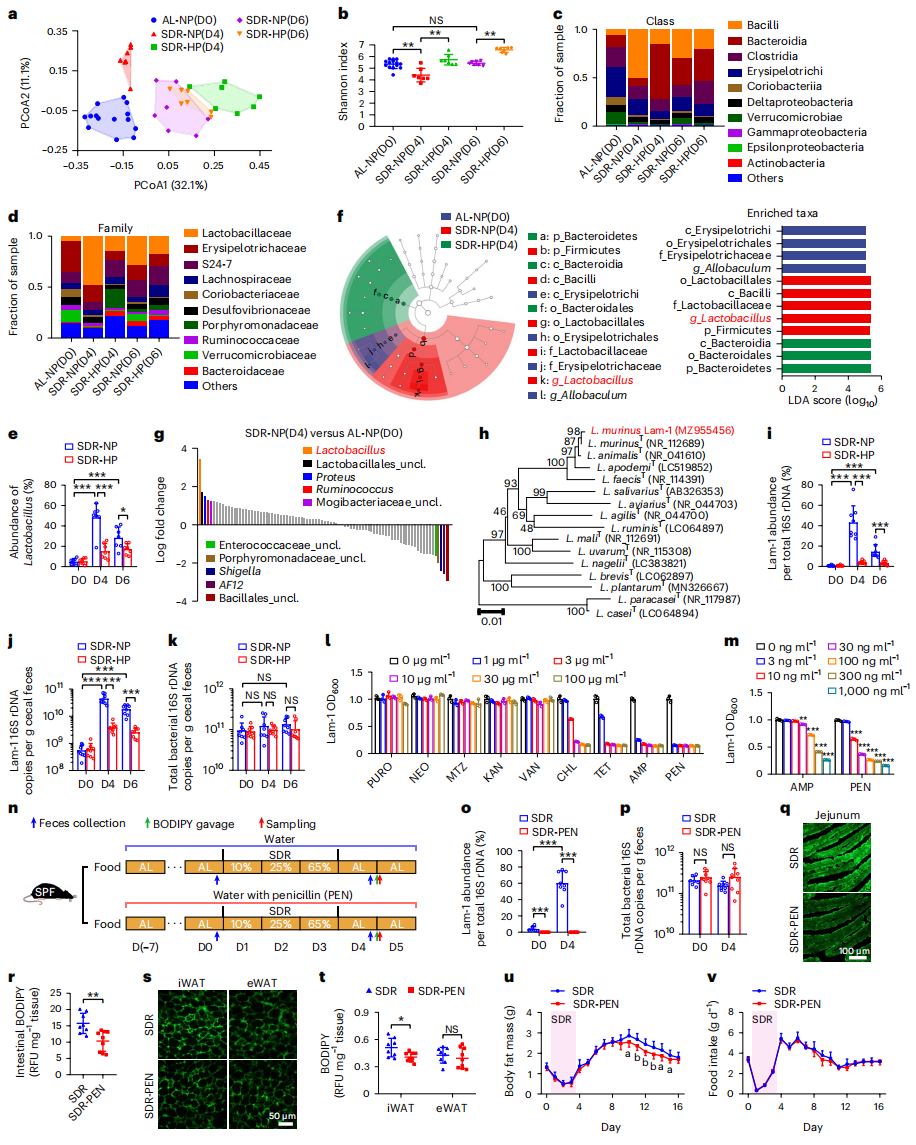
图四 节食后恢复饮食可改变肠道菌群结构,增强肠道脂质吸收[7]
已知抗生素引起的微生物群耗竭会改变代谢平衡,包括GLP-1的增加和管腔胆汁酸的减少,表明肠道对脂质的吸收减少[10]。研究者发现Lam-1对青霉素敏感,低至10 ng/ml(图四l和m)。提前1周给药青霉素(图四n),发现青霉素可以显著抑制节食后Lam-1的生长,但细菌总量不受影响(图四o和p);小鼠肠道脂肪酸吸收和WAT脂肪酸摄取显著降低(图四q-t);并在不改变食物摄入量的情况下抑制脂肪量增加(图四u和v)。以上数据表明,节食后恢复饮食可通过改变肠道菌群来增强肠道脂质吸收和WAT脂肪酸摄取,导致脂肪累积。
最后,研究者进一步研究肠道菌群Lam-1是如何调节肠道脂质吸收和WAT脂肪酸摄取。与对照组相比,SDR-NP组盲肠粪便的代谢组发生显著变化,前5种显著增加的代谢产物是DL-3-苯基乳酸(PLA)、4-羟基苯基乳酸(HPLA)、2-羟基异己酸(HICA)、2-羟基-3-甲基丁酸(HMBA)和吲哚乳酸(ILA),而SDR-HP组可以阻断这5种代谢产物的变化(图五a)。LC–MS/MS定量分析证实了这5种代谢物的丰度变化(图五b–f)。相关性分析表明,乳酸杆菌与这5种代谢物的表达水平密切相关(图五g和h)。此外,给小鼠灌胃Lam-1也能显著提高盲肠粪便中这5种代谢产物的水平(图五i)。体外培养发现Lam-1产生的这5种代谢产物量均显著高于大肠杆菌,PLA、HPLC和ILA显著高于乳酸杆菌LC2W(图五j和k)。给小鼠灌胃这5种代谢产物的混合物,发现小鼠的粪便BODIPY水平显著降低(图五l);近端空肠绒毛的荧光强度和肠道BODIPY水平显著增加(图五m和n);WAT中BODIPY水平显著增加(图五o和p)。此外,每日灌胃这5种代谢混合物也会造成小鼠体内大量脂肪累积,但不改变食物摄入量(图五q和r)。以上数据表明,肠道菌群如乳酸杆菌Lam-1产生的代谢产物,可以增强肠道脂质吸收和WAT脂肪酸摄取,最终导致脂肪累积。
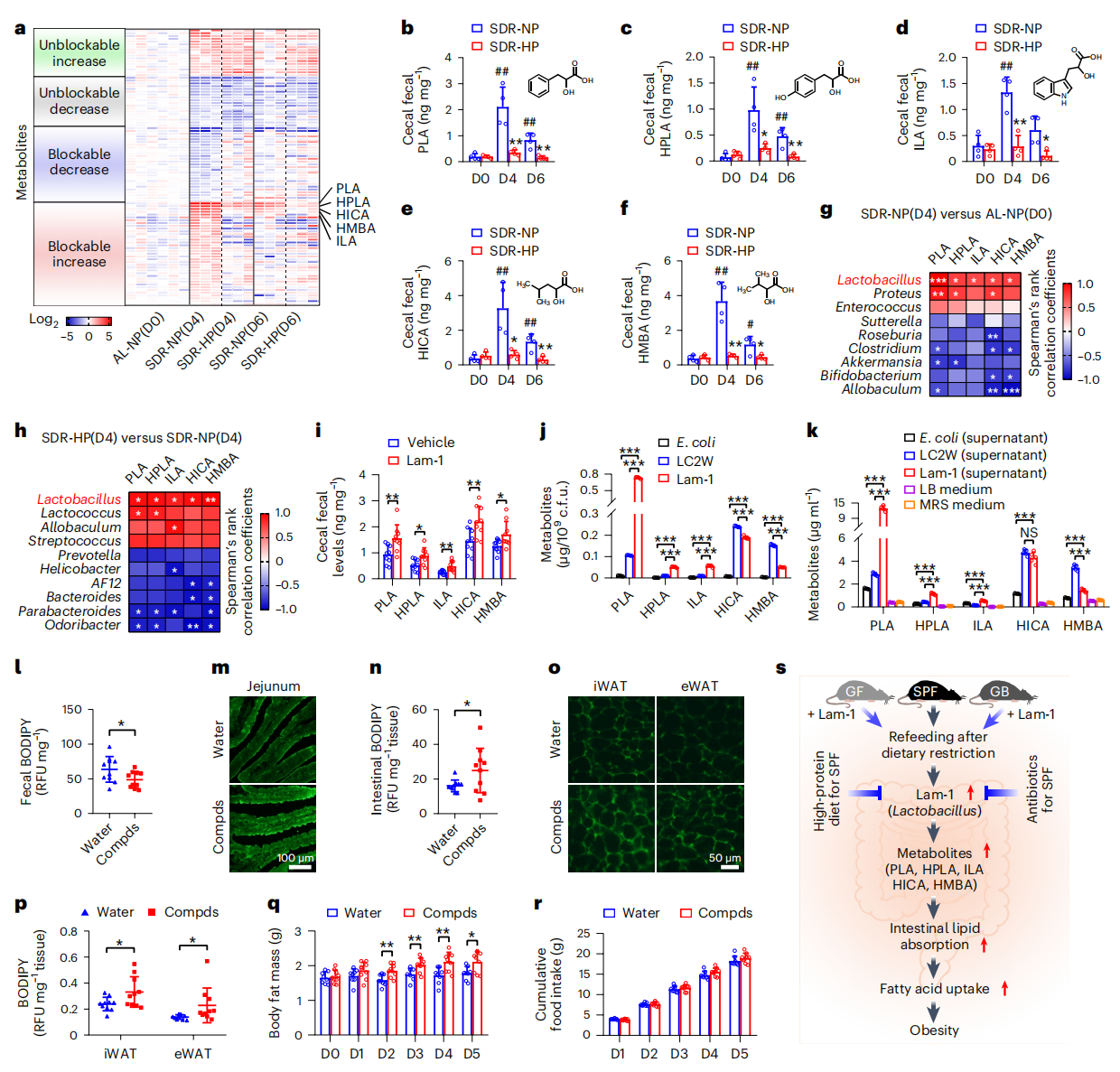
图五 乳酸杆菌代谢产物可增强肠道脂质吸收造成脂肪量累积[7]
综上所述,研究者系统性证明了节食后恢复饮食会出现脂肪量快速累积的现象,是通过促进肠道乳酸杆菌及其代谢产物的丰度,增强肠道脂质吸收和WAT脂肪酸摄取,最终导致脂肪量的增加。而节食后高蛋白饮食或者用抗生素靶向肠道乳酸杆菌可以阻断这一过程,从而抑制脂肪累积,抵抗节食后的体脂反弹(图五s)。该研究揭示了节食后体脂反弹的潜在机制,并提供了一种有效预防节食后再肥胖的替代策略,具有广泛的应用价值。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Kumanyika S, Dietz WH. Solving Population-wide Obesity - Progress and Future Prospects. N Engl J Med 2020, 383(23):2197-2200.
2. Heymsfield SB, Wadden TA. Mechanisms, Pathophysiology, and Management of Obesity. N Engl J Med 2017, 376(15):1492.
3. Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (Albany NY) 2016, 8(12):3341-3355.
4. Montani JP, Schutz Y, Dulloo AG. Dieting and weight cycling as risk factors for cardiometabolic diseases: who is really at risk? Obesity reviews : an official journal of the International Association for the Study of Obesity 2015, 16 Suppl 1:7-18.
5. von Schwartzenberg RJ, Bisanz JE, Lyalina S, Spanogiannopoulos P, Ang QY, Cai J, Dickmann S, Friedrich M, Liu SY, Collins SL et al. Caloric restriction disrupts the microbiota and colonization resistance. Nature 2021, 595(7866):272-277.
6. Krautkramer KA, Fan J, Bäckhed F. Gut microbial metabolites as multi-kingdom intermediates. Nature reviews Microbiology 2021, 19(2):77-94.
7. Zhong W, Wang H, Yang Y, Zhang Y, Lai H, Cheng Y, Yu H, Feng N, Huang R, Liu S et al. High-protein diet prevents fat mass increase after dieting by counteracting Lactobacillus-enhanced lipid absorption. Nat Metab 2022, 4(12):1713-1731.
8. Bray MS, Ratcliffe WF, Grenett MH, Brewer RA, Gamble KL, Young ME. Quantitative analysis of light-phase restricted feeding reveals metabolic dyssynchrony in mice. International journal of obesity (2005) 2013, 37(6):843-852.
9. Li G, Xie C, Lu S, Nichols RG, Tian Y, Li L, Patel D, Ma Y, Brocker CN, Yan T et al. Intermittent Fasting Promotes White Adipose Browning and Decreases Obesity by Shaping the Gut Microbiota. Cell Metab 2017, 26(5):801.
10. Zarrinpar A, Chaix A, Xu ZZ, Chang MW, Marotz CA, Saghatelian A, Knight R, Panda S. Antibiotic-induced microbiome depletion alters metabolic homeostasis by affecting gut signaling and colonic metabolism. Nature communications 2018, 9(1):2872.



