技术分享:RNA结合蛋白RBM46调控减数分裂起始过程
减数分裂是有性生殖生物体中一种独特的细胞分裂过程。配子的形成需要从有丝分裂转变到减数分裂。减数分裂起始因子STRA8在视黄酸的诱导下调节启动减数分裂[1],但仅有STRA8及其伴侣蛋白时并不足以启动,表明减数分裂过程受到多层调控。N6-甲基腺苷(m6A)是最丰富的mRNA内部修饰,已成为调控基因表达的一种重要的转录后调控机制[2, 3]。包含有YTH结构域的reader可特异性识别结合m6A修饰RNA。YTHDC2作为YTH家族成员,在雄性生殖细胞中大量表达。重组人YTHDC2蛋白具有3'→5' RNA解旋酶活性,可以解开具有3' 突出的RNA双链,解旋酶活性的缺失会造成减数第一次分裂(减I)前期进程阻滞导致不育[4]。在小鼠睾丸中,YTHDC2与5'→3'核糖核酸外切酶XRN1和减数分裂特异性蛋白MEIOC直接结合[5, 6]。生化分析表明与XRN1结合后,YTHDC2的解旋酶活性增强[7]。Ythdc2和Meioc缺陷小鼠具有相似表型,生殖细胞进入减数分裂后阻滞在减I前期的较早阶段,过早发生类似中期的染色质凝集浓缩而凋亡[6]。YTHDC2和MEIOC作为减数分裂启动的重要转录后调控因子,共同作用调节有丝分裂到减数分裂的转变。但目前尚不清楚YTHDC2/MEIOC是如何特异性选择其作用的RNA底物。2022年8月,Science Advances上报道了由RBM46/YTHDC2/MEIOC复合物形成的转录后调控机制。在小鼠睾丸特异性敲除Rbm46可导致小鼠不育,并伴有有丝分裂到减数分裂的转变缺陷。RBM46作为YTHDC2/MEIOC复合物的组成部分,结合在YTHDC2富含U的motif序列邻近100个核苷酸内,共同靶向有丝分裂相关转录本的3′ UTR并介导其降解,进而在精子形成减数分裂的起始阶段沉默有丝分裂相关转录,保障从有丝分裂转变到减数分裂的顺利进行[8]。
为了寻找YTHDC2/MEIOC调控网络中的其他重要因子,研究者在出生后12天(P12)的小鼠睾丸中进行YTHDC2免疫沉淀(IP),并进行质谱分析(MS)。IP结果显示160 kDa的YTHDC2蛋白(图一A),并且在MS结果中检测到与其结合的MEIOC。此外发现一种推定的RNA结合蛋白RBM46,也存在于YTHDC2复合物中(图一B)。Western blot分析P21小鼠睾丸的IP复合物,证明了内源性YTHDC2与MEIOC、RBM46三者之间存在相互作用(图一C),并且用核糖核酸酶(RNase)处理免疫沉淀物后,仍不影响三者的相互作用,表明它们之间的相互作用不依赖于RNA的存在(图一C)。在HEK293T细胞中过表达Rbm46-GFP和HA-Meioc或者FLAG-Ythdc2,IP结果显示外源性表达的RBM46可分别与MEIOC和YTHDC2蛋白相结合(图一D)。三种截短体的IP实验表明RBM46的RNA识别基序(RRM1/2/3)和双链RNA结合域(DSRM)的缺失消除了与YTHDC2的相互作用,但不受其N端(氨基酸1-62)或氨基酸303-391缺失的影响(图一E)。研究者进一步在大肠杆菌中表达纯化GST-RBM46蛋白和全长His-YTHDC2,体外蛋白质结合实验显示两者并不直接结合(图一F)。以上数据表明,小鼠睾丸中RBM46以RNA非依赖性方式与MEIOC和YTHDC2相互作用,但RBM46和YTHDC2之间的相互作用是间接的。
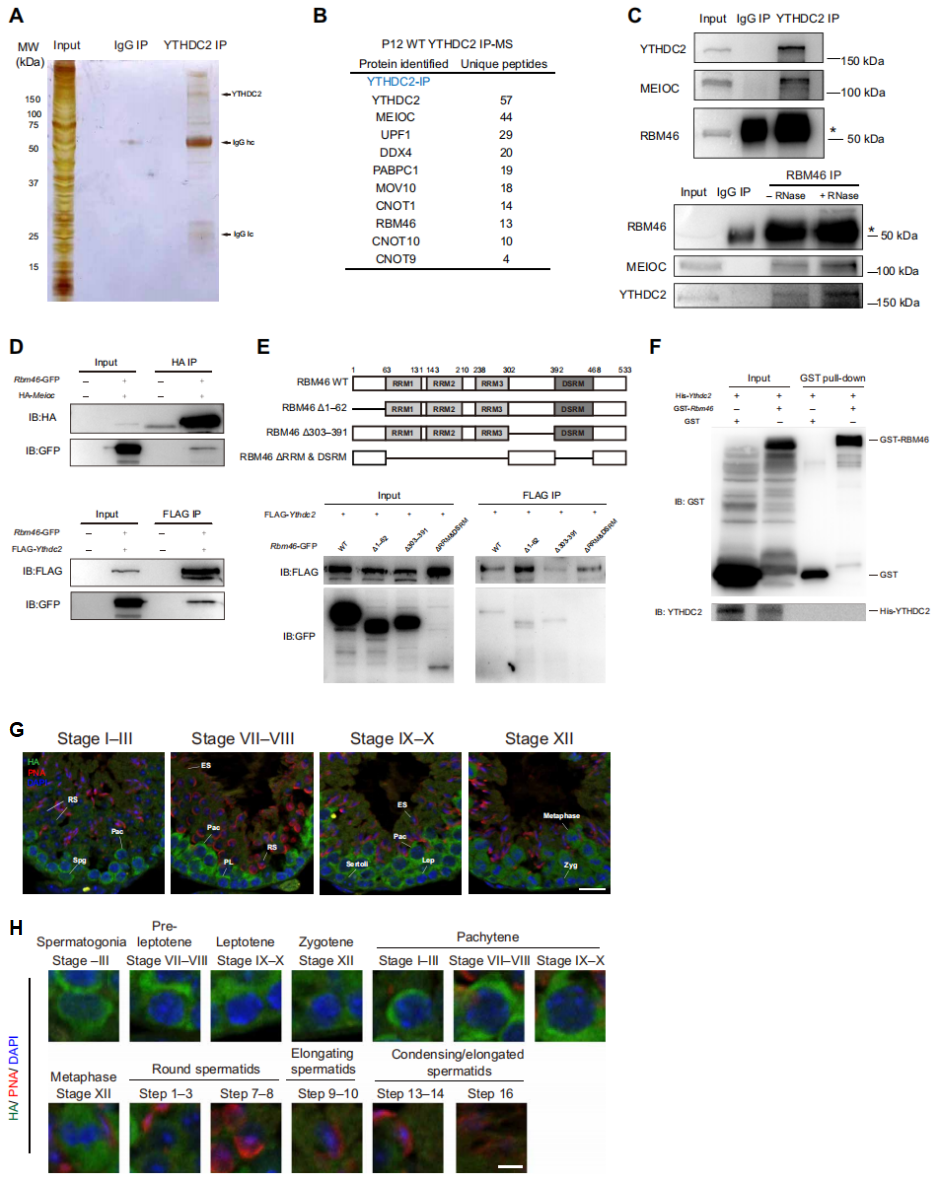
图一 小鼠睾丸中RBM46与YTHDC2和MEIOC相结合[8]
为了确定RBM46特异性表达的细胞类型,研究者在Rbm46基因组的N端原位敲入HA标签序列,利用半克隆技术构建了Rbm46-HA敲入小鼠。采用HA和顶体标记物PNA抗体对小鼠睾丸进行免疫染色,发现RBM46主要定位于睾丸精母细胞的细胞质(图一G),在减I的细线期到粗线期精母细胞都高表达,以及在中期I和次级精母细胞(图一H)。RBM46表达在减数分裂后期的精子细胞中开始减少,从第4步开始在球形精子和延长形精子细胞中表达消失(图一H)。以上数据表明,RBM46在减数分裂开始时上调表达,且在减I前期维持高表达水平。
接下来,为了解Rbm46在精子形成中的生理功能,研究者构建了Rbm46fl条件性敲除小鼠,并与Neurog-Cre小鼠交配获得睾丸特异性Rbm46敲除小鼠(Neurog-cre Rbm46 KO)。该KO小鼠能正常生长到成年,但睾丸高度萎缩(图二A);与同窝对照组相比,7-8周龄的小鼠体重没有显著差异,但睾丸重量轻72%(图二B和C);当与野生型(WT)雌性交配时,该KO雄鼠不能生育(图二D),表明Rbm46是精子形成所必需的。睾丸组织学分析显示,该KO小鼠P60成年时精子形成严重受损,减数分裂后期生殖细胞完全缺失,减I前期精母细胞也显著减少(图二E);大多数曲细精管停滞在类前细线期(图二F);SYCP3的阳性染色仅在较少的细胞中检测到(图二G)。
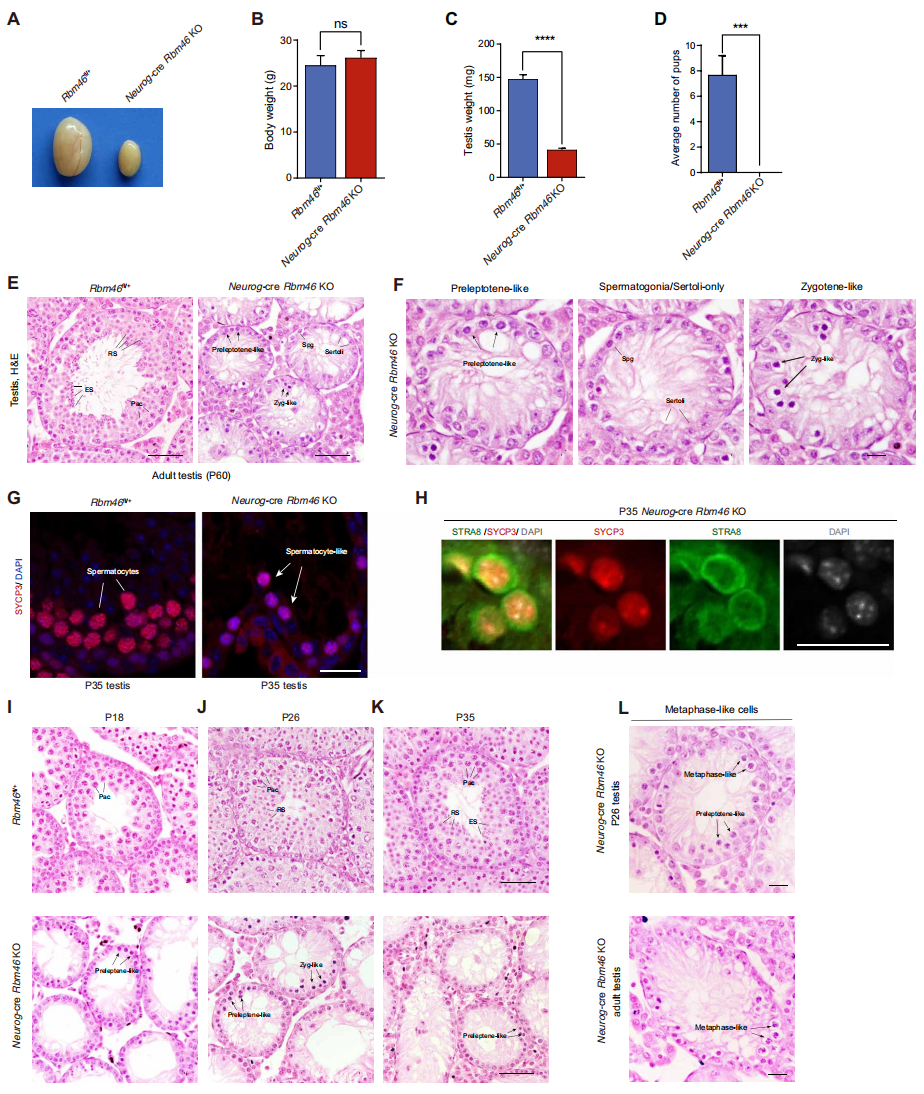
图二 睾丸特异性Rbm46敲除导致减数分裂停滞及小鼠不育[8]
进一步研究减数分裂发生缺陷的时间,研究者收集了幼年WT和Neurog-cre Rbm46 KO小鼠睾丸进行组织学分析。与WT小鼠相比,该KO雄鼠P18睾丸的大多数生殖细胞停滞在类前细线期(图二I);P26和P35时,曲细精管中完全没有减数分裂后期精子细胞和晚期精母细胞,主要停滞在类偶线期(图二J和K)。此外,虽然大量P35的类前细线期细胞表达STRA8,但显示出SYCP3信号的密集聚集,以及含有斑片状DNA凝集(图二H),表明这些细胞处于染色质凝集状态;且在P26和P60 观测到异常的中期样细胞(图二L)。以上数据表明,Neurog-cre Rbm46 KO小鼠的生殖细胞虽然进入减数分裂,但主要停滞在类前细线期阶段,这些细胞经历了过早的染色质凝集,导致一些生殖细胞迅速而过早地离开减I前期,进入中期样阶段。
为了确定RBM46直接作用的RNA靶点,研究者在P12-14的WT小鼠睾丸中进行RBM46 eCLIP-seq(图三A)。结果显示,RBM46主要与3' UTR(60%)和编码序列(37%)结合(图三B);表现为在靶基因的最后一个外显子上结合增加,并显著富集在随后的3' UTR区域(图三C)。Motif分析发现RBM46优先与“AAUCAUGU”序列结合,“UGAUU”排第二(图三D)。研究者实验发现有丝分裂细胞周期因子CCNA2分别在Meioc KO、Ythdc2 KO和Neurog-cre Rbm46 KO的类精母细胞中异常高表达,并且RBM46在Ccna2基因的3' UTR区域存在多个motif结合位点(图三E),提示Ccna2是RBM46的直接作用靶点。小鼠睾丸RBM46 IP-MS结果显示,除了与YTHDC2、MEIOC结合以外,RBM46还与细胞质加工小体(P小体)的关键成分CNOT1,PABPC1、MOV10等存在相互作用(图三F),提示RBM46与RNA加工有关。凝胶迁移实验(EMSA)证明了RBM46与包含有motif序列的Ccna2 3' UTR可在体外直接结合(图三G)。
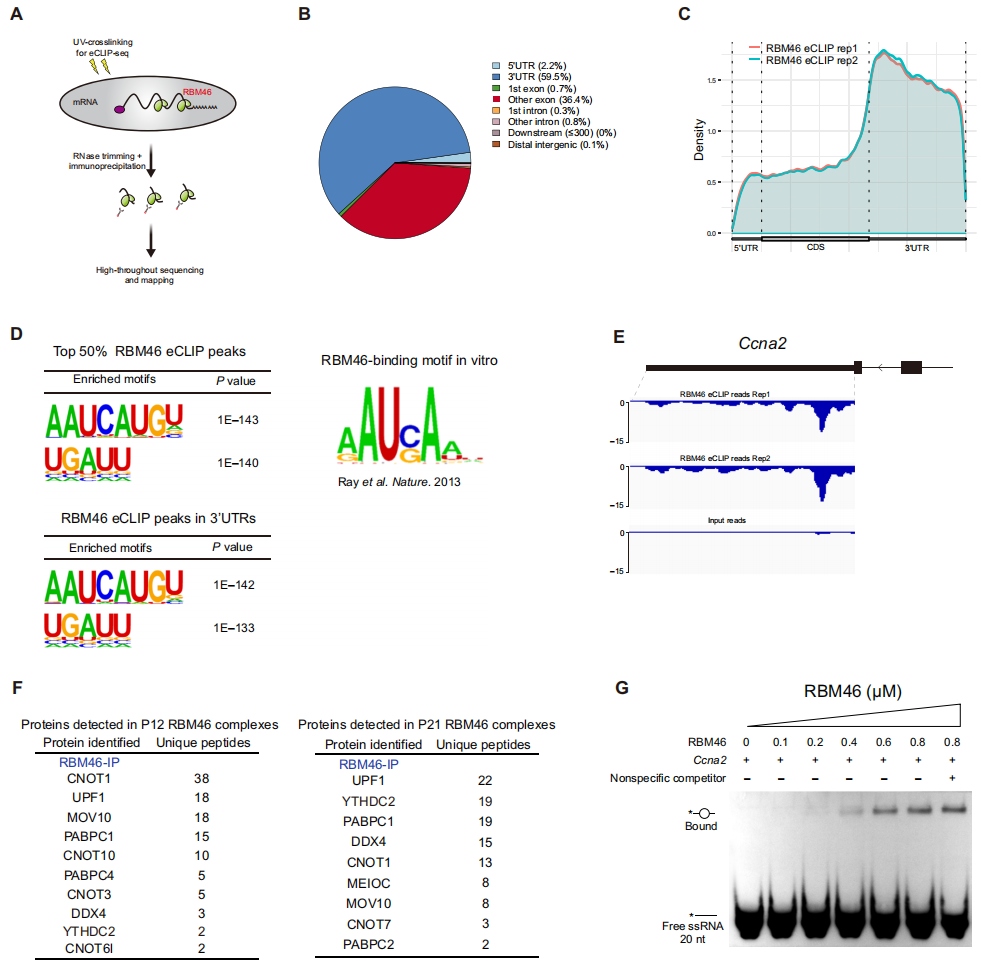
图三 RBM46选择性结合在靶mRNA的3' UTR [8]
最后,研究者将RBM46 eCLIP结果与发表的YTHDC2和MEIOC RNA靶点进行比较。YTHDC2主要结合在3' UTR[7],与RBM46的RNA结合分布相似(图四A)。在报道的P10小鼠睾丸的511个YTHDC2靶点中,53% YTHDC2结合位点在前后100核苷酸(nt)内也被RBM46结合,在70 nt窗口内共同结合的有52%(图四B)。Motif分析发现YTHDC2优先结合在“AAUCAUGU”序列(图四C),与RBM46的主要结合motif序列相同。为了确定RBM46和YTHDC2结合位点的位置关系,研究者分析了YTHDC2富含U motif的上下游100 nt窗口内的其他motif,同样获得了RBM46 motif序列“AAUCAUGU”(图四D),且RBM46倾向于结合在YTHDC2结合位点的5' 上游区域(图四E)。以上数据表明,RBM46的RNA结合位点与YTHDC2相邻且非常接近,它们可能作为同一蛋白质复合物共同靶向并作用于靶点上。
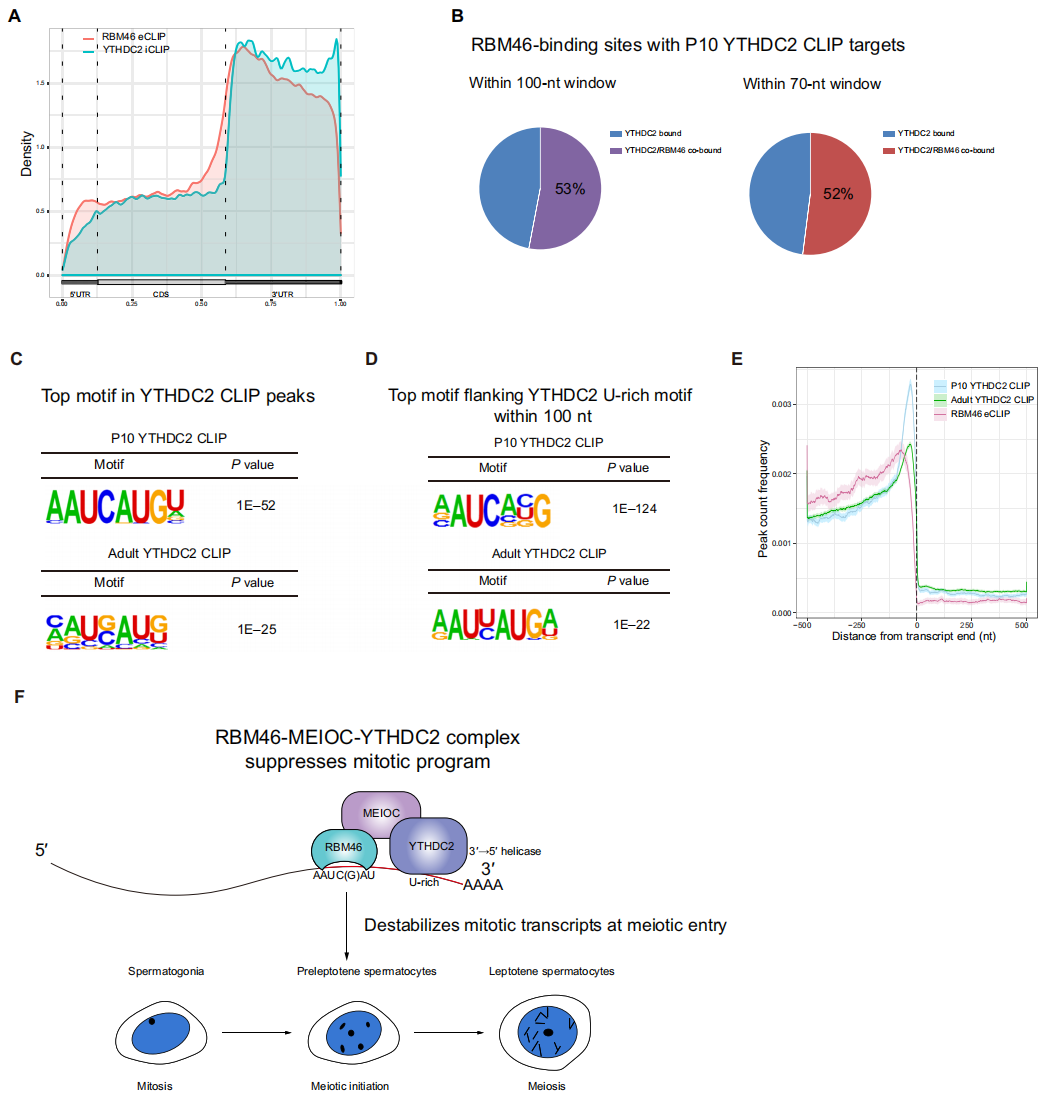
图四 RBM46的RNA结合位点与YTHDC2相邻[8]
综上所述,研究者发现RNA结合蛋白RBM46作为YTHDC2/MEIOC复合物的组成部分,形成一个转录后调控网络,在精子形成过程中识别与破坏有丝分裂相关转录本的稳定,确保成功进入减数分裂(图四F)。研究者实验证实RBM46睾丸特异性敲除小鼠的精母细胞出现有丝分裂到减数分裂的转变缺陷,导致不育。RBM46与YTHDC2/MEIOC的协同作用对于在减数分裂起始阶段正确退出有丝分裂程序至关重要,这对理解减数分裂相关的生育障碍具有重要意义。
此外,2022年9月,Protein & Cell也在线报道了RBM46在减数分裂起始过程中的其他功能,它对于联会复合体的正常形成是必需的。RBM46通过靶向粘连蛋白复合体亚基(cohesin complex subunits)的mRNA 3' UTR区域,调节粘连蛋白的翻译,从而确保减数分裂联会过程的正常进行[9]。

两篇文章中涉及的Rbm46-HA小鼠(图一G和H)的具体信息,可在GTP研发中心的标签小鼠(GTP ID: 19000583)产品列表中进行查询。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Koubova J, Menke DB, Zhou Q, Capel B, Griswold MD, Page DC. Retinoic acid regulates sex-specific timing of meiotic initiation in mice. Proc Natl Acad Sci U S A 2006,103(8):2474-2479.
2. Dominissini D, Moshitch-Moshkovitz S, Schwartz S, Salmon-Divon M, Ungar L, Osenberg S, Cesarkas K, Jacob-Hirsch J, Amariglio N, Kupiec M et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature 2012, 485(7397):201-206.
3. Fu Y, Dominissini D, Rechavi G, He C. Gene expression regulation mediated through reversible m(6)A RNA methylation. Nat Rev Genet 2014, 15(5):293-306.
4. Wojtas MN, Pandey RR, Mendel M, Homolka D, Sachidanandam R, Pillai RS. Regulation of m(6)A Transcripts by the 3'-->5' RNA Helicase YTHDC2 Is Essential for a Successful Meiotic Program in the Mammalian Germline. Mol Cell 2017, 68(2):374-387 e312.
5. Wojtas MN, Pandey RR, Mendel M, Homolka D, Sachidanandam R, Pillai RS. Regulation of m(6)A Transcripts by the 3'→5' RNA Helicase YTHDC2 Is Essential for a Successful Meiotic Program in the Mammalian Germline. Molecular cell 2017, 68(2):374-387.e312.
6. Abby E, Tourpin S, Ribeiro J, Daniel K, Messiaen S, Moison D, Guerquin J, Gaillard JC, Armengaud J, Langa F et al. Implementation of meiosis prophase I programme requires a conserved retinoid-independent stabilizer of meiotic transcripts. Nature communications 2016, 7:10324.
7. Li L, Krasnykov K, Homolka D, Gos P, Mendel M, Fish RJ, Pandey RR, Pillai RS. The XRN1-regulated RNA helicase activity of YTHDC2 ensures mouse fertility independently of m(6)A recognition. Molecular cell 2022, 82(9):1678-1690.e1612.
8. Qian B, Li Y, Yan R, Han S, Bu Z, Gong J, Zheng B, Yuan Z, Ren S, He Q et al. RNA binding protein RBM46 regulates mitotic-to-meiotic transition in spermatogenesis. Sci Adv 2022, 8(34):eabq2945.
9. Lv Y, Lu G, Cai Y, Su R, Liang L, Wang X, Mu W, He X, Huang T, Ma J et al. RBM46 is essential for gametogenesis and functions in post-transcriptional roles affecting meiotic cohesin subunits. Protein & cell 2022, pwac040.



