技术分享:用于光遗传学操纵和光声成像的BphP1条件性表达工具鼠
光遗传学操纵和活体深层组织成像是非侵入式研究个体与细胞在体生理过程的重要手段。由于具有低组织吸收率、低自体荧光和少光散射的优点,基于近红外光的基因编码光遗传学工具[1]和光声(PA)成像探针被广泛用于深层组织研究[2]。来自沼泽红假单胞菌的光敏色素BphP1可在近红外光诱导下与天然配体PpsR2结合,需要的发色团胆绿素在包括哺乳动物在内的真核生物中天然存在且含量丰富,因此BphP1-PpsR2构成的近红外光敏系统作为一种光遗传学工具[3]常被用于研究基因转录调控和蛋白质相互作用等[4]。
光声断层扫描(PAT)是一种混合光声成像模式,用于检测光诱导的超声波。BphP1的另一个优点是可以作为一种光声分子探针,其光声成像深度远远超过其他光学成像技术[5]所能达到的深度。充分利用BphP1的强近红外光吸收和生物组织的弱声学衰减,PAT可以实现厘米深度的高空间分辨率成像。此外,BphP1可逆的光开关属性便于差异性排除来自血红蛋白的背景信号,进而将分子检测灵敏度提高三个数量级[5, 6]。尽管PAT已越来越多地用于动物模型的深层组织研究,但迄今为止还没有特异性表达可逆性光声探针的转基因小鼠模型被报道。鉴于BphP1作为差分PAT探针的优越光学特性,构建BphP1转基因小鼠模型可拓宽PAT在活体深层组织成像研究中的应用。
2022年5月,Nature Communications上报道了一种可用于近红外光遗传学操纵和光声成像的转基因小鼠模型,称为loxP-BphP1小鼠。该BphP1条件性表达工具鼠在loxP位点的控制下表达BphP1-mCherry-TetR转基因,表现为Cre重组酶依赖性的时空表达。该小鼠内源性BphP1-mCherry-TetR蛋白具有光遗传学性能,可在近红外光照射下激活小鼠及其细胞的基因转录。此外,在光声成像方面,该小鼠可在Cre介导下进行不同内脏器官、发育胚胎等活体深层组织BphP1光声成像,具有高检测灵敏度[7]。
首先,研究者构建了loxP-BphP1小鼠。在小鼠胚胎干细胞中将loxP-EGFP-loxP-BphP1-mCherry-TetR元件(图一a)定点插入Rosa26基因座,通过囊胚注射获得loxP-BphP1小鼠。经三对引物的基因型鉴定(图一b),杂合小鼠可同时检测到未修饰Rosa26和转基因序列,而野生型小鼠仅检测到Rosa26序列,纯合小鼠仅有转基因序列(图一c,上图)。将loxP-BphP1小鼠与Vasa-Cre小鼠杂交后,可在Vasa-Cre小鼠的生殖细胞中切除EGFP序列,促使BphP1-mCherry-TetR蛋白在F1小鼠(BphP1-Crevasa)中普遍表达(图一c和d)。IVIS光谱在体荧光成像显示,loxP-BphP1纯合小鼠相比杂合子,在小鼠尾部显示出更强的EGFP荧光(图一e)。分离loxP-BphP1纯合小鼠的原代神经元和成纤维细胞进行体外培养测试,在转导AAV-Cre后可见部分细胞仅表达mCherry(图一f和g),表明Cre依赖性切除EGFP并成功启动BphP1-mCherry-TetR表达。研究者进一步在BphP1-Crevasa小鼠的尾部检测到EGFP阴性且mCherry阳性表达,同样地纯合子mCherry信号强于杂合子(图一h)。以上结果表明loxP-BphP1小鼠在Cre介导下沉默EGFP表达,进而表达BphP1-mCherry-TetR蛋白。
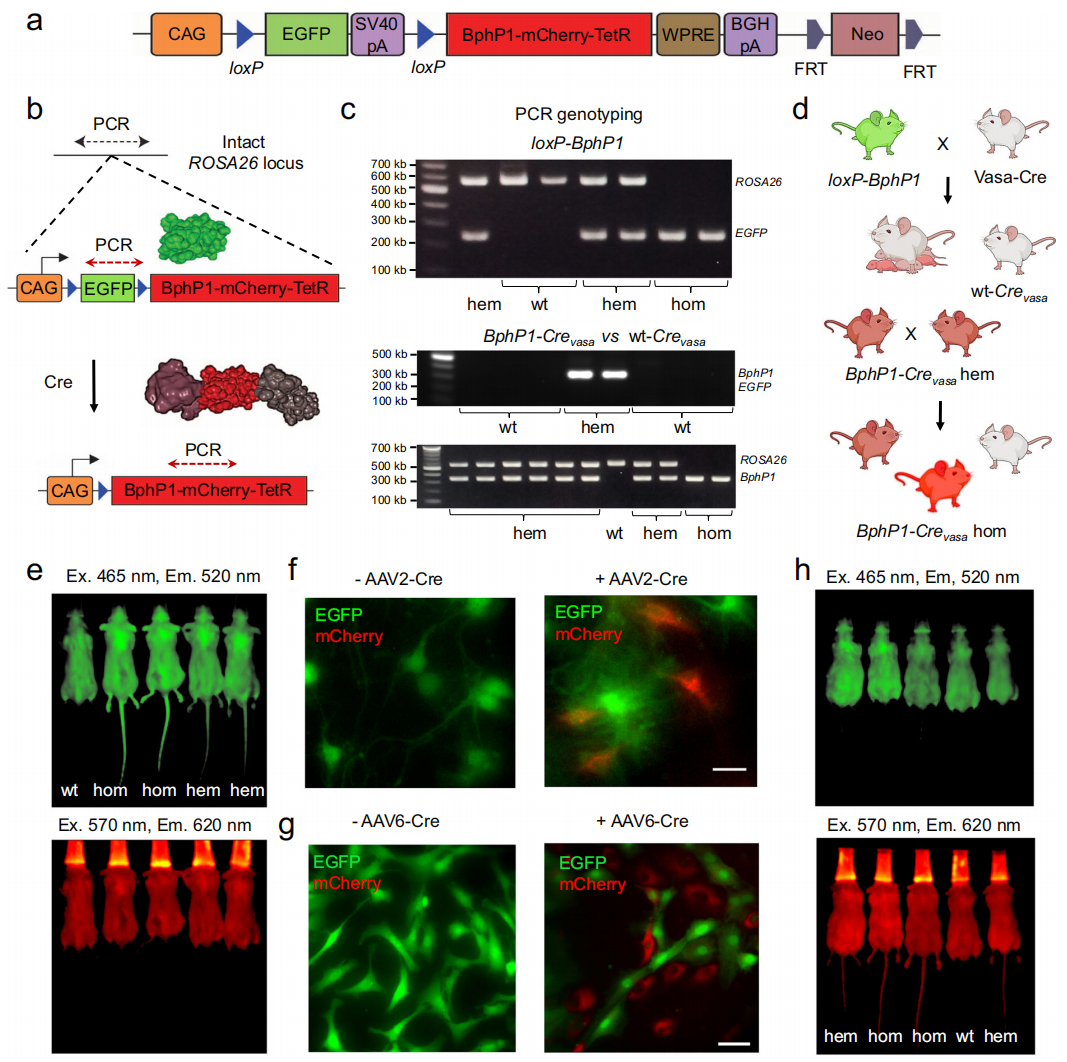
图一 loxP-BphP1小鼠的构建以及Cre依赖的BphP1表达[7]
接下来,研究者在体外测试BphP1-Crevasa小鼠的光遗传学激活性能。从刚出生的BphP1-Crevasa纯合小鼠(图二c)中分离出原代神经元、皮肤成纤维细胞和内皮细胞,体外培养7天后AAV递送2个元件。其一,CAG-NLS-QPAS1-VP16编码携带核定位信号的BphP1优化版配体QPAS1;其二,TRE-Tight2-AkaLuc编码由TRE驱动的AkaLuc荧光素酶报告基因(图二b)。在近红外光的照射下,BphP1和QPAS1发生异二聚体化,进而在核定位信号的帮助下进入细胞核,使得TetR结合TRE序列,并与VP16转录激活下游AkaLuc报告基因(图二a)。AAV转导7天后,细胞在740/25nm光照24小时或保持黑暗,随后添加荧光素酶底物AkaLumine-HCl检测生物发光(图二b)。结果显示,相比黑暗状态对照组,近红外光诱导BphP1介导的AkaLuc生物发光在神经元中为5.8倍(图二d),皮肤成纤维细胞为7.9倍(图二e),内皮细胞为5.7倍(图二f)。以上数据表明,基于BphP1的光遗传学工具可在体外细胞中激活基因转录。
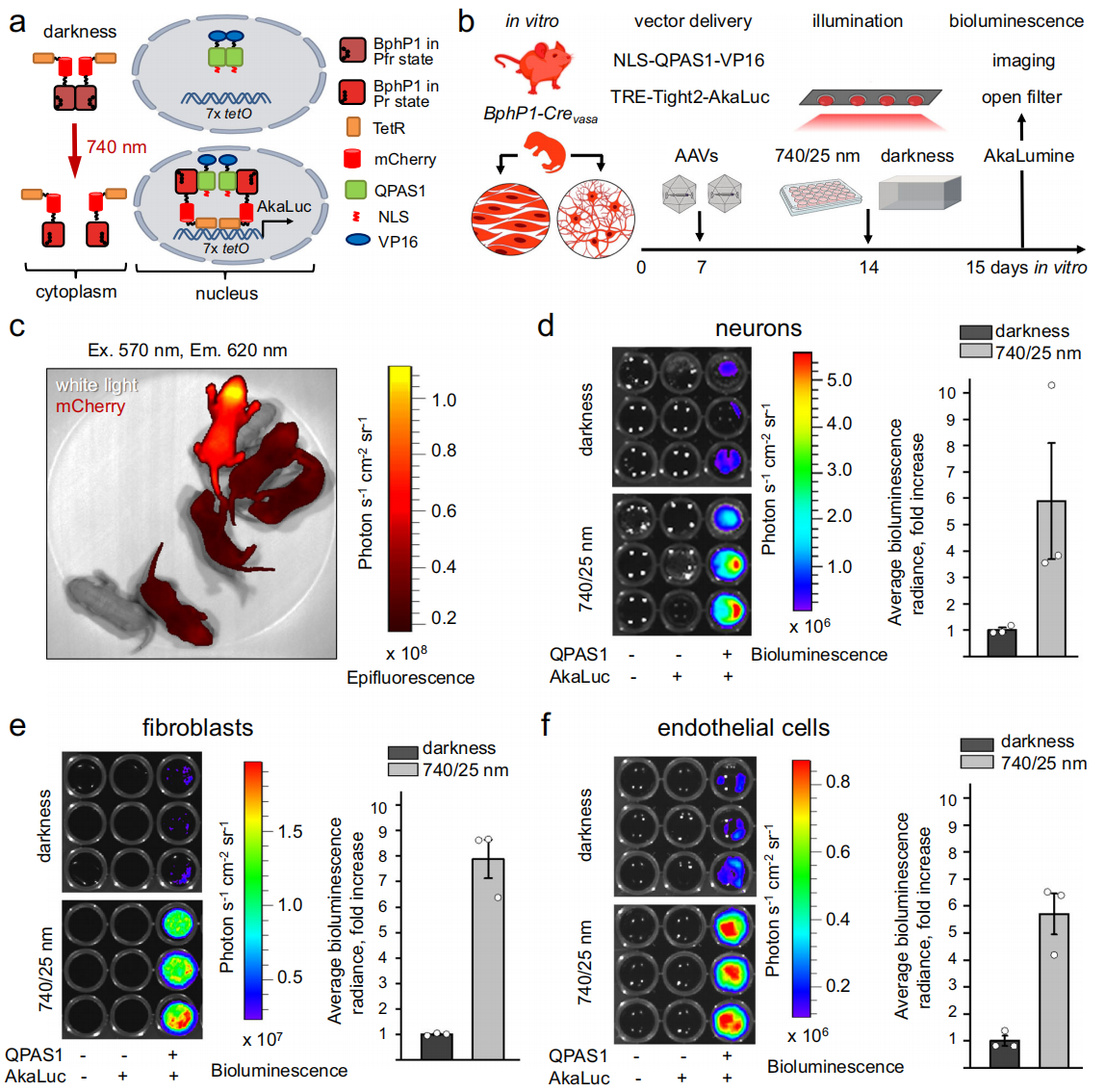
图二 BphP1-Crevasa小鼠的原代细胞体外光遗传学激活基因转录[7]
随后,研究者进一步测试BphP1-Crevasa小鼠的在体光遗传学激活性能。使用流体动力学尾静脉注射向肝递送质粒CAG-NLS-QPAS1-VP16和TRE-Tight2-AkaLuc,1小时后740/25 nm光照小鼠或黑暗保持24小时,随后注射底物AkaLumine-HCl检测生物发光(图三a)。结果显示,光照下内源性BphP1-mCherry-TetR诱导小鼠肝脏AkaLuc转录激活为12.4倍(图三b)。以上结果表明,近红外光可诱导BphP1-Crevasa小鼠的体内基因转录激活。
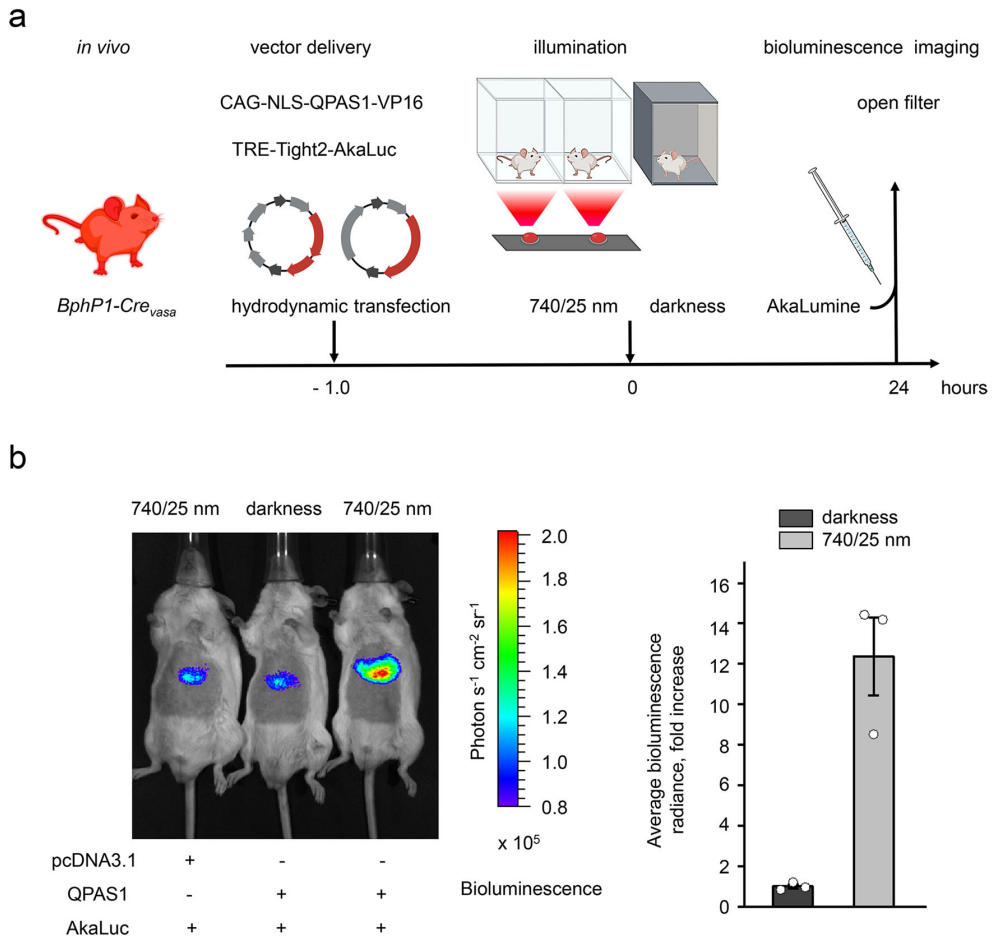
图三 BphP1-Crevasa小鼠的在体光遗传学激活基因转录[7]
接下来,研究者测试BphP1-Crevasa小鼠的光声成像性能。选择750 nm的脉冲光用于光声成像,635 nm和790 nm分别作为BphP1 ON和OFF状态的光开关波长(图四a),同时构建了基于商用Vesasonics扫描仪的高速PAT系统(图四b)。BphP1-Crevasa小鼠的光开关和光声成像的时间顺序如图四c所示,每个开关/成像周期为16秒,通过比较每个周期的开始(ON状态)和结束(OFF状态)采集的光声图像获得差分图像,可有效消除血液背景信号。研究者展示了包括肝脏、胃、脾脏和肠道的代表性小鼠横截面的差分光声成像(图四d);在肝脏等器官中检测到稳健且可重复的BphP1光开关信号(图四e);差分光声成像结果显示,与胃相比,小鼠肝脏和脾脏中的BphP1全息信号更高(图四f),反映出内源性胆绿素在这些器官里本底水平更高些。以上结果表明,BphP1转基因小鼠模型能够实现PAT深度穿透和高检测灵敏度。
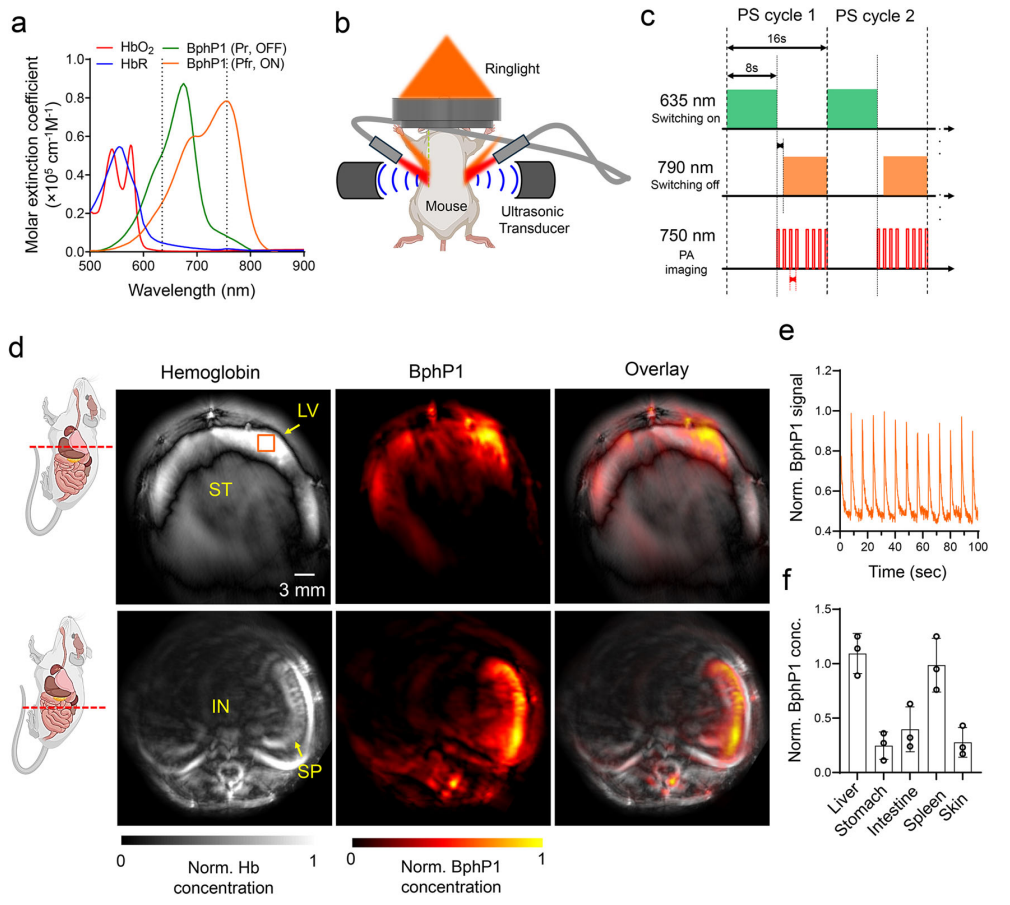
图四 BphP1-Crevasa小鼠的全身光声成像[7]
对发育中的胚胎进行活体无创成像是发育与生殖生物学的迫切需要。为了验证胚胎在母体中的位置,研究者开发了一种混合光声与超声的系统,可以同时对组织形态和分子信息进行双模态成像(图五b)。将loxP-BphP1纯合雄鼠与Vasa-Cre纯合雌鼠杂交,怀孕雌鼠在E15天时进行成像(图五a)。经超声确认孕鼠体内共有7个胚胎,它们大小各不相同,位于腹部皮肤表面以下1-7 mm的深度(图五c)。IVIS光谱结果证实了BphP1仅在胚胎中表达(图五d)。然后,在与超声成像大致相同的位置对孕鼠进行差分光声成像。正如预期,传统PAT图像里整个小鼠的血液背景信号较高(图五e),难以区分胚胎和母体器官。相比之下,通过差分光声成像获得的BphP1信号仅在胚胎中被检测到,不包含有母体器官(图五f)。胚胎中观察到稳健且可重复的BphP1光开关信号(图五g)。双模态成像结果显示,超声成像识别的所有胚胎都有BphP1阳性信号,即两种成像模式显示的胚胎位置一致(图五h)。以上结果表明,表达BphP1的胚胎可用于体内无创光声成像。
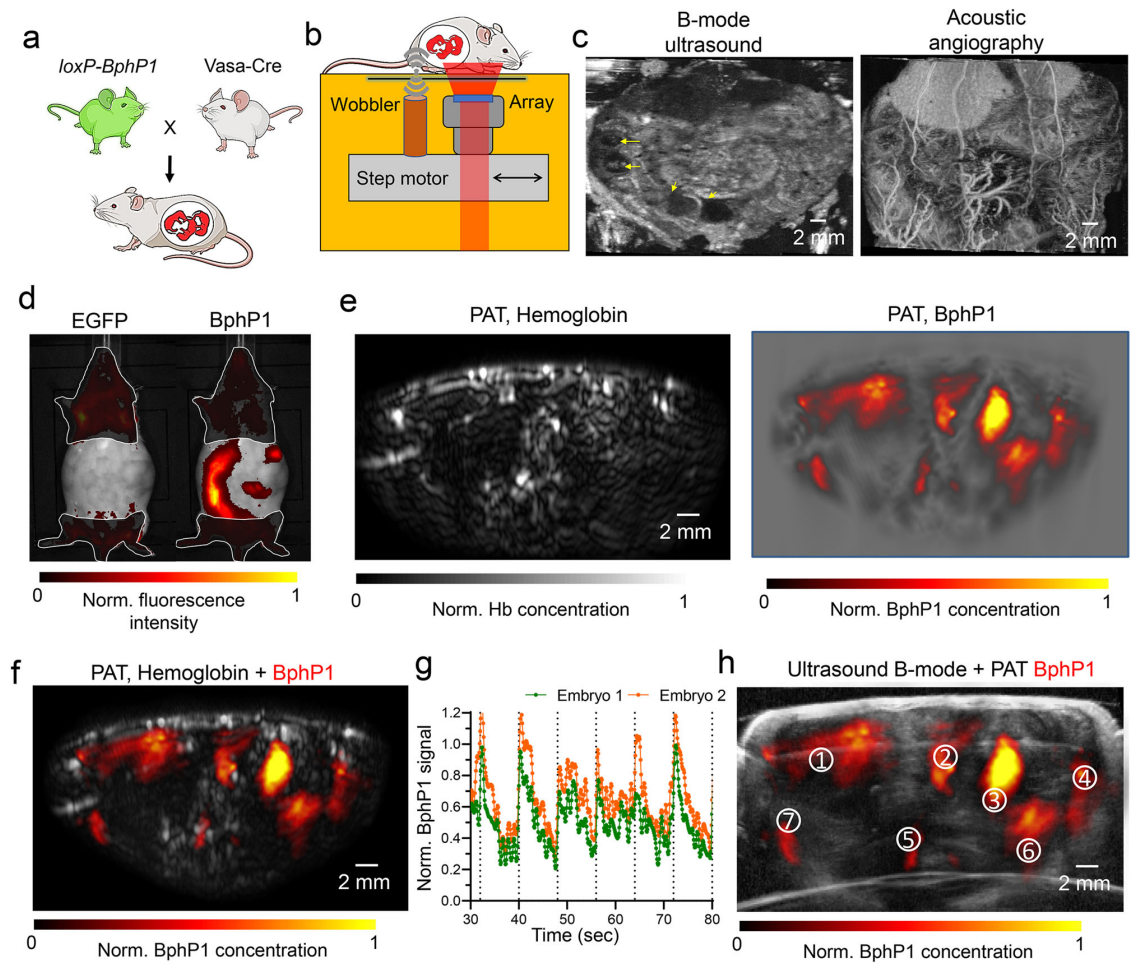
图五BphP1-Crevasa胚胎可用于体内无创光声成像[7]
综上所述,研究者开发的loxP-BphP1小鼠能够实现Cre依赖的时空光遗传学调控以及利用BphP1在不同器官、发育胚胎等深层组织中进行光声成像。该BphP1条件性表达工具鼠为活体近红外光遗传学和光声成像提供了重要研究模型,未来可广泛地运用于组织发育和形态发生、细胞群体命运、同种异体移植动力学、组织再生、肿瘤发展和感染扩散等相关研究。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Manoilov KY, Verkhusha VV, Shcherbakova DM. A guide to the optogenetic regulation of endogenous molecules. Nature methods 2021, 18(9):1027-1037.
2. Ntziachristos V. Going deeper than microscopy: the optical imaging frontier in biology. Nature methods 2010, 7(8):603-614.
3. Braatsch S, Johnson JA, Noll K, Beatty JT. The O2-responsive repressor PpsR2 but not PpsR1 transduces a light signal sensed by the BphP1 phytochrome in Rhodopseudomonas palustris CGA009. FEMS Microbiol Lett 2007, 272(1):60-64.
4. Bellini D, Papiz MZ. Structure of a bacteriophytochrome and light-stimulated protomer swapping with a gene repressor. Structure (London, England : 1993) 2012, 20(8):1436-1446.
5. Yao J, Kaberniuk AA, Li L, Shcherbakova DM, Zhang R, Wang L, Li G, Verkhusha VV, Wang LV. Multiscale photoacoustic tomography using reversibly switchable bacterial phytochrome as a near-infrared photochromic probe. Nature methods 2016, 13(1):67-73.
6. Li L, Shemetov AA, Baloban M, Hu P, Zhu L, Shcherbakova DM, Zhang R, Shi J, Yao J, Wang LV et al. Small near-infrared photochromic protein for photoacoustic multi-contrast imaging and detection of protein interactions in vivo. Nature communications 2018, 9(1):2734.
7. Kasatkina LA, Ma C, Matlashov ME, Vu T, Li M, Kaberniuk AA, Yao J, Verkhusha VV. Optogenetic manipulation and photoacoustic imaging using a near-infrared transgenic mouse model. Nature communications 2022, 13(1):2813.



