技术分享:AAV8-Lhcgr基因治疗Lhcgr缺陷小鼠产生可育后代
睾酮是调控男性表型和生殖功能发育与维持的关键激素,主要由位于生精小管之间的睾丸间质细胞负责合成与分泌。睾酮合成过程涉及多个基因参与的多个反应步骤。当其中一个基因缺失时会引起睾丸间质细胞衰竭(LCF),导致睾酮缺乏和发育异常,进而导致精子发生受阻和男性不育[1]。虽然睾酮替代疗法(TRT)可以恢复血清睾酮水平,但是这种传统疗法难以恢复生育能力,特别是用于治疗遗传性LCF少有成功[2]。基因治疗是治疗遗传性LCF的最有前途策略之一,可以通过注射病毒载体将基因转导至睾丸中。可是腺病毒会引起睾丸炎症反应,使得基因表达逐渐消失[3];慢病毒会将基因整合到生殖细胞中,引起伦理安全问题[4]。重组腺相关病毒(AAV)载体凭借理想的安全性优势,已成为在体基因治疗的有力工具[5]。然而,AAV介导的基因治疗能否恢复睾酮水平以及治疗遗传性LCF仍不清楚,因此迫切需要在遗传性LCF动物模型中评价其基因治疗的可行性、安全性和有效性。
Lhcgr基因编码黄体生成素/绒毛膜促性腺激素受体,在哺乳动物中高度保守,是睾丸间质细胞成熟和睾酮合成所必需的。Lhcgr缺陷的Lhcgr -/-雄性小鼠的睾丸间质细胞发育受损,导致睾酮水平显著降低,表现出性发育迟缓、精子形成缺陷和雄性不育,与人类LCF的疾病表型相似[6, 7]。因此,Lhcgr -/-小鼠可作为研究基因治疗遗传性LCF的合适动物模型。
2022年10月,Cell Reports Medicine上报道了利用Lhcgr -/-小鼠模型来评价基因治疗遗传性LCF的可行性。研究者确定了AAV8作为高效特异性靶向睾丸间质祖细胞的基因递送载体。AAV8-Lhcgr基因治疗后,可以恢复青春期和成年Lhcgr -/-小鼠的睾酮水平,促进睾丸间质细胞成熟,重启性发育,挽救精子形成,从而有效产生健康可育的后代[8]。
由于不同的AAV血清型具有不同的组织细胞倾向性,为了测试最佳递送载体,研究者将不同血清型的CAG-mCherry报告AAV注射入Lhcgr -/-小鼠睾丸,发现在相同的病毒滴度下,AAV8在测试的血清型中表现出最高的转导效率以及特异性靶向睾丸间质祖细胞,并且具有良好的安全性和耐受性,因此选择AAV8用于后续实验。首先,研究者利用Lhcgr -/-小鼠模型来确定基于AAV8的基因治疗能否有效恢复Lhcgr表达和睾酮水平,构建了CAG启动子驱动Lhcgr表达的AAV8载体(AAV8-Lhcgr)(图一A),选择3周龄Lhcgr -/-小鼠来确定不同剂量梯度的AAV8-Lhcgr对青春期LCF的治疗效果(图一B),同时设立PBS处理的Lhcgr -/-小鼠作为阴性对照组,不做任何处理的Lhcgr +/+和Lhcgr +/-小鼠作为正常对照组。治疗4周后,睾丸组织的RT-PCR结果显示,与PBS对照组相比,AAV8-Lhcgr治疗组小鼠睾丸中Lhcgr的mRNA呈病毒剂量依赖性表达,注射量为8×1010拷贝/睾丸时表现最佳(图一C)。免疫染色结果显示,AAV8-Lhcgr治疗组小鼠的睾丸间质中存在明显的LHCGR表达(图一D)。此外,AAV8-Lhcgr治疗组小鼠的血清睾酮浓度上升显著,且呈剂量依赖性增加(图一E);对精子发生至关重要的睾丸内睾酮浓度也显著增加(图一F);血清二氢睾酮浓度显著增加(图一G)。研究者进一步检测血清促黄体生成素(LH)和卵泡刺激素(FSH)水平,结果显示,LH水平显著下降(图一H),但FSH水平没有显著变化(图一I),表明下丘脑-垂体-性腺轴对睾酮水平的正常负反馈。以上数据表明,AAV8-Lhcgr基因治疗增加了Lhcgr在睾丸中的表达,恢复了青春期Lhcgr -/-小鼠的睾酮水平。
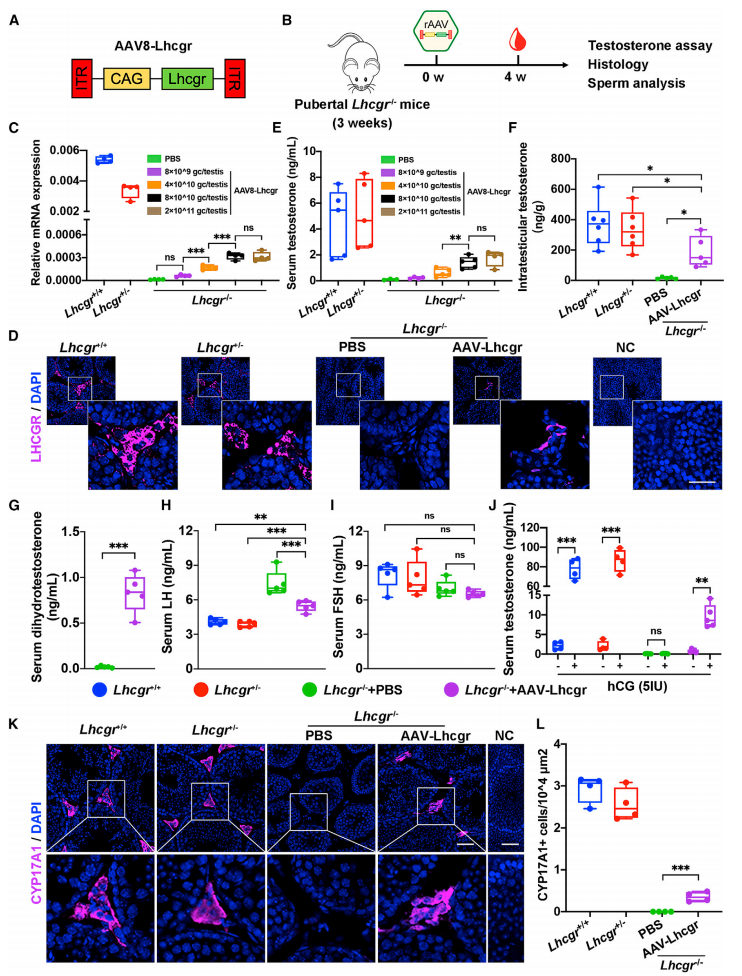
图一 AAV8-Lhcgr基因治疗挽救青春期Lhcgr -/-小鼠的睾丸间质细胞功能和睾酮水平[8]
研究者进一步通过注射人绒毛膜促性腺激素(hCG),评估基因治疗对青春期小鼠睾丸间质细胞成熟的影响。结果显示,AAV8-Lhcgr治疗组小鼠注射hCG后,血清睾酮浓度增加了10倍以上(图一J)。免疫荧光结果显示,AAV8-Lhcgr治疗组小鼠睾丸间质中的成熟睾丸间质细胞标志物CYP17A1的表达显著增加(图一K和L)。以上数据表明,AAV8-Lhcgr基因治疗促进了青春期Lhcgr -/-小鼠睾丸间质细胞的成熟。
接下来,研究者检测AAV8-Lhcgr(8×1010拷贝/睾丸)基因治疗的Lhcgr -/-小鼠是否伴随着性发育的正常化。结果发现,保留的睾丸在基因治疗4周后下降到阴囊,发育不良的外生殖器阴茎和阴囊大小接近正常对照组(图二A-B);与PBS对照组相比,肛门与生殖器的距离(图二C)、阴茎长度(图二D)、睾丸重量(图二E)和附睾重量(图二F)都显著增加,表明基因治疗后雄性化得到促进;精囊重量增加到正常对照组的约37%(图二G);前列腺重量超过正常对照组的一半(图二H);输精管重量和长度显著增加(图二I和J)。以上数据表明,AAV8-Lhcgr基因治疗重启了青春期Lhcgr -/-小鼠的性发育。
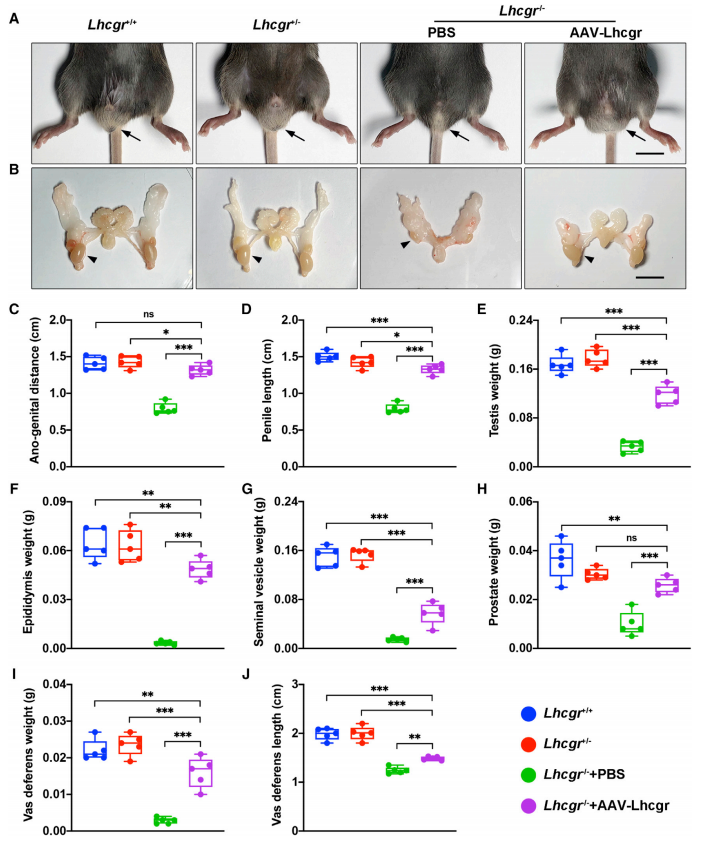
图二 AAV8-Lhcgr基因治疗重启青春期Lhcgr -/-小鼠的性发育[8]
接下来,研究者检测AAV8-Lhcgr(8×1010拷贝/睾丸)基因治疗能否挽救青春期Lhcgr -/-小鼠的精子形成。组织学分析结果显示,相较于PBS对照组,AAV8-Lhcgr治疗组小鼠的生精小管宽度增加,并且有明显的精子形成(图三A),附睾尾部管腔直径恢复并出现大量精子(图三B)。计算机辅助精液分析(CASA)显示AAV8-Lhcgr治疗组小鼠的精子数量增加到正常对照组的一半以上(图三C和D),精子活力与正常对照组没有明显差异(图三E和F)。以上数据表明,AAV8-Lhcgr基因治疗可以挽救青春期Lhcgr -/-小鼠的精子形成,并显著增加精子的数量和活力。
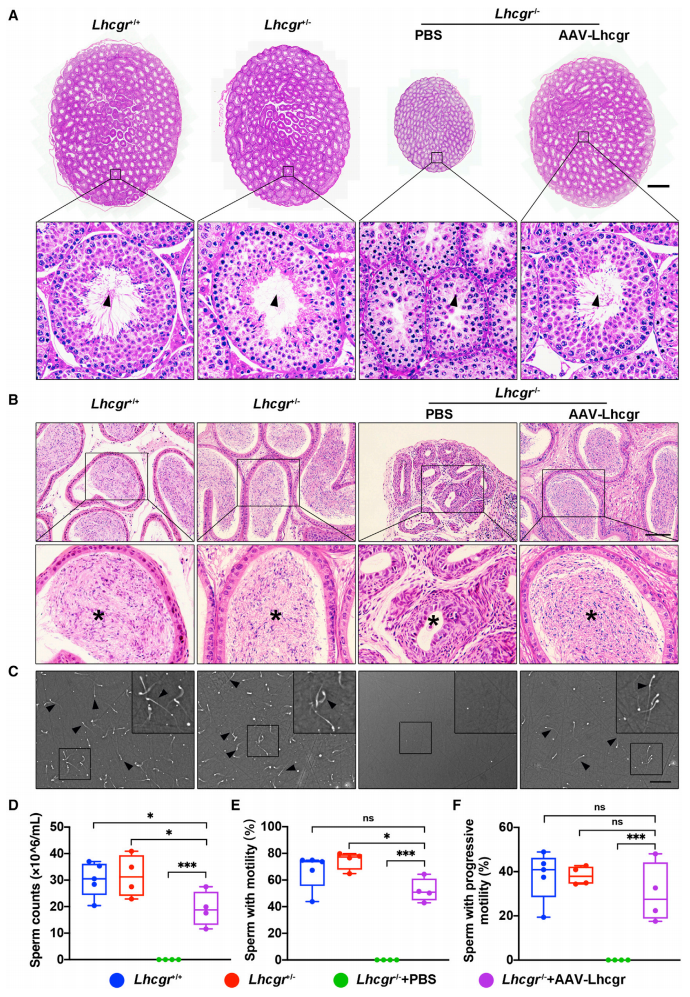
图三 AAV8-Lhcgr基因治疗挽救青春期Lhcgr -/-小鼠的精子形成[8]
随后,研究者对基因治疗后产生的精子的受精能力进行评估,从AAV8-Lhcgr基因治疗4周后雄性Lhcgr -/-小鼠的附睾尾部获得精子,将其与Lhcgr +/+雌性小鼠的卵母细胞进行体外受精(IVF)(图四A),最终成功获得58只子代小鼠。对8只子代幼鼠(图四B)进行基因型鉴定,野生型和突变型等位基因的分布比例符合孟德尔定律(图四C)。使用CAG-Lhcgr特异性引物对8只子代幼鼠进行鼠尾鉴定,未检测到任何载体序列的整合(图四D),Southern分析也没有检测到信号(图四E),表明AAV8递送的基因没有整合到子代基因组中。进一步地,研究者将子代雄鼠和雌鼠分别与Lhcgr +/+小鼠自然交配(图四F和J),均表现出正常的生育能力(图四G-I,K-M)。以上数据表明,AAV8-Lhcgr基因治疗可恢复青春期Lhcgr -/-小鼠的生育能力并产生健康可育的后代。
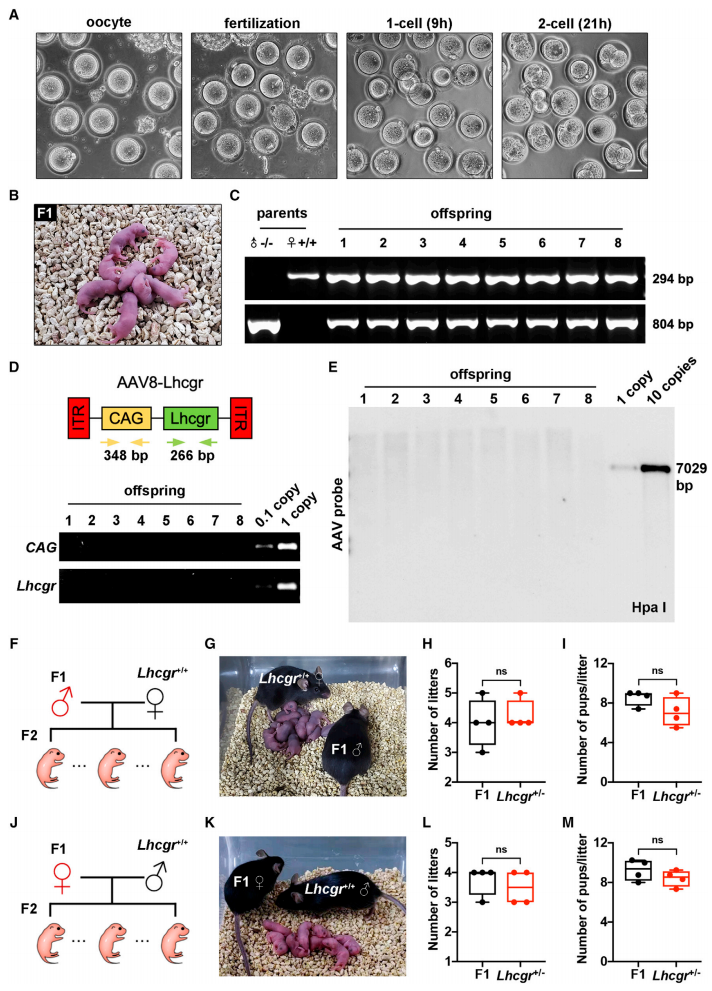
图四 AAV8-Lhcgr基因治疗可恢复Lhcgr -/-小鼠生育能力并产生可育后代[8]
由于成年LCF患者错过了青春期治疗的最佳机会[9],研究者进一步测试AAV8-Lhcgr基因治疗是否对成年小鼠仍具有治疗潜力。给8周龄Lhcgr -/-小鼠注射AAV8-Lhcgr(8×1010拷贝/睾丸),4周后评估效果(图五A)。结果显示,与PBS对照组相比,AAV8-Lhcgr治疗组小鼠的Lhcgr表达水平显著增加(图五B),血清和睾丸内睾酮水平以及血清二氢睾酮水平同样显著升高(图五C-E),性发育和精子形成恢复正常(图五F-H),附睾中精子数量和活力也显著增加(图五I-K)。以上数据表明,AAV8-Lhcgr基因治疗同样可以恢复成年Lhcgr -/-小鼠的睾酮水平并挽救精子形成。
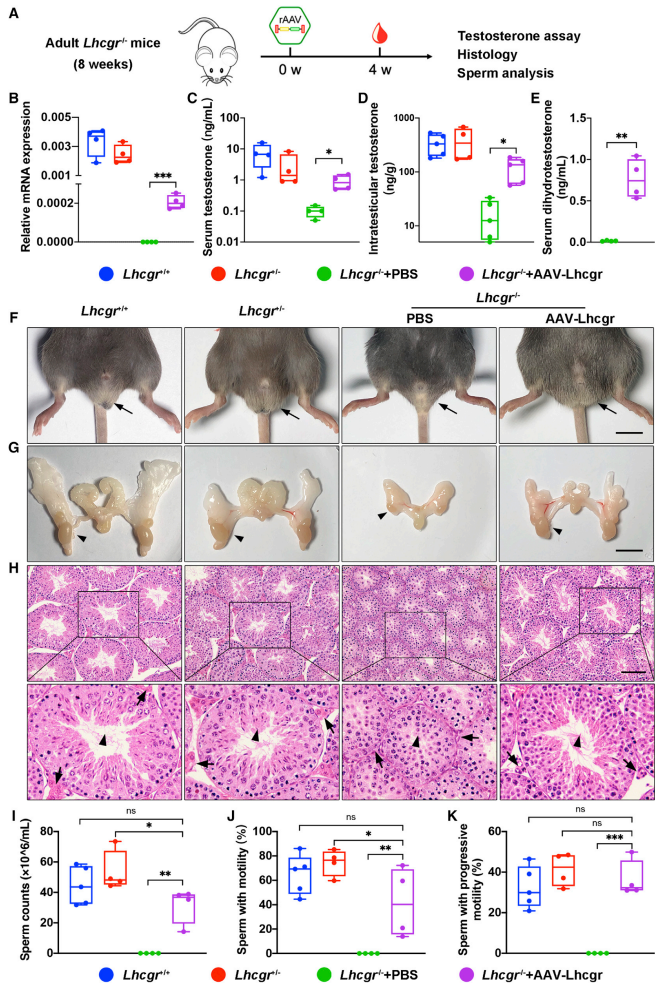
图五 AAV8-Lhcgr基因治疗重启成年Lhcgr -/-小鼠的性发育并挽救精子形成[8]
综上所述,研究者证明了AAV8-Lhcgr基因治疗可以恢复青春期Lhcgr -/-小鼠的睾酮水平、重启性发育、挽救精子形成、恢复生育能力以及产生健康可育后代。此外,研究者还证明这种AAV8介导的基因疗法对错过青春期治疗的成年LCF小鼠同样具有治疗潜力。该研究证实了AAV8介导的基因递送用于治疗遗传性LCF的可行性,为遗传性LCF的基因治疗新疗法奠定了重要的临床前研究基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Teerds KJ, Huhtaniemi IT. Morphological and functional maturation of Leydig cells: from rodent models to primates. Human reproduction update 2015, 21(3):310-328.
2. Kathrins M, Niederberger C. Diagnosis and treatment of infertility-related male hormonal dysfunction. Nat Rev Urol 2016, 13(6):309-323.
3. Darbey A, Rebourcet D, Curley M, Kilcoyne K, Jeffery N, Reed N, Milne L, Roesl C, Brown P, Smith LB. A comparison of in vivo viral targeting systems identifies adeno-associated virus serotype 9 (AAV9) as an effective vector for genetic manipulation of Leydig cells in adult mice. Andrology 2021, 9(1):460-473.
4. Yang F, Whelan EC, Guan X, Deng B, Wang S, Sun J, Avarbock MR, Wu X, Brinster RL. FGF9 promotes mouse spermatogonial stem cell proliferation mediated by p38 MAPK signalling. Cell Prolif 2021, 54(1):e12933.
5. Pasi KJ, Rangarajan S, Mitchell N, Lester W, Symington E, Madan B, Laffan M, Russell CB, Li M, Pierce GF et al. Multiyear Follow-up of AAV5-hFVIII-SQ Gene Therapy for Hemophilia A. N Engl J Med 2020, 382(1):29-40.
6. Lei ZM, Mishra S, Zou W, Xu B, Foltz M, Li X, Rao CV. Targeted disruption of luteinizing hormone/human chorionic gonadotropin receptor gene. Molecular endocrinology (Baltimore, Md) 2001, 15(1):184-200.
7. Kossack N, Troppmann B, Richter-Unruh A, Kleinau G, Gromoll J. Aberrant transcription of the LHCGR gene caused by a mutation in exon 6A leads to Leydig cell hypoplasia type II. Molecular and cellular endocrinology 2013, 366(1):59-67.
8. Xia K, Wang F, Lai X, Dong L, Luo P, Zhang S, Yang C, Chen H, Ma Y, Huang W et al. AAV-mediated gene therapy produces fertile offspring in the Lhcgr-deficient mouse model of Leydig cell failure. Cell Rep Med 2022:100792.
9. Troppmann B, Kleinau G, Krause G, Gromoll J. Structural and functional plasticity of the luteinizing hormone/choriogonadotrophin receptor. Hum Reprod Update 2013, 19(5):583-602.



