技术分享:乙醛酸盐代谢失衡增加NAFLD高草酸尿症风险
非酒精性脂肪肝病(NAFLD)是西方国家最常见的肝病,常伴有肥胖、高脂血症、高血压、胰岛素抵抗等代谢综合征[1, 2],并且会导致其他肝外并发症,如心血管疾病、慢性肾病和肾结石等。当尿液中的草酸盐浓度升高导致高草酸尿症时,会增加肾结石 的风险。肝脏中的乙醛酸盐(Glx)代谢主要生成草酸盐,占血液循环草酸盐总量的85%-90%[3],然而其是否参与NAFLD中草酸盐等致结石物质的形成还未被详细报道。
2021年8月,Cell Reports杂志上报道了一种整合表观基因组和转录组分析的方法,发现了NAFLD小鼠肝细胞中乙醛酸盐(Glx)代谢通路的改变,主要表现为丙氨酸-乙醛酸氨基转移酶(Agxt)的高甲基化和低表达,导致过多的草酸盐累积。回补Agxt或抑制羟脯氨酸(Hyp)分解代谢可改善NAFLD小鼠的草酸盐累积现象。在NAFLD患者中也发现了AGXT的下调表达,该研究为NAFLD增加肝外并发症肾结石的风险提供了一种疾病分子机制[4]。
研究者首先利用广泛使用的NAFLD小鼠模型[5],在对照组(ob/+)和肥胖(ob/ob)小鼠的肝细胞中鉴定与脂肪变性相关的转录组和表观基因组改变,并与NAFLD患者的公共数据库信息进行交叉分析,交集得到AGXT这一候选基因(图一A)。在ob/ob肝细胞中,Agxt表现为低mRNA表达、高甲基化和低染色体可及性(图一B)。AGXT是一种肝脏特异性表达的蛋白酶,负责催化乙醛酸盐(Glx)转化为甘氨酸,防止其转化为草酸盐(图一C)。AGXT功能缺失突变会导致原发性高草酸尿症I型(PH1),并且纯合子Agxt -/-小鼠也表现出PH1疾病特征[6]。因此,研究者聚焦于研究NAFLD相关的Agxt改变对肝脏草酸盐生成的影响。
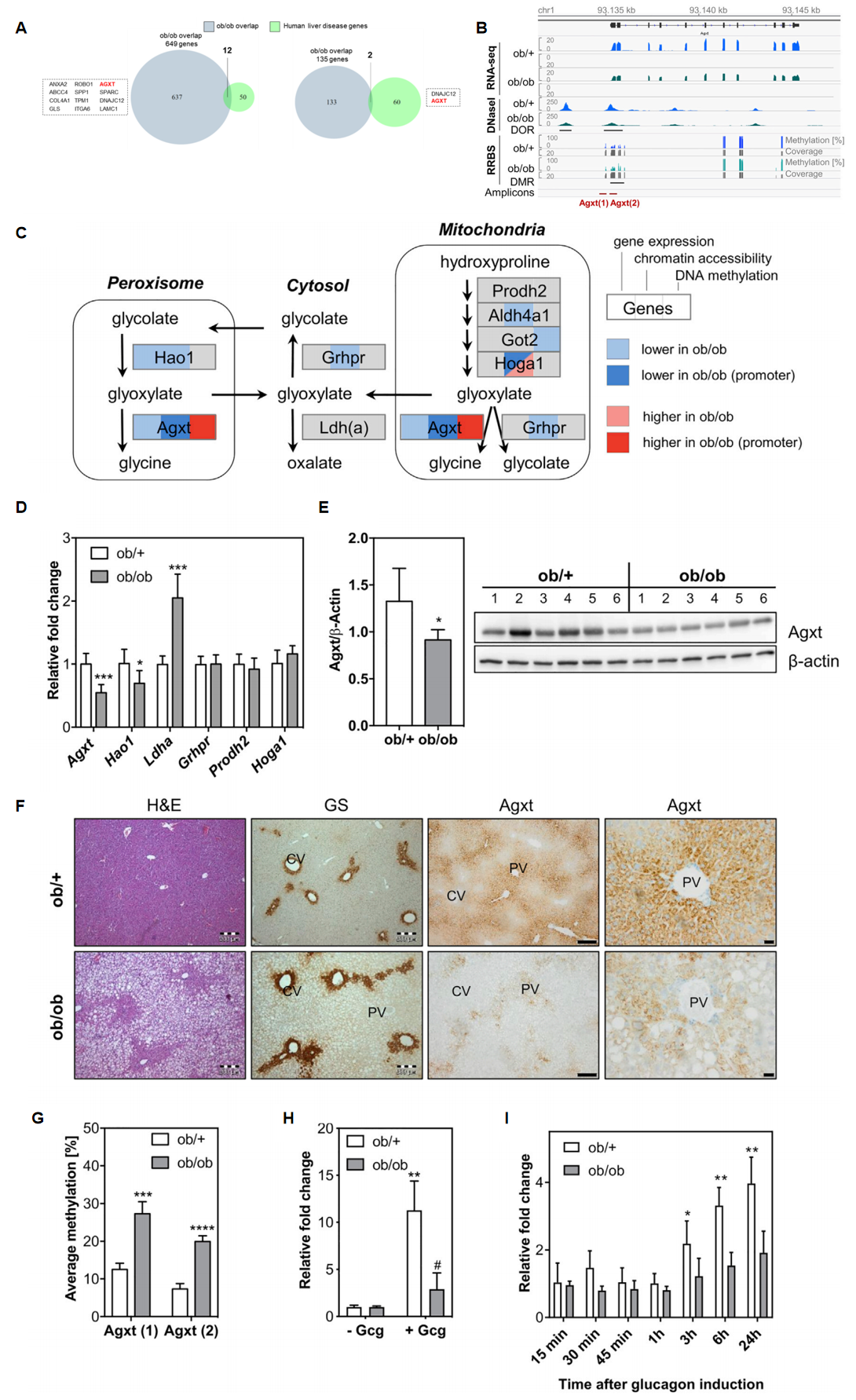
图一 乙醛酸盐代谢通路基因在NAFLD小鼠中的转录组和表观基因组改变[4]
研究者进一步分析了参与小鼠肝脏乙醛酸盐(Glx)代谢的相关基因(图一C),例如:Hao1负责在过氧化物酶体中将乙醇酸盐(Glc)转化为Glx[7];Prodh2和Hoga1分别在线粒体中催化羟脯氨酸(Hyp)转为Glx的第一步和最后一步[8];Grhpr在线粒体和细胞质中将Glx转为Glc;以及Ldha等肝脏特异性乳酸脱氢酶可将细胞质中的Glx转化为草酸盐。RNA-seq结果显示,Hao1与Agxt相似在ob/ob肝细胞中被显著下调,还观察到Got2的DNA低甲基化以及Hao1、Grhpr、Aldh4a1和Hoga1的染色质重排(图一C)。与对照组小鼠相比,ob/ob肝组织中的Agxt mRNA水平降低了约2倍(图一D),蛋白水平的降低也在肝脏组织的蛋白质印迹(WB)实验(图一E)和免疫组织化学(IHC)实验中得到证实(图一F)。Grhpr、Prodh2、Hoga1的mRNA表达无明显变化,而Hao1 mRNA表达略微下调,Ldha上调了2倍(图一D),表明乙醛酸盐代谢通路基因在NAFLD小鼠肝脏中的表达被改变。另外,研究者还发现了ob/ob肝细胞中Agxt启动子两个区域的甲基化显著增加(图一G)。并且在胰高血糖素的诱导下,对照组小鼠肝脏显示出约11倍的Agxt mRNA上调表达,而ob/ob小鼠仅上调2.9倍(图一H)。在体外培养实验中,ob/ob肝细胞对胰高血糖素刺激诱导的Agxt表达也不敏感(图一I),表明Agxt启动子的高甲基化降低了其对胰高血糖素的刺激应答。
接下来,研究者检测脂肪变性肝细胞体外生成草酸盐的情况,将小鼠原代肝细胞进行体外培养,并在培养基中添加乙醛酸盐(Glx)、羟脯氨酸(Hyp)和乙醇酸盐(Glc),检测草酸盐的释放情况(图二A)。实验发现,ob/ob肝细胞的甘油三酯(TAG)增加(图二B)。当添加的Hyp浓度高于3.16 mM时,ob/ob肝细胞中产生的草酸盐和Glc显著高于对照组细胞(图二C和D)。相比之下,ob/ob肝细胞对外源添加的Glc和Glx的应答与对照组相似(图二C和D)。因此,在脂肪变性肝细胞的Glx代谢途径中,只有Hyp的代谢增加了草酸盐的释放。蛋白检测结果显示,ob/ob肝细胞中的Agxt和Hao1蛋白表达基线水平均低于对照组细胞(图二E和F)。Agxt蛋白仅在对照组细胞的Hyp代谢中表达增加,而在ob/ob肝细胞中没有变化(图二E);相比之下,Hao1蛋白在三种添加物的代谢中都有所增加(图二F)。以上结果表明,脂肪变性肝细胞Agxt的本底蛋白表达水平低,且对Hyp分解代谢的反应性降低。另外,在底物存在的情况下Hao1蛋白表达增强,二者可能协同导致产生过多的草酸盐。
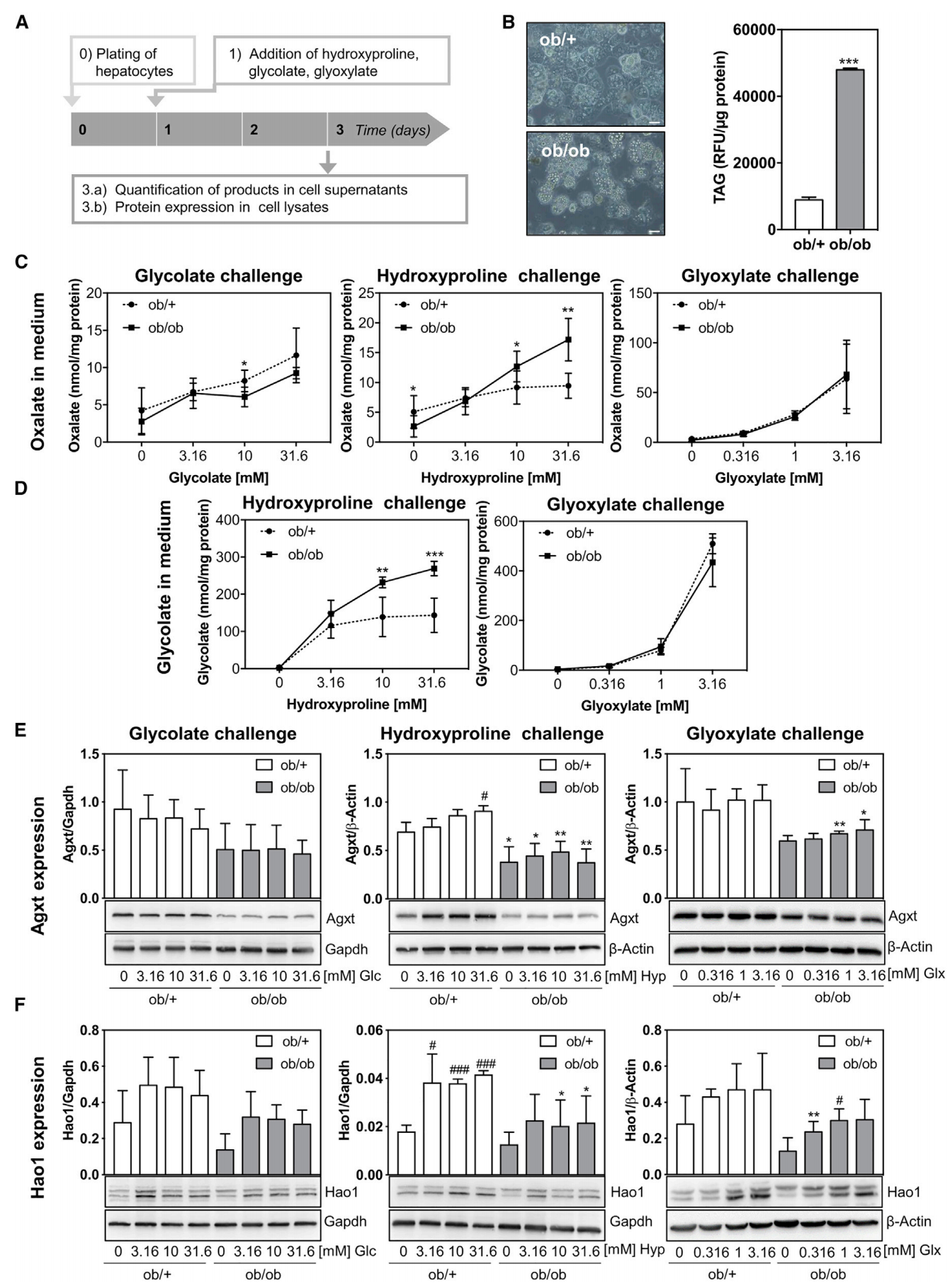
图二 体外脂肪变性肝细胞的Hyp分解代谢产生更多草酸盐[4]
进而,研究者在另一种NAFLD小鼠模型上进行验证,将西方饮食(WD)和正常饮食(NCD)喂养的小鼠进行比较分析。WD喂养6周后,小鼠体重显著增加,表现为轻度脂肪变性,此时肝脏的Agxt表达显著降低,而Ldha显著增加(图三A)。WD喂养30周后,Agxt表达降低更加明显,同时伴随着Hao1和Hoga1的下调表达(图三B)。WB和IHC实验也证实了WD喂养后小鼠肝组织中Agxt蛋白水平的降低(图三C和D)。分离培养WD喂养6周的小鼠原代肝细胞,发现Agxt启动子区域的甲基化增加(图三E);TAG水平显著上调(图三F);对Glc、Hyp和Glx的代谢响应也与ob/ob小鼠的体外肝细胞培养结果相似(图三G和H),再次证实了NAFLD小鼠模型中Hyp分解代谢的异常。
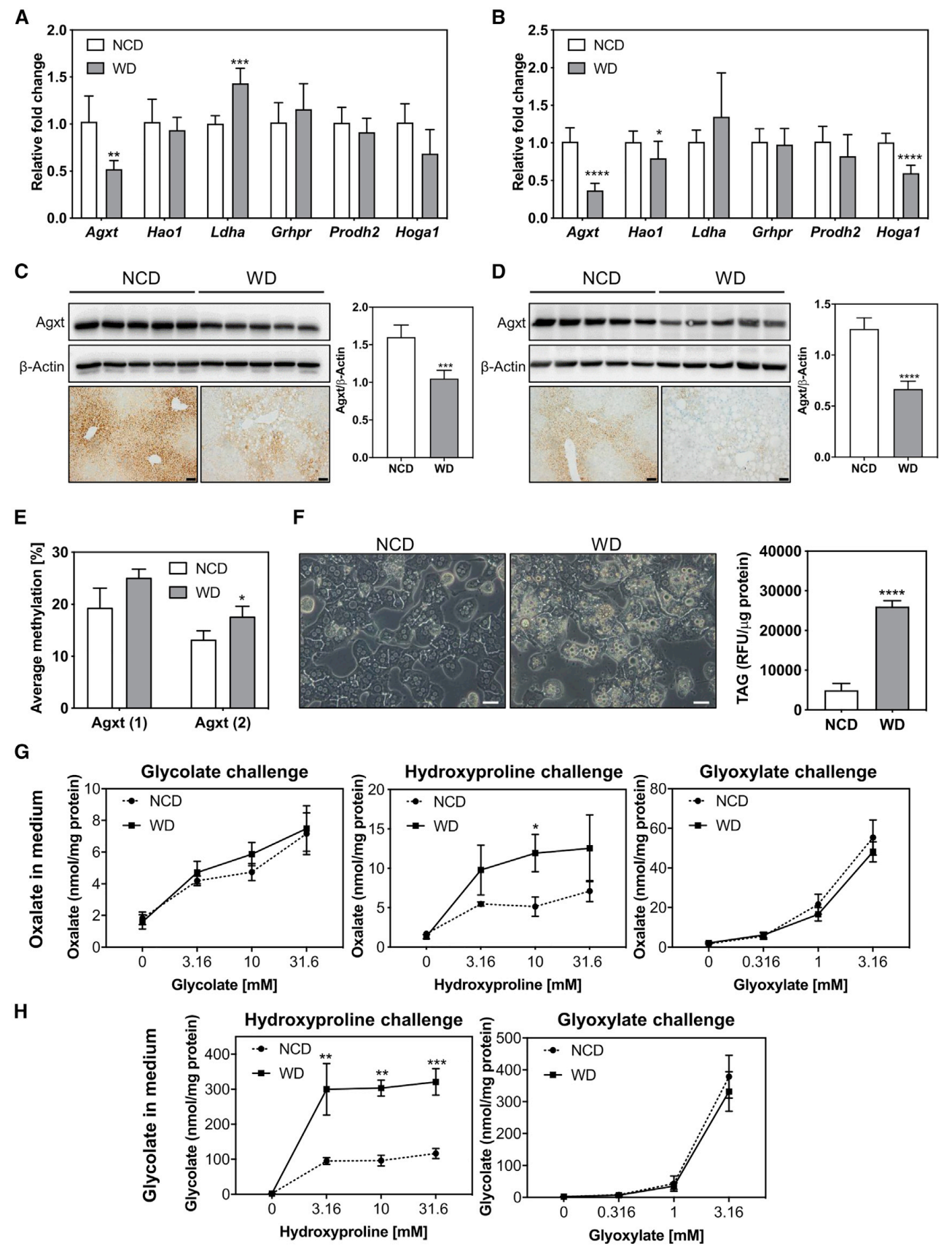
图三 西方饮食喂养的NAFLD小鼠证实了Hyp分解代谢的异常[4]
接着,研究者进行体内验证实验,分别给ob/ob小鼠和对照组小鼠喂食NCD或含有1% Hyp的饲料10天,最后检测血浆和尿液中的草酸盐含量(图四A)。从右心室、门静脉(入肝)和肝静脉(出肝)分别进行采血检测草酸盐含量,发现ob/ob小鼠喂食Hyp后,草酸盐在肝静脉以及肝静脉/门静脉血浆中的含量显著增加,而心脏血液中的草酸盐浓度没有变化(图四B)。24小时尿草酸盐排泄量在喂食Hyp后显著增加,且ob/ob小鼠组的增加更为显著(图四C)。另外,研究者将过表达Agxt的AAV递送至小鼠体内,2周后再进行NCD或含有1% Hyp的饲料喂食 2周,最后检测血浆和尿液中的草酸盐含量(图四D)。结果显示,Agxt-AAV的递送可显著减少ob/ob小鼠血浆和尿液中的草酸盐含量(图四E),WB和IHC实验证明了AAV递送后的Agxt恢复表达(图四F和G)。以上数据表明,回补Agxt的表达可改善ob/ob小鼠喂食Hyp后的肝脏草酸盐增加。
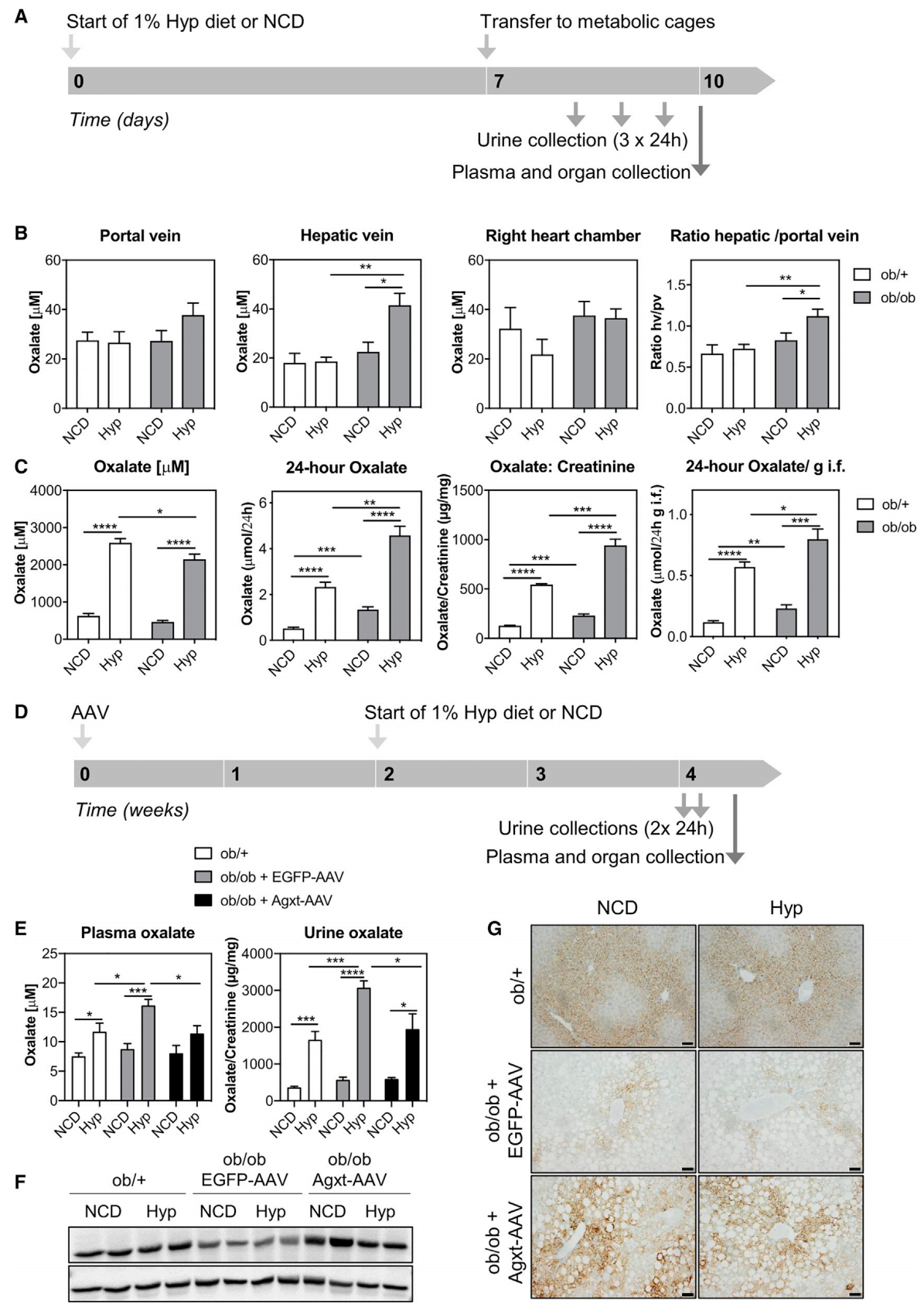
图四 回补Agxt表达可改善喂食Hyp的ob/ob小鼠肝脏草酸盐的增加[4]
最后,研究者从患有脂肪变性或正常的17名男性中分离得到原代肝细胞,经分析发现TAG含量与AGXT mRNA表达呈负相关,且与AGXT启动子的甲基化水平成正相关(图五A);TAG含量越高,AGXT表达则越低(图五B),反之AGXT启动子的DNA甲基化水平则越高(图五C)。供体的肝组织IHC实验显示,与中心周围标记物谷氨酰胺合成酶(GS)不同,AGXT在肝脏所有区域都有表达,且在脂肪变性肝细胞的表达较低(图五D)。研究者还分析了人类参与Glx代谢的关键基因(图五E),发现除AGXT外,GRHPR和HOGA1 mRNA在高TAG含量的肝细胞中表达显著降低(图五F),表明NAFLD患者中涉及了更为复杂的Glx代谢通路改变。研究者在肥胖儿童和青少年患者中分析NAFLD与草酸盐排泄量之间的关系,发现脂肪变性率与尿液草酸盐/肌酐呈正相关(图五G)。在体外人原代肝细胞培养实验中,在添加Glc和Glx时,草酸盐水平显著增加;而添加Hyp时,只有Glc水平显著增加,草酸盐水平无变化(图五H),表明在人原代肝细胞中,与过氧化物酶体的Glc氧化反应相比,线粒体的Hyp分解代谢对肝草酸盐的贡献似乎没那么重要。
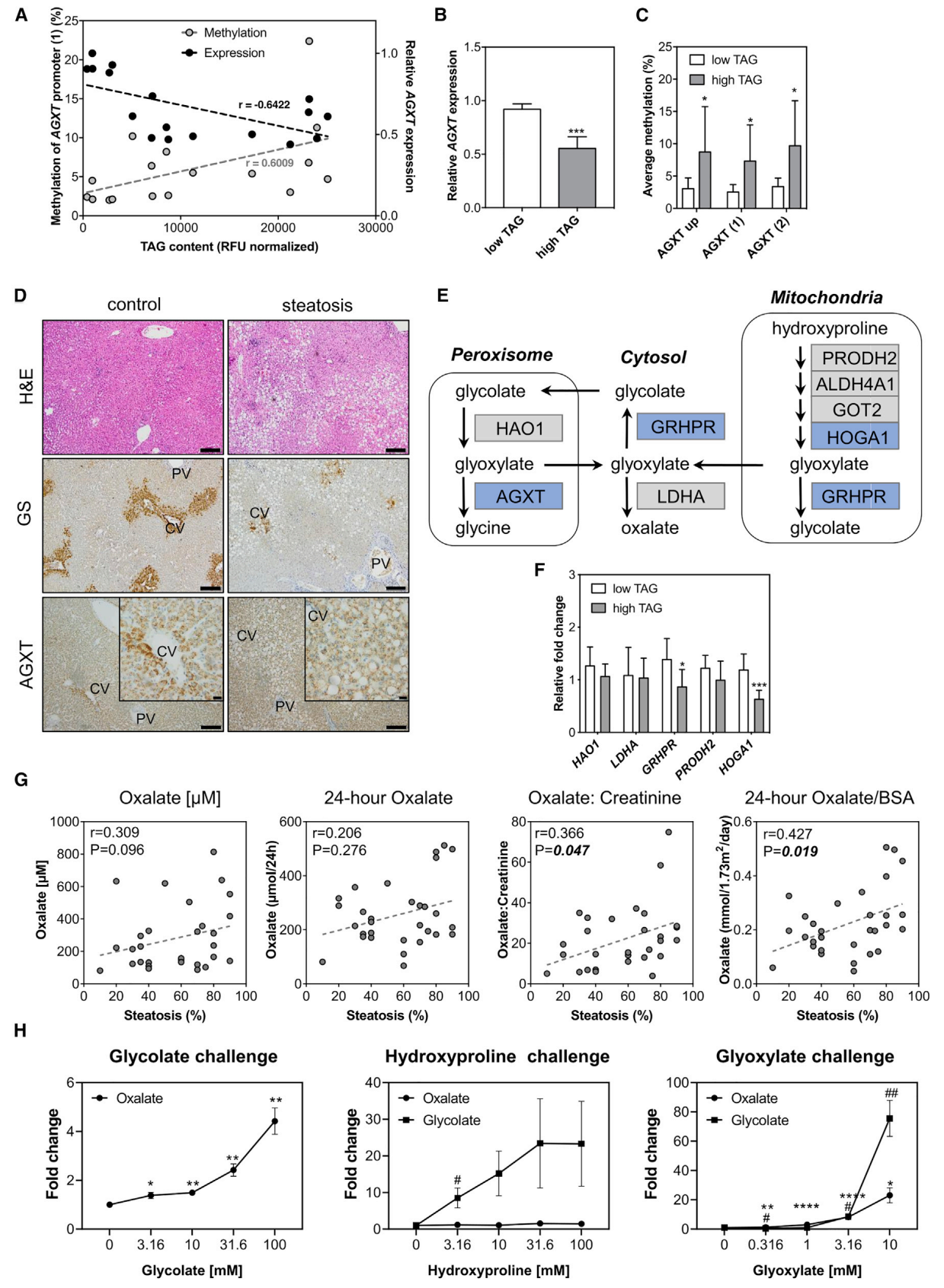
图五 Glx代谢基因和尿草酸盐排泄的改变与NAFLD患者的肝脏脂质含量呈相关性[4]
综上所述,研究者在NAFLD小鼠模型和NAFLD患者中,发现了肝脏Glx代谢通路中AGXT的蛋白表达下调与启动子高甲基化,造成了脂肪变性的肝细胞释放出更多的草酸盐,进而可能导致肝外并发症肾结石。该研究为NAFLD增加肝外并发症肾结石的风险提供了一种疾病分子机制,也提示NAFLD患者需要注意Glx及其前体的饮食摄入,以避免高草酸尿症。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Wainwright P, Byrne CD. Bidirectional Relationships and Disconnects between NAFLD and Features of the Metabolic Syndrome. Int J Mol Sci 2016, 17(3).
2. Qin SY, Wang S, Wang X, Wang JB. Non-alcoholic fatty liver disease and the risk of urolithiasis A systematic review and meta-analysis. Medicine 2018, 97(35).
3. Brzica H, Breljak D, Burckhardt BC, Burckhardt G, Sabolic I. Oxalate: From the Environment to Kidney Stones. Arh Hig Rada Toksiko 2013, 64(4):609-630.
4. Gianmoena K, Gasparoni N, Jashari A, Gabrys P, Grgas K, Ghallab A, Nordstrom K, Gasparoni G, Reinders J, Edlund K et al. Epigenomic and transcriptional profiling identifies impaired glyoxylate detoxification in NAFLD as a risk factor for hyperoxaluria. Cell Rep 2021, 36(8).
5. Anstee QM, Goldin RD. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research. Int J Exp Pathol 2006, 87(1):1-16.
6. Salido EC, Li XM, Lu Y, Wang X, Santana A, Roy-Chowdhury N, Torres A, Shapiro LJ, Roy-Chowdhury J. Alanine-glyoxylate aminotransferase-deficient mice, a model for primary hyperoxaluria that responds to adenoviral gene transfer. Proceedings of the National Academy of Sciences of the United States of America 2006, 103(48):18249-18254.
7. Dutta C, Avitahl-Curtis N, Pursell N, Cohen ML, Holmes B, Diwanji R, Zhou W, Apponi L, Koser M, Ying B et al. Inhibition of Glycolate Oxidase With Dicer-substrate siRNA Reduces Calcium Oxalate Deposition in a Mouse Model of Primary Hyperoxaluria Type 1. Mol Ther 2016, 24(4):770-778.
8. Jiang JQ, Johnson LC, Knight J, Callahan MF, Riedel TJ, Holmes RP, Lowther WT. Metabolism of [C-13(5)] hydroxyproline in vitro and in vivo: implications for primary hyperoxaluria. Am J Physiol-Gastr L 2012, 302(6):G637-G643.



