技术分享:杂交ssDNA修复模板与小分子联合使用可提高原代细胞的基因敲入效率
CRISPR/Cas系统已成为一种功能强大的基因组编辑工具。基于CRISPR/Cas系统的细胞疗法已在临床应用中通过同源定向修复(HDR)引入Cas9介导的基因敲入,纠正致病突变或者插入新的治疗基因。通常HDR模板(HDRT)可以使用不同方法进行递送,包括重组腺相关病毒(rAAV)转导和电转不同形式DNA如dsDNA、ssDNA、环形或线性DNA[1, 2]等。而HDR效率和细胞毒性随着HDRT的浓度与形式而变化。基于rAAV的方法虽然可递送大片段HDRT,细胞毒性小,基因敲入效率显著[3, 4],但是生产成本高,工艺复杂,使其临床应用受到一定的限制[5, 6]。相比非病毒的DNA递送的生产工艺简单,开发成本低,时间短,也已应用于多种原代细胞类型。然而,大片段HDRT 的DNA递送还需要进一步降低DNA毒性、提高敲入效率和增加细胞产量,才能更好地推进其临床应用[2, 7]。
研究者先前已开发了一种方法,通过在dsDNA HDRT的两端加入Cas9靶序列(CTS),后者包括gRNA 靶序列和NGG原间隔序列临近基序(PAM),使得核糖核蛋白复合物(RNP)能够结合在HDRT的两端,促进dsDNA HDRT递送,进而增强基因敲入效率,但是细胞毒性也随之增加[2]。与dsDNA相比,ssDNA具有较低的毒性[7],若能与CTS相结合,将有望进一步解决大片段HDRT的DNA递送问题。
2022年8月,Nature Biotechnology杂志上在线报道了一种由ssDNA及两端含有Cas9靶序列(CTS)的HDRT,称为ssCTS模板,可显著提高HDR敲入效率以及敲入细胞量,适用于多种靶位点和不同原代细胞,效率高达80–90%。同时使用可增强HDR的小分子抑制剂,可以进一步提高ssCTS模板的敲入效率约2-3倍。利用ssCTS模板和小分子的联合使用,研究者高效实现多个致病基因的基因替换,以及低成本的CAR-T细胞生产[8]。
首先,研究者筛选了多种由ssDNA以及两端包含CTS位点的小dsDNA组成的ssCTS杂交结构,其中小dsDNA可通过发夹环、退火的互补寡核苷酸或者更复杂的二级结构来形成(图一a和b);并先设计了短的ssCTS来进行快速打靶筛选,这些不同杂交结构的113-195 nt ssCTS成功敲入后使得原代T细胞表达CD5-HA融合蛋白。经流式检测,大多数形式的ssCTS模板均可增强敲入效率(图一c),其中通过退火互补寡核苷酸在ssDNA 5′ 端和3′ 端形成CTS位点的结构(图一b,“j”)显示出最高的敲入效率(图一b和c)和较低的细胞毒性。基于此结构,研究者进而构建了较长的1500-2923 nt ssCTS模板,分别在IL2RA位点上敲入tNGFR和IL2RA-GFP,以及在TRAC位点上敲入BCMA-CAR(图一d-f)。结果显示,CTS位点的添加均可增强不同浓度dsDNA和ssDNA HDRT的基因敲入效率,但是当到达毒性剂量后敲入效率逐渐降低;与dsCTS模板(dsDNA+CTS)相比,ssCTS模板表现出更优的敲入效率和敲入细胞量,在最佳HDRT浓度下产生的敲入细胞量高达7倍(图一d-f)。
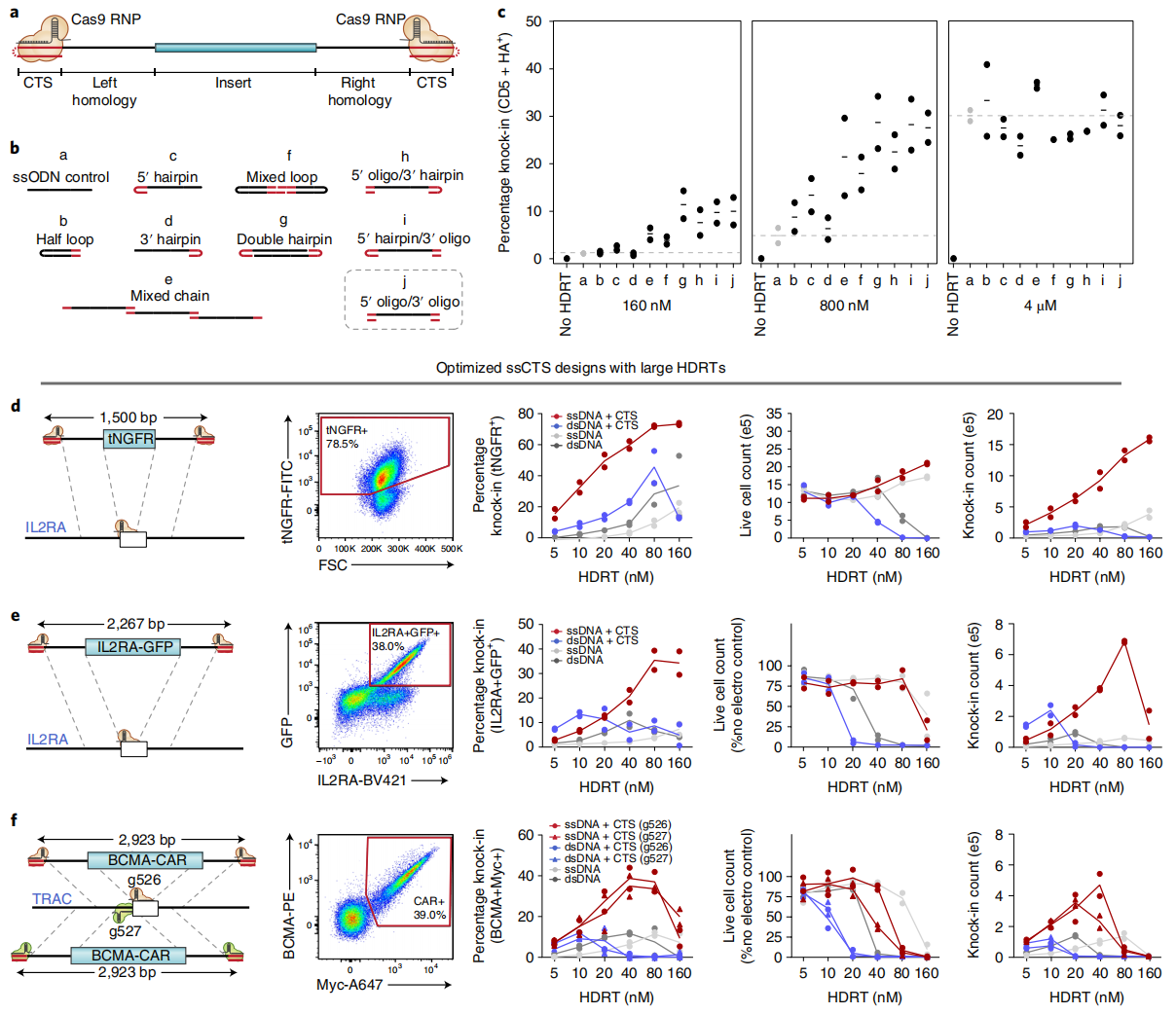
图一 ssCTS模板的设计开发实现高效基因敲入[8]
接下来,研究者利用敲入IL2RA-GFP(图一e)来评估并优化ssCTS变体。其一,测试CTS序列的特异性,发现只有与RNP识别匹配的CTS,即靶位点的CTS序列才能提高敲入效率(图二a)。其二,通过退火不同长度和覆盖率的互补寡核苷酸来确定最佳dsDNA区域,发现当dsDNA序列覆盖于gRNA序列、PAM和CTS位点下游的一小段同源臂时可以提高敲入效率,而gRNA序列上游5′ 端核苷酸则不需要被覆盖(图二b);且在gRNA序列上游5′ 端增加核苷酸反而会降低敲入效率(图二c)。其三,通过在20 bp gRNA识别序列的5′ 端生成具有不同数量错配碱基的CTS位点,进一步测试对gRNA识别的要求。结果显示,当采用野生型和高保真型Cas9时,包含4-8个错配核苷酸gRNA增强敲入效率最为显著(图二d),可能由于这种错配保证了Cas9 RNP的结合但不切割CTS。其四,研究者测试了dsDNA序列需要覆盖下游同源臂的最佳长度,发现当大于20-40 bp的同源臂在相应的寡核苷酸中具有互补序列时具有最佳的敲入效率(图二e)。以上数据确定了最优ssCTS设计方案:在ssDNA的两端包含CTS位点,其中PAM向内靠近同源臂,gRNA序列的5' 端包括4个不匹配的核苷酸,互补寡核苷酸覆盖20 bp的gRNA靶位点、PAM序列和大约20 bp的同源臂序列(图二f)。
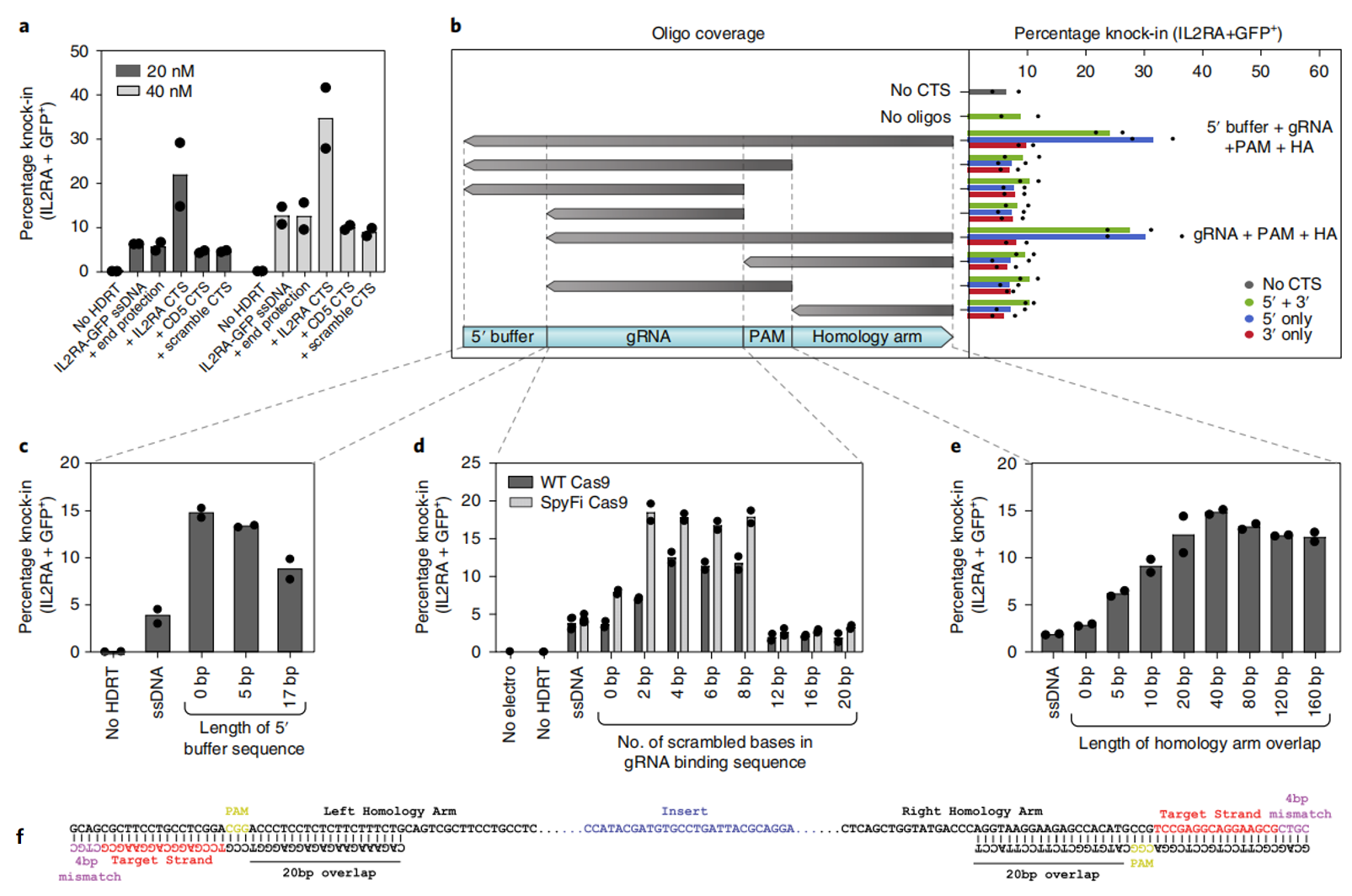
图二 ssCTS设计方案的评估与优化[8]
接着,研究者使用上述最优ssCTS设计方案,测试不同基因组位点、敲入模板和原代造血细胞类型的基因敲入效率。在靶向CLTA位点敲入表达CLTA-mCherry融合蛋白的实验中,发现相比dsCTS,ssCTS模板的使用显著提高了在CD4+ T细胞、CD8+ T细胞、调节性T细胞(Treg)、NK细胞、B细胞、CD34+造血干细胞和γδ T细胞中的敲入效率、活细胞数和敲入细胞数(图三a-c)。在原代T细胞靶向22个基因敲入表达tNGFR的实验中,证明了决大多数ssCTS的敲入效率显著优于其他对照组(图三d)。在靶向TRAC位点敲入表达NY-ESO-1特异性TCR和其他基因的实验中,研究者构建了HDRT文库进行高通量敲入筛选实验。结果显示,与最佳dsCTS浓度相比,ssCTS的敲入效率和敲入细胞量都增加了5倍以上,同时最终敲入细胞中的HDRT文库与质粒文库保持一致(图三e-g)。以上数据表明,ssCTS模板在多种原代细胞的不同基因组位点敲入实验中,均能显著性提高基因敲入效率和敲入细胞产量。
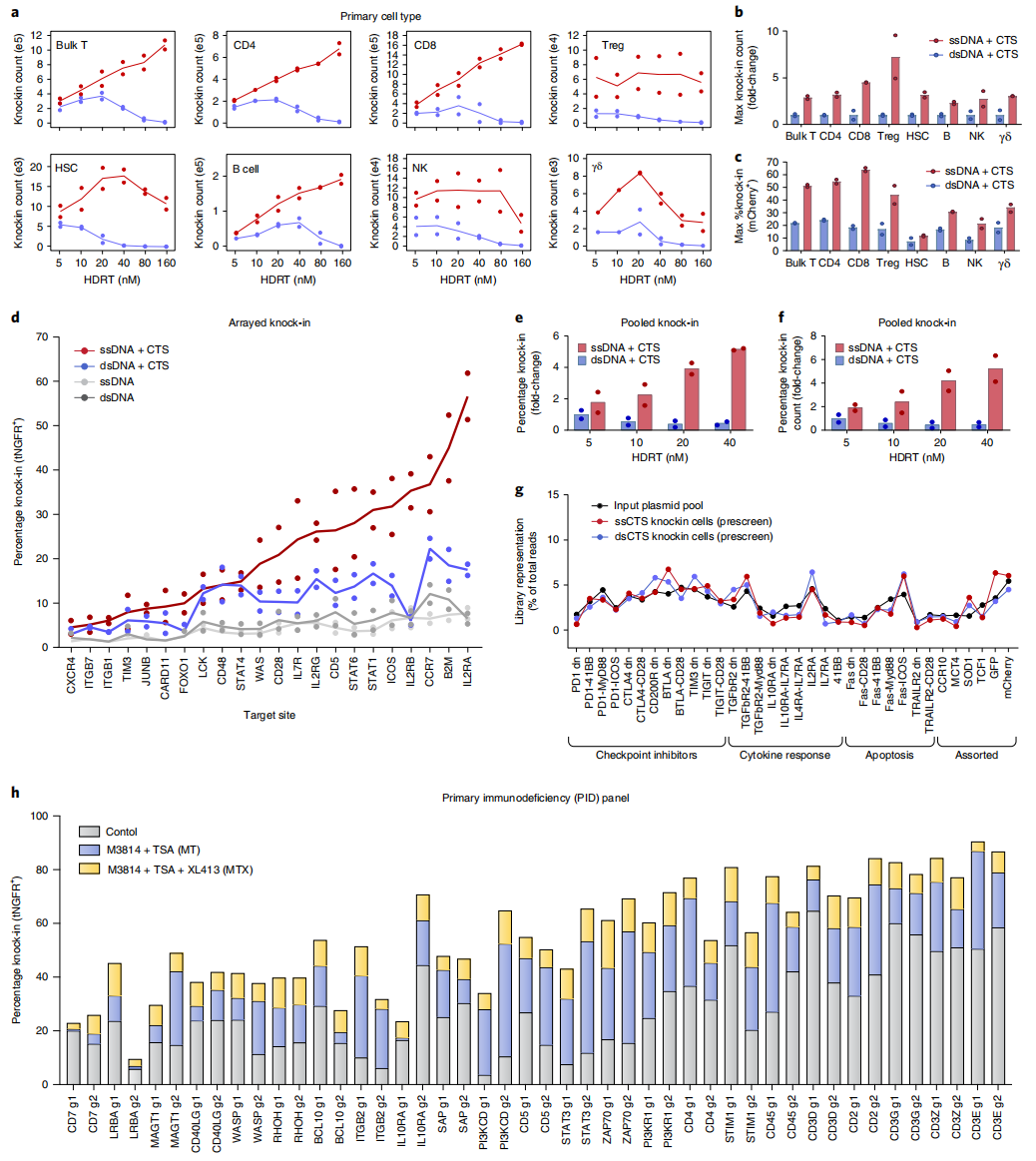
图三 ssCTS模板在不同基因组位点和原代细胞中的应用[8]
先前有研究报道一些小分子抑制剂可以提高人原代T细胞的敲入效率,如DNA依赖蛋白激酶抑制剂NU7441和M3814,组蛋白去乙酰化酶抑制剂TSA,CDC7抑制剂XL413等[9, 10]。因而,研究者测试这些小分子抑制剂能否进一步增强ssCTS模板的敲入效率,分别使用M3814+TSA(MT)和M3814+TSA+XL413(MTX)组合检测了靶向22个基因敲入表达tNGFR的共计44个ssCTS模板。结果显示,MT组合普遍提高了ssCTS模板的敲入效率,而MTX组合还能进一步增强,使得15个基因的敲入效率大于50%,且6个基因达到80%以上(图三h)。以上数据表明,ssCTS和小分子抑制剂的联合使用,可显著增强HDRT敲入效率,有望广泛应用于需要高纯度或高产量敲入细胞的特定疾病靶点治疗。
最后,研究者利用ssCTS模板进行临床应用测试,采用开放阅读框(ORF)替代策略来治疗两个免疫疾病相关基因IL2RA和CTLA4[11]。在IL2RA基因1号外显子处敲入IL2RA基因ORF序列可以补偿IL2RA 11个点突变造成的缺陷(图四a)。ssCTS模板和MTX抑制剂联合使用实现了约2.3 kb全ORF IL2RA-GFP的敲入,效率高达80%(图四b)。进一步对ORF IL2RA-GFP模板进行S166N点突变,该突变消除了IL2RA蛋白表达在细胞膜表面,仅为胞内表达[12]。结果显示,S166N敲入细胞显示出细胞膜表达几乎完全缺失,以及与WT水平相当的胞内表达(图四c);荧光显微镜观察结果显示,相比WT蛋白表达在胞内和细胞表面,S166N突变蛋白只在胞内形成了核周聚集物(图四d)。同样地,研究者检测了CTLA4基因的ORF敲入,结果显示ssCTS模板和MTX抑制剂的联合使用产生了70-80%的敲入效率(图四e和f)。进一步构建R70W、R75W、T124P致病突变体,结果显示,尽管三种突变体在细胞膜表面的蛋白表达水平有些不同,但所有三种突变都显著降低了与配体CD80的结合(图四e,g-i)。以上数据表明,ssCTS模板和MTX抑制剂的联合使用可以应用于临床基因替代治疗和疾病突变体研究。
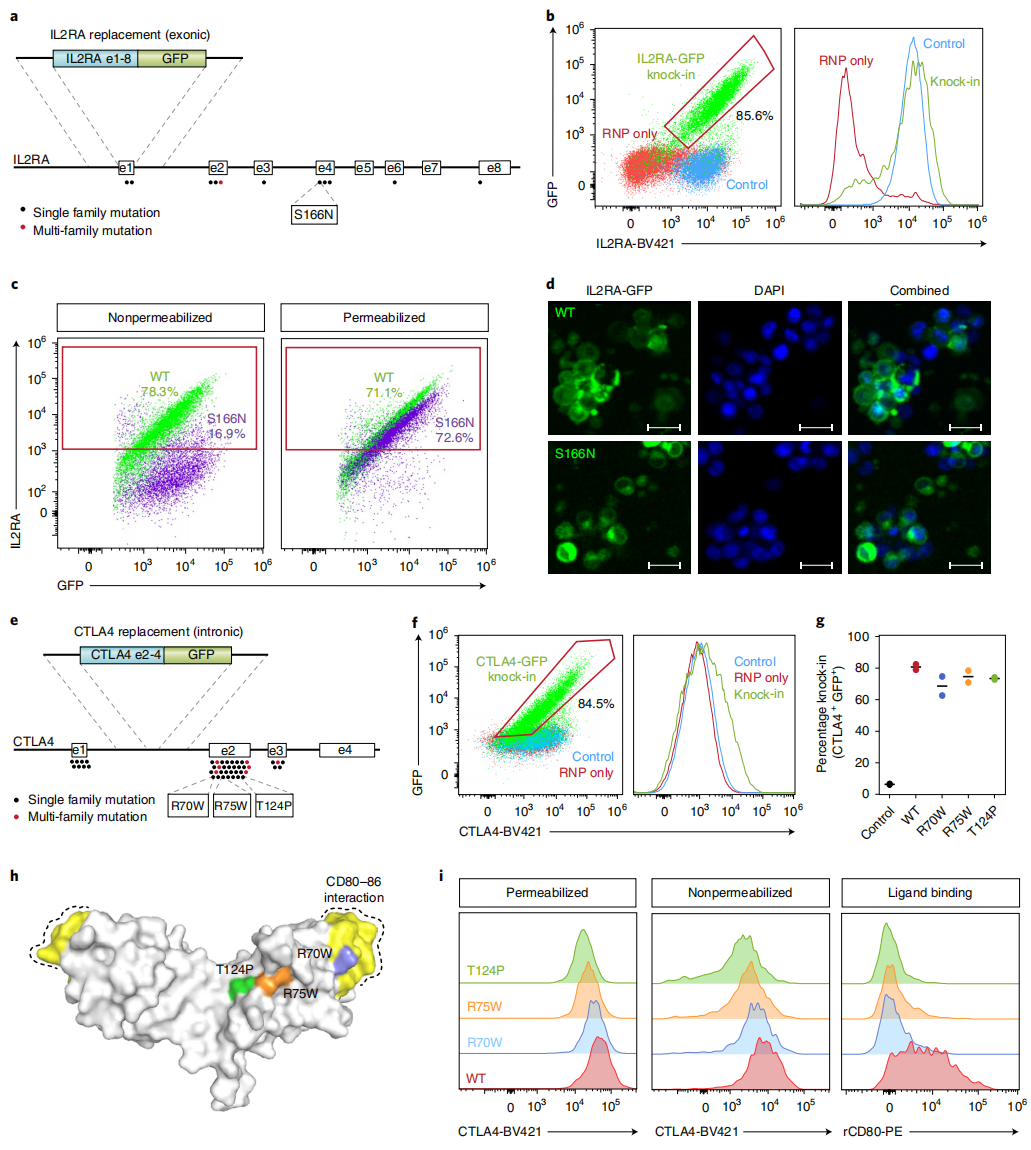
图四 ssCTS模板和小分子联合使用实现基因治疗的高效全ORF替换[8]
此外,研究者将ssCTS模板用于大规模CAR-T细胞生产,得到的细胞数可达到临床患者所需要的剂量范围,并且具有良好的靶细胞杀伤能力。这种完全非病毒的生产工艺,能够用于生产临床规模的位点特异性T细胞工程,未来有望实现完全GMP级的低成本生产。
综上所述,研究者开发的由ssDNA及两端Cas9靶序列(CTS)组成的ssCTS模板,相比上一代dsCTS模板,具有更小的细胞毒性、更优的HDR敲入效率和敲入细胞产量的优点,适用于各种靶位点和不同原代细胞类型;同时添加可增强HDR的小分子抑制剂,还能进一步提高ssCTS模板的敲入效率。该研究证明了这种完全非病毒的ssCTS模板,在简化生产工艺、降低生产成本、保证产品质量上的优势,在基因校正、疾病变异建模和细胞疗法开发等方面具有广泛应用前景。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Eyquem J, Mansilla-Soto J, Giavridis T, van der Stegen SJ, Hamieh M, Cunanan KM, Odak A, Gönen M, Sadelain M. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 2017, 543(7643):113-117.
2. Nguyen DN, Roth TL, Li PJ, Chen PA, Apathy R, Mamedov MR, Vo LT, Tobin VR, Goodman D, Shifrut E et al. Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency. Nat Biotechnol 2020, 38(1):44-49.
3. Feucht J, Sun J, Eyquem J, Ho YJ, Zhao Z, Leibold J, Dobrin A, Cabriolu A, Hamieh M, Sadelain M. Calibration of CAR activation potential directs alternative T cell fates and therapeutic potency. Nature medicine 2019, 25(1):82-88.
4. Martin RM, Ikeda K, Cromer MK, Uchida N, Nishimura T, Romano R, Tong AJ, Lemgart VT, Camarena J, Pavel-Dinu M et al. Highly Efficient and Marker-free Genome Editing of Human Pluripotent Stem Cells by CRISPR-Cas9 RNP and AAV6 Donor-Mediated Homologous Recombination. Cell stem cell 2019, 24(5):821-828.e825.
5. Dobrowsky T, Gianni D, Pieracci J, Suh J. AAV manufacturing for clinical use: Insights on current challenges from the upstream process. Curr Opin Biomed Eng 2021, 20.100353.
6. Wright JF. Manufacturing and characterizing AAV-based vectors for use in clinical studies. Gene Ther 2008, 15(11):840-848.
7. Roth TL, Puig-Saus C, Yu R, Shifrut E, Carnevale J, Li PJ, Hiatt J, Saco J, Krystofinski P, Li H et al. Reprogramming human T cell function and specificity with non-viral genome targeting. Nature 2018, 559(7714):405-409.
8. Shy BR, Vykunta VS, Ha A, Talbot A, Roth TL, Nguyen DN, Pfeifer WG, Chen YY, Blaeschke F, Shifrut E et al. High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails. Nature biotechnology 2022.
9. Fu YW, Dai XY, Wang WT, Yang ZX, Zhao JJ, Zhang JP, Wen W, Zhang F, Oberg KC, Zhang L et al. Dynamics and competition of CRISPR-Cas9 ribonucleoproteins and AAV donor-mediated NHEJ, MMEJ and HDR editing. Nucleic acids research 2021, 49(2).
10. Kath J, Du WJ, Pruene A, Braun T, Thommandru B, Turk R, Sturgeon ML, Kurgan GL, Amini L, Stein M et al. Pharmacological interventions enhance virus-free generation of TRAC-replaced CAR T cells. Mol Ther-Meth Clin D 2022, 25:311-330.
11. Jamee M, Zaki-Dizaji M, Lo B, Abolhassani H, Aghamahdi F, Mosavian M, Nademi Z, Mohammadi H, Jadidi-Niaragh F, Rojas M et al. Clinical, Immunological, and Genetic Features in Patients with Immune Dysregulation, Polyendocrinopathy, Enteropathy, X-linked (IPEX) and IPEX-like Syndrome. The journal of allergy and clinical immunology In practice 2020, 8(8):2747-2760 e2747.
12. Goudy K, Aydin D, Barzaghi F, Gambineri E, Vignoli M, Ciullini Mannurita S, Doglioni C, Ponzoni M, Cicalese MP, Assanelli A et al. Human IL2RA null mutation mediates immunodeficiency with lymphoproliferation and autoimmunity. Clinical immunology (Orlando, Fla) 2013, 146(3):248-261.



