技术分享:人工染色体融合小鼠的建立揭示基因组结构的稳健性
罗伯逊(Rb)融合有助于物种核型的多样性。然而,由于缺乏一种简单有效的方法对动物的染色体进行遗传操作,Rb融合是如何发生和推动进化,仍然是未知的。在实验室中重演这一过程将有助于阐明Rb融合在进化中的作用。着丝粒位于异染色质区内,这里富集大量短的DNA串联重复序列,又称为卫星DNA。先前有研究表明,通过Rb融合诱导产生的中着丝粒染色体具有由夹在两个major satellite (MajSat) DNA之间的minor satellite (MinSat) DNA组成的新着丝粒区[1],表明Rb融合断点位于着丝粒区的MinSat序列内。2018年,中国团队已率先利用基于CRISPR-Cas9介导的染色体工程通过头尾融合策略成功融合了16条酵母染色体,产生了具有1或2条染色体的酵母菌株[2]。那么能否通过同样方式在实验室中创建染色体数减少的小鼠,科学家们对此进行了探索性研究。
2022年9月,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)李劲松院士团队在Cell Research上报道了一种由CRISPR-Cas9介导靶向MinSat序列的染色体工程,实现了小鼠染色体的融合改造,并利用类精子干细胞介导半克隆技术成功建立了染色体数减少、具有中着丝粒染色体的小鼠模型[3]。
类精子干细胞是一种仅携带精子基因组的小鼠雄性单倍体胚胎干细胞(AG-haESCs),可先在细胞水平上进行CRISPR-Cas9基因编辑,再通过卵母细胞注射(ICAHCI)一步法获得具有相应遗传特征的半克隆小鼠[4]。因此,类精子干细胞介导的半克隆技术为染色体工程研究提供了强有力的工具。实验室常用小鼠(Mus musculus)的核型为40条染色体,其中除了Y染色体均为端着丝粒染色体,可在长期配繁中保持染色体数目与结构的稳定。小鼠MinSat序列在不同染色体之间高度同源,是由一个120 bp的单元串联重复组成,并特异性位于除Y染色体之外所有染色体的着丝粒区[5]。研究者设计了5个sgRNA,分别靶向小鼠着丝粒MinSat的不同区域(CENsg1-5,图一a),并在类精子干细胞(O48细胞)进行测试,结果显示CENsg1的基因编辑效率最高(图一b),被用于后续的靶向实验。共获得了10株稳定携带19条染色体的ROB-O48细胞系,其中各包含了1条中着丝粒染色体和18条端着丝粒染色体(图一c)。研究者发现Rb融合不影响ROB-O48细胞中单倍体的维持,并且在长期体外培养期间,中着丝粒染色体可以稳定地存在于ROB-O48细胞中。此外,4株ROB-O48细胞和野生型O48细胞的全基因组测序(WGS)显示出正常的核型特征。以上结果表明,CRISPR-Cas9介导的着丝粒MinSat切割可以成功地诱导类精子干细胞中两个端着丝粒染色体之间的头对头融合。
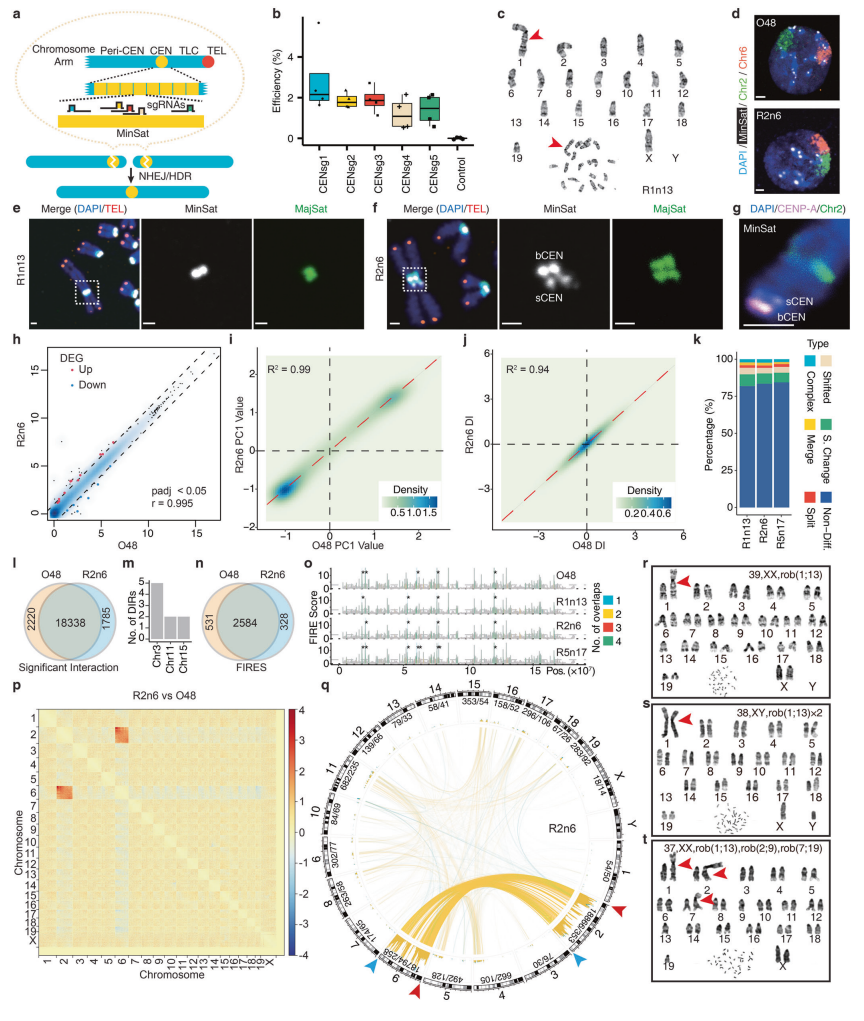
图一 利用类精子干细胞建立人工染色体融合小鼠模型[3]
接下来,研究者对ROB-O48细胞的核型、序列特征等进行多角度分析。经DNA FISH分析表明,野生型O48细胞的Chr2和Chr6分别位于核内的单独空间,但在R2n6(Chr2和Chr6之间的Rb融合)细胞中两条融合染色体之间的距离减小(图一d),并在其他测试的ROB-O48细胞中均观察到类似的结果。在所有ROB-O48细胞中,新着丝粒由夹在MajSat之间的MinSat组成,两条融合染色体之间没有端粒DNA(图一e)。有趣的是,研究者在包含Chr2融合的所有中着丝粒染色体上观察到两个富含MinSat的区域(图一f)。经验证发现,在O48细胞的近端区域中,Chr2确实存在两个着丝粒,包括一个小着丝粒(称为sCEN,与染色体臂紧密相邻,仅富含突变体MinSat)和一个大着丝粒(称为bCEN,被着丝粒周围区域包围,并富含野生型和突变体MinSat)。研究者在着丝粒蛋白A(CENP-A)的基因组C端序列上原位敲入HA标签序列,构建了CENP-A-HAtag细胞用于两个着丝粒的活性分析。结果显示,sCEN仅与CENP-B结合表现为失活状态,而bCEN与CENP-B和CENP-A共定位显示为活性状态(图一g),表明sCEN在进化过程中已失活,不会出现双活性着丝粒导致有丝分裂不稳定的现象[6]。
RNA-seq结果显示,基于多能性相关基因以及所有表达基因,ROB-O48细胞和O48细胞之间存在高度相关性(图一h);仅鉴定出少数差异表达基因(DEG)的表达,且DEG位于融合染色体和未融合染色体,表明Rb融合可能会在融合和未融合的染色体中引入轻微扰动,并且单染色体融合事件对转录组和分化潜能的影响有限。
研究者进一步检测Rb融合诱导的大规模结构重组是否会造成染色质3D结构的改变,通过在3株ROB-O48细胞(R1n13、R2n6和R5n17.1)进行Hi-C实验解析染色体结构[7]。首先,研究者比较了ROB-O48细胞和O48细胞之间的A/B室分布,发现具有惊人的高相似性,并且在ROB-O48细胞中没有发现室重排现象(图一i)。其次,O48细胞中90%以上的拓扑相关结构域(TAD)边界可以在ROB-O48细胞内重复,并且二者TAD边界得分高度相关(图一j);大多数TAD为无差异型(80%以上)和“噪声型”边界变化(图一k)。再次,约87%的显著性染色体之间相互作用可同时在O48和ROB-O48细胞中被检测到(图一l),进一步检测ROB-O48中的差异相互作用区(DIR),发现只有约10个显著的DIR,它们沿着融合和非融合染色体均匀分布(图一m)。最后,在所有样本中都可以观察到大多数检测到的近距离交互热点(FIRE)(图一n)。以上结果表明,Rb融合只会引起全基因组染色体内相互作用的轻微波动。
此外,研究者观察到两个融合的染色体之间,尤其是新融合的着丝粒位点周围的紧密接触(图一p),染色体间相互作用分析发现ROB-O48和O48细胞之间的主要差异在于那两条融合染色体,特别是在着丝粒区域附近(图一q);还观察到Chr2、Chr4、Chr5和Chr11尾部区域相互作用的广泛变化(图一q)。这些数据表明,Rb融合导致融合染色体之间的相互作用增强。
最后,研究者将这些ROB-O48细胞注射到卵母细胞中以获得小鼠,结果显示所有携带19条染色体的ROB-O48细胞都可以获得杂合的具有一条中着丝粒染色体的半克隆小鼠(图一r,图二a和b)。所有半克隆小鼠均为雌性[4],繁殖后可将中着丝粒染色体传递到下一代,获得携带一条中着丝粒染色体的雌性和雄性F1杂合小鼠(图二c)。这些F1杂合小鼠都是可育的,经过繁育最终得到4个纯合小鼠,分别具有一对源自R1n13、R2n6、R2n11和R5n17.1细胞的中着丝粒染色体(图一s,图二d和k)。进一步地,研究者通过在R1n13细胞中进行额外的Rb融合,测试是否可以衍生出具有多条融合染色体的ROB-O48细胞或小鼠,获得了3株具有三条融合染色体的ROB-O48细胞。这些细胞可以产生具有杂合中着丝粒染色体的半克隆小鼠,也可以将融合的染色体传递给下一代(图一t)。以上结果证实,通过CRISPR-Cas9介导类精子干细胞中MinSat序列的切割,可以成功建立具有中着丝粒染色体的小鼠,且存在的单个或多个Rb融合可以稳定地传递给后代。
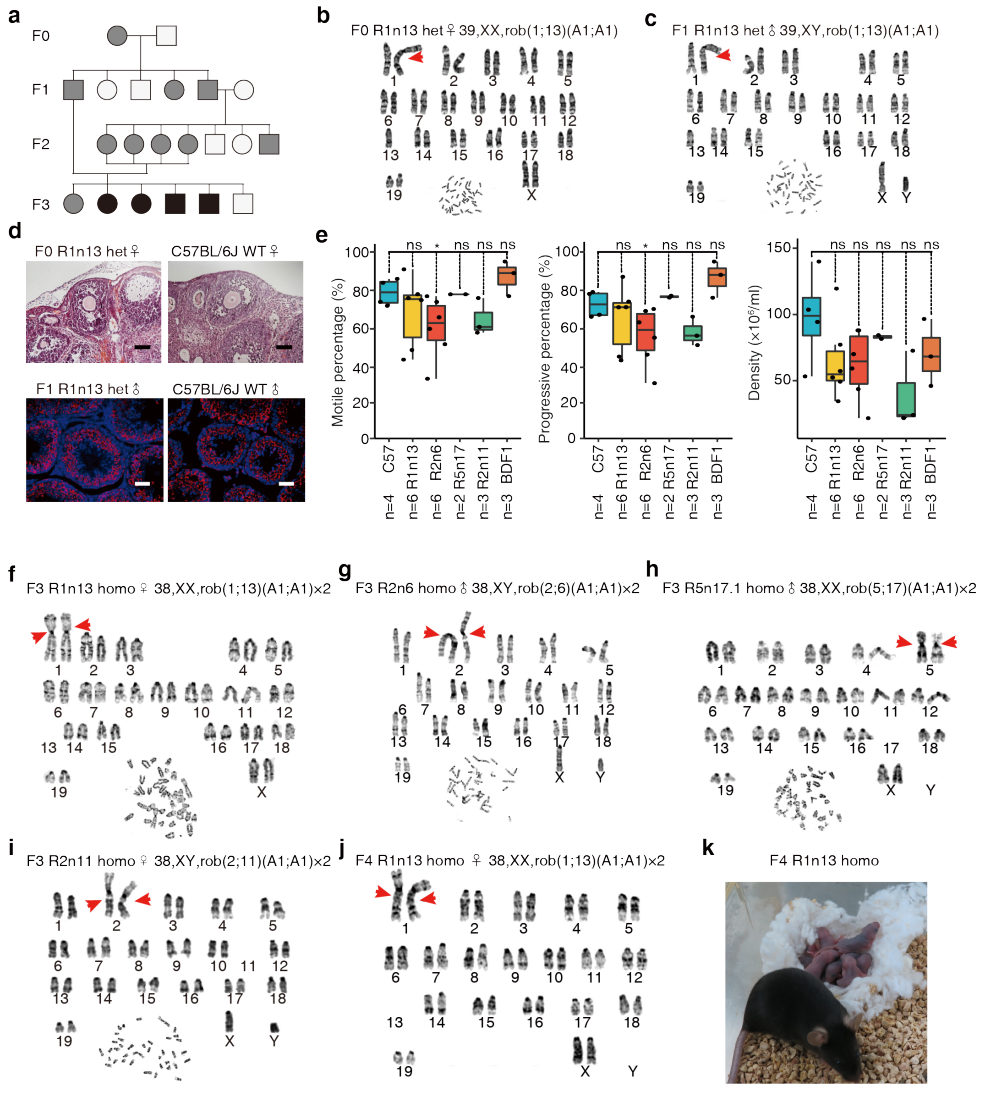
图二 利用ROB-O48细胞产生具有19对染色体的染色体融合小鼠[3]
综上所述,研究者通过CRISPR-Cas9介导靶向MinSat序列的染色体工程,成功地诱导了类精子干细胞中两个端着丝粒染色体之间的头对头融合,实现了小鼠染色体融合改造,成功地建立了具有中着丝粒染色体且可以稳定遗传的小鼠模型。该研究揭示了真核生物基因组结构的稳健性,为哺乳动物进行染色体结构改造、动物新核型亚种创造以及染色体结构变异疾病的模拟提供了可行的技术路线,开启了以小鼠为代表的哺乳动物染色体遗传改造的新领域。

文中涉及的CENP-A-HAtag细胞(图一g)的具体信息,可在GTP研发中心的标签细胞(GTP ID: 20001041)产品列表中进行查询。


GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Garagna S, Zuccotti M, Capanna E, Redi CA. High-resolution organization of mouse telomeric and pericentromeric DNA. Cytogenetic and genome research 2002, 96(1-4):125-129.
2. Shao Y, Lu N, Wu Z, Cai C, Wang S, Zhang LL, Zhou F, Xiao S, Liu L, Zeng X et al. Creating a functional single-chromosome yeast. Nature 2018, 560(7718):331-335.
3. Zhang XM, Yan M, Yang Z, Xiang H, Tang W, Cai X, Wu Q, Liu X, Pei G, Li J. Creation of artificial karyotypes in mice reveals robustness of genome organization. Cell research 2022, 32(11):1026-1029.
4. Zhong C, Yin Q, Xie Z, Bai M, Dong R, Tang W, Xing YH, Zhang H, Yang S, Chen LL et al. CRISPR-Cas9-Mediated Genetic Screening in Mice with Haploid Embryonic Stem Cells Carrying a Guide RNA Library. Cell stem cell 2015, 17(2):221-232.
5. Kalitsis P, Griffiths B, Choo KH. Mouse telocentric sequences reveal a high rate of homogenization and possible role in Robertsonian translocation. Proc Natl Acad Sci U S A 2006, 103(23):8786-8791.
6. Earnshaw WC, Ratrie H, 3rd, Stetten G. Visualization of centromere proteins CENP-B and CENP-C on a stable dicentric chromosome in cytological spreads. Chromosoma 1989, 98(1):1-12.
7. Rao SS, Huntley MH, Durand NC, Stamenova EK, Bochkov ID, Robinson JT, Sanborn AL, Machol I, Omer AD, Lander ES et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell 2014, 159(7):1665-1680.



