技术分享:FXR1通过LLPS激活后期精子细胞中mRNA翻译保障精子形成
哺乳动物的精子形成是一个高度协调的过程,在此过程中,单倍体精子细胞经过时序性形态变化,包括细胞核压缩,鞭毛和顶体的形成,细胞质丢失等,最终形成精子。该分化过程严格受控于一组时空调控基因,统称为精子形成基因。在上述精子细胞发生形变的过程中,细胞核的压缩会导致转录关闭。因此,精子形成基因需要提前转录出mRNA,并在发育过程中以翻译抑制的状态储存于信使核糖核蛋白(mRNP)中,直到特定发育窗口再被激活翻译[1, 2]。这种转录与翻译之间的解偶联是精子形成过程一种重要的基因表达调控机制,但是储存的mRNA是如何在后期精子细胞(LS)中被翻译激活的,目前尚不清楚。
2022年8月,Science发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)刘默芳研究组与国内外多家实验室合作的文章,发现RNA结合蛋白FXR1通过激活后期精子细胞中mRNA翻译,介导精子形成。FXR1在后期精子细胞中高表达,可通过液-液相分离(LLPS)形成FXR1 mRNP颗粒,并招募真核翻译起始因子EIF4G3等翻译机器,将储存的mRNA从翻译抑制状态转换为翻译激活状态,保障精子细胞发育和精子形成[3]。
首先,为了探究后期精子细胞中储存mRNA的翻译激活机制,研究者利用蛋白质组学分析来挖掘小鼠后期精子细胞的潜在翻译调节因子,分别收集出生25天(25 dpp)和35天(35 dpp)小鼠睾丸的多聚核糖体组分(图一A),并鉴定出50个翻译调控相关蛋白质。其中,有12个显著富集于35天小鼠睾丸的多聚核糖体中,包括FXR1(图一B)。蔗糖密度梯度分析表明,相较于25天,FXR1在35天小鼠睾丸中的含量更高,且蛋白翻译抑制剂嘌呤霉素的处理降低了大分子量多聚核糖体组分中的FXR1蛋白含量(图一C)。以上结果表明,FXR1是后期精子细胞的潜在翻译调控因子。
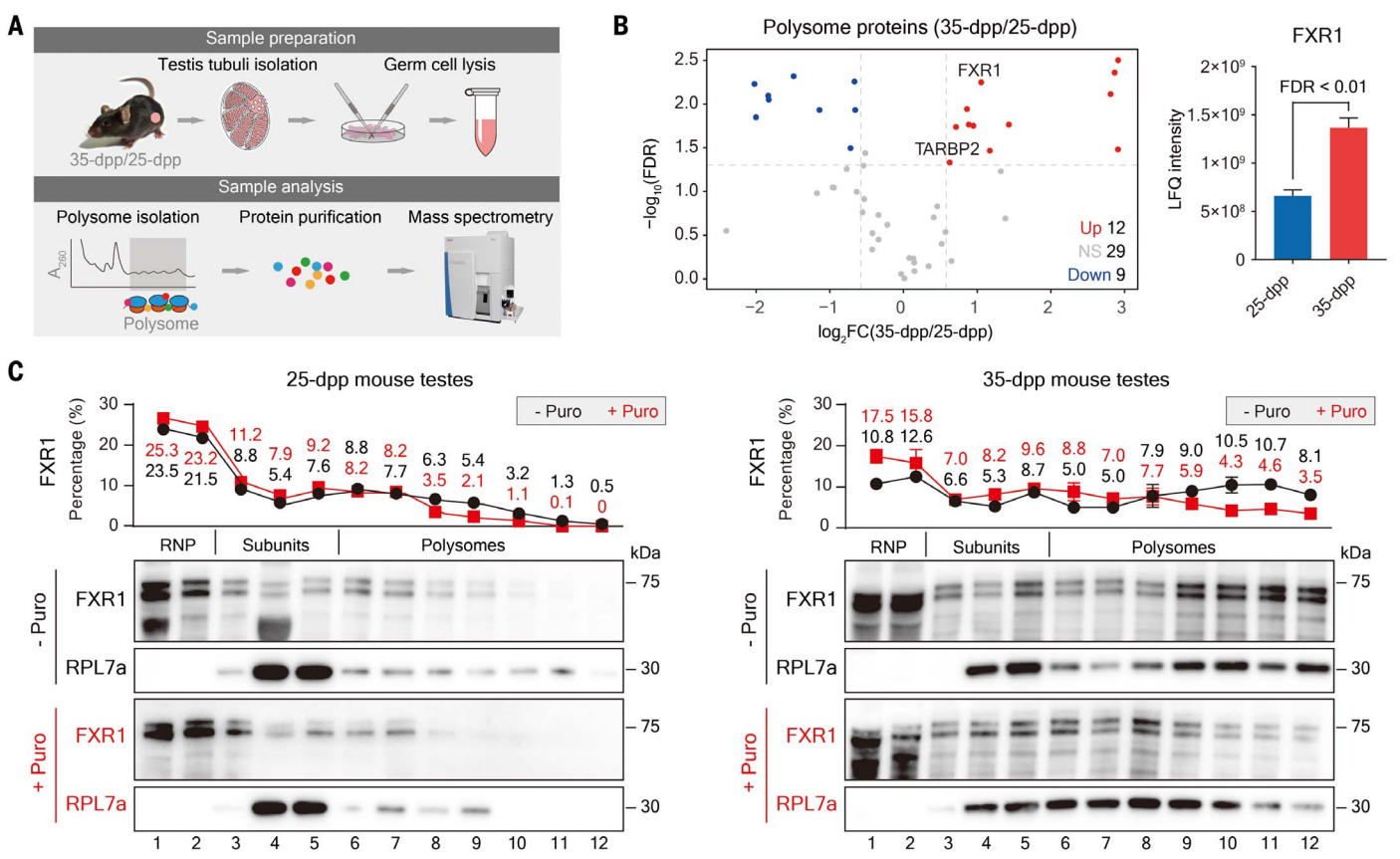
图一 筛选小鼠睾丸中潜在的翻译调控因子[3]
接下来,为了确定FXR1是否参与后期精子细胞中的翻译调控,研究者使用eCLIP-seq共鉴定了4272种FXR1的靶mRNA,并用RIP-qPCR验证了其中7种mRNA在成年小鼠睾丸中(图二A,左)与小鼠睾丸的多聚核糖体中(右)被FXR1显著富集。此外,这些靶mRNA的含量在球形精子细胞(RS)和后期精子细胞中相差不大,但在后期精子细胞中有较高水平的蛋白质表达(图二B),提示它们在雄性生殖细胞的早期已被转录,但在后期精子细胞中才被翻译。睾丸切片的免疫荧光证实了GPD2、AKAP3、HK1和STAT4蛋白主要在后期精子细胞中表达(图二C)。以上结果表明,FXR1参与了精子形成后期的翻译激活。
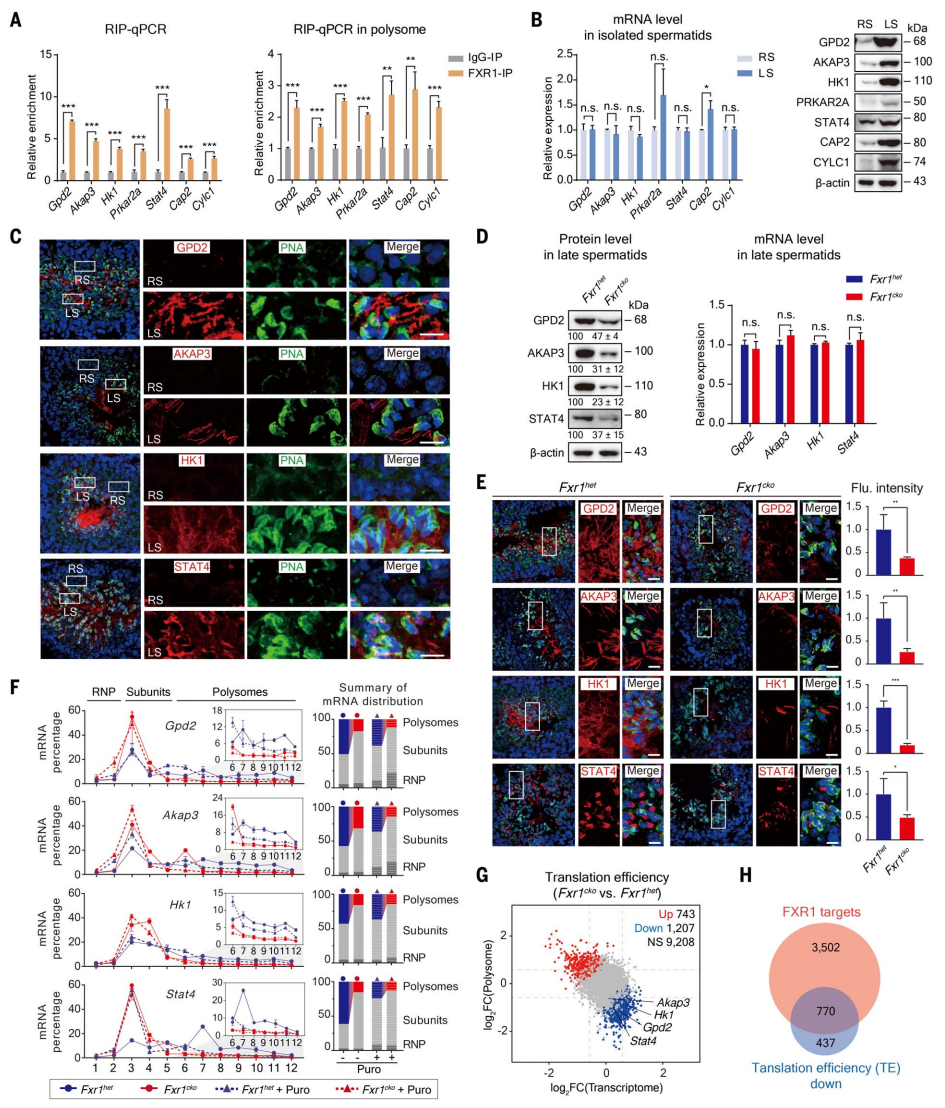
图二 FXR1是小鼠精子形成基因翻译激活所必需的[3]
为了研究FXR1在后期精子细胞翻译激活中的作用,研究者构建了FXR1条件性敲除小鼠(Fxr1cko),发现与对照组Fxr1het小鼠相比,Fxr1cko小鼠后期精子细胞的GPD2、AKAP3、HK1和STAT4蛋白水平降低(图二D左和图二E),但mRNA水平没有改变(图二D右)。蔗糖密度梯度分析也表明,所有测试的靶mRNA在Fxr1cko小鼠多聚核糖体中的含量减少,随之在小分子量的RNP、40S及80S组分中的含量增加(图二F)。对Fxr1cko小鼠进行转录组测序和polysome profiling,发现1207种mRNA的翻译效率显著降低,其中包括前面验证的4个FXR1靶点(图二G)。交叉分析显示,这些在Fxr1cko小鼠中翻译效率降低的mRNA中,有770种与FXR1直接结合(图二H)。结果表明,FXR1参与了部分mRNA的翻译激活。此外,Fxr1cko雄性小鼠不育(图三A),睾丸中的球形精子细胞和延长形精子细胞数量正常,但在曲细精管的第14-16步(第II-VIII阶段)浓缩精细胞的数量减少(图三B和C),与后期精子细胞中检测到的凋亡信号一致(图三D),同时附睾中没有精子存在(图三E)。以上结果表明,FXR1在小鼠精子细胞发育和雄性生殖中发挥重要功能。
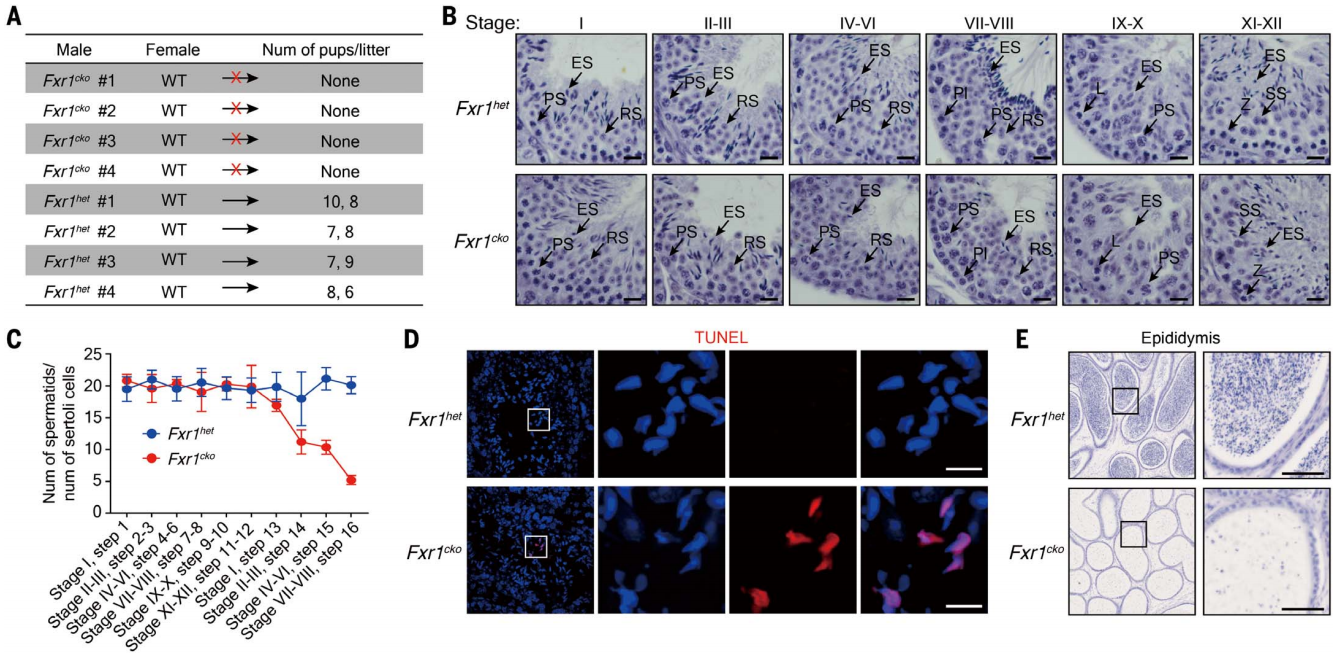
图三 FXR1蛋白缺失导致小鼠雄性不育[3]
接下来,研究者对FXR1介导翻译激活的机制进行研究,利用免疫沉淀(IP)结合质谱分析来寻找潜在辅助因子,发现FXR1与EIF4G3蛋白显著结合,后者已被证明对雄性生育至关重要[4]。在小鼠睾丸组织和293T细胞中的co-IP实验证实了FXR1和EIF4G3之间的相互作用,并且它们的相互作用对RNase A处理具有抵抗力(图四A和B),表明它们之间存在直接的相互作用。EIF4G3 RIP-qPCR实验显示,与对照组相比,Fxr1cko小鼠里所有测试的FXR1激活的靶mRNA都显著减少(图四C),表明EIF4G3与靶mRNA的有效结合需要FXR1。小鼠睾丸co-IP实验显示在精母细胞(SC)和球形精子细胞中都检测到FXR1-EIF4G3相互作用,但在后期精子细胞中更为明显(图四D)。FXR1和EIF4G3主要存在于精母细胞和球形精子细胞的细胞质中,但在后期精子细胞里它们形成大量独特的颗粒且共定位更加显著(图四E)。以上结果表明,FXR1通过招募EIF4G3翻译机器来协调靶mRNA的翻译激活。
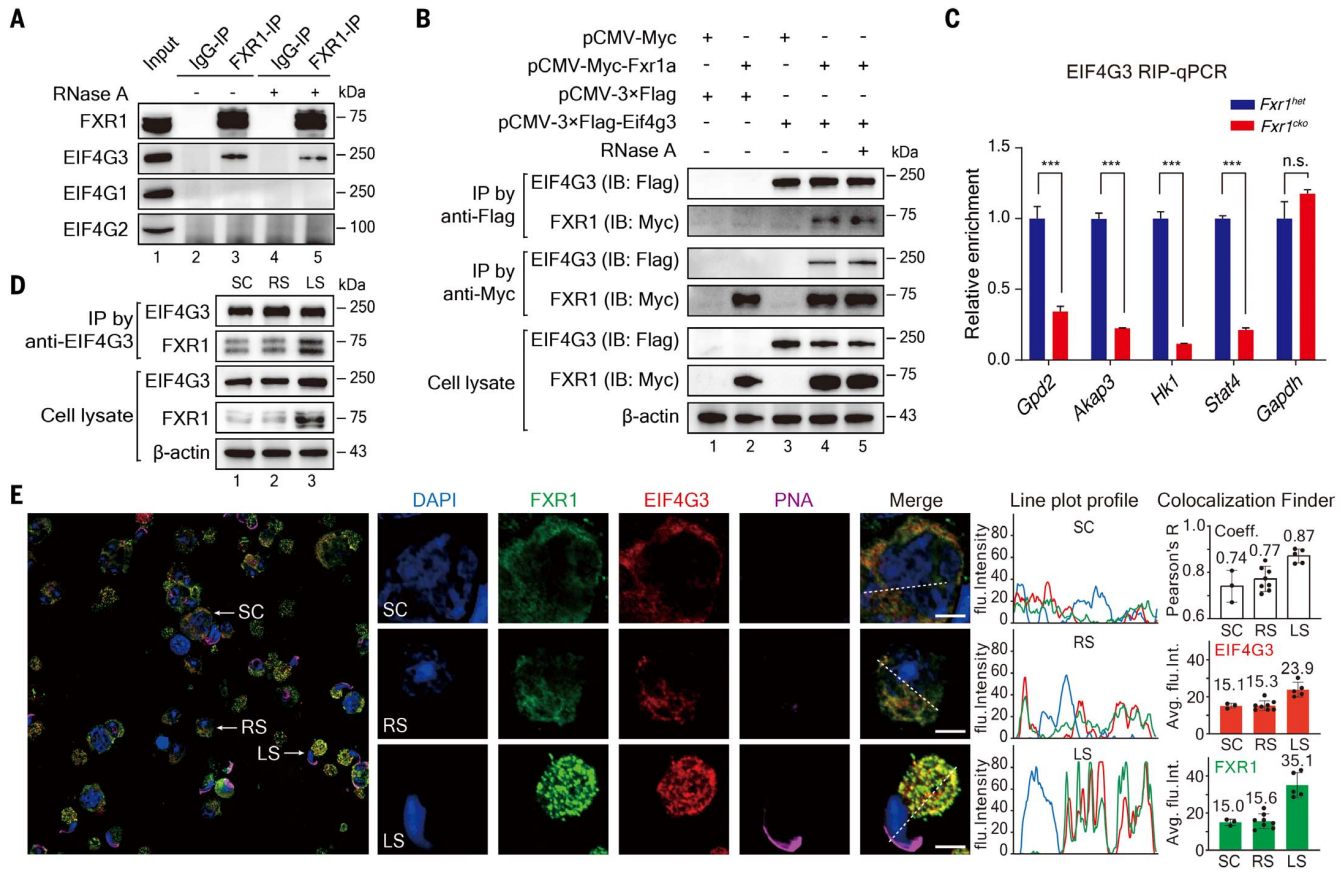
图四 小鼠睾丸中FXR1与EIF4G3的直接相互作用[3]
在后期精子细胞中观察到FXR1颗粒提示其在精子形成的早期和后期具有不同的功能。已有研究表明FXR家族的另一个蛋白FMR1/FMRP,可以通过LLPS形成生物分子颗粒[5],因而推测FXR1在小鼠后期精子细胞中可能具有相分离能力。研究者利用CRISPR-Cas9结合半克隆技术在Fxr1基因组N端原位敲入3xFlag构建Flag-Fxr1小鼠(图五A),发现与对照组7种FXR1蛋白亚型相比,Flag-Fxr1小鼠后期精子细胞中的FXR1a和FXR1d蛋白亚型的表达相对丰富(图五B)。进而在体外实验中证明了FXR1a可形成球形液滴(图五C);荧光漂白恢复技术(FRAP)实验显示,荧光淬灭后的FXR1a液滴可在180秒内恢复荧光(图五D)。此外,在C2C12细胞中,所有FXR1亚型所形成的球形液滴均可出现液滴融合现象(图五E),且FXR1a液滴在120秒内恢复大多数荧光信号(图五F)。将Alexa Fluor 488标记的FXR1a蛋白与Cy3标记的Gpd2 mRNA混合后,发现靶Gpd2 mRNA以剂量依赖的方式促进FXR1a的液滴形成(图五G)。以上结果表明,FXR1可与靶mRNA形成mRNP颗粒。
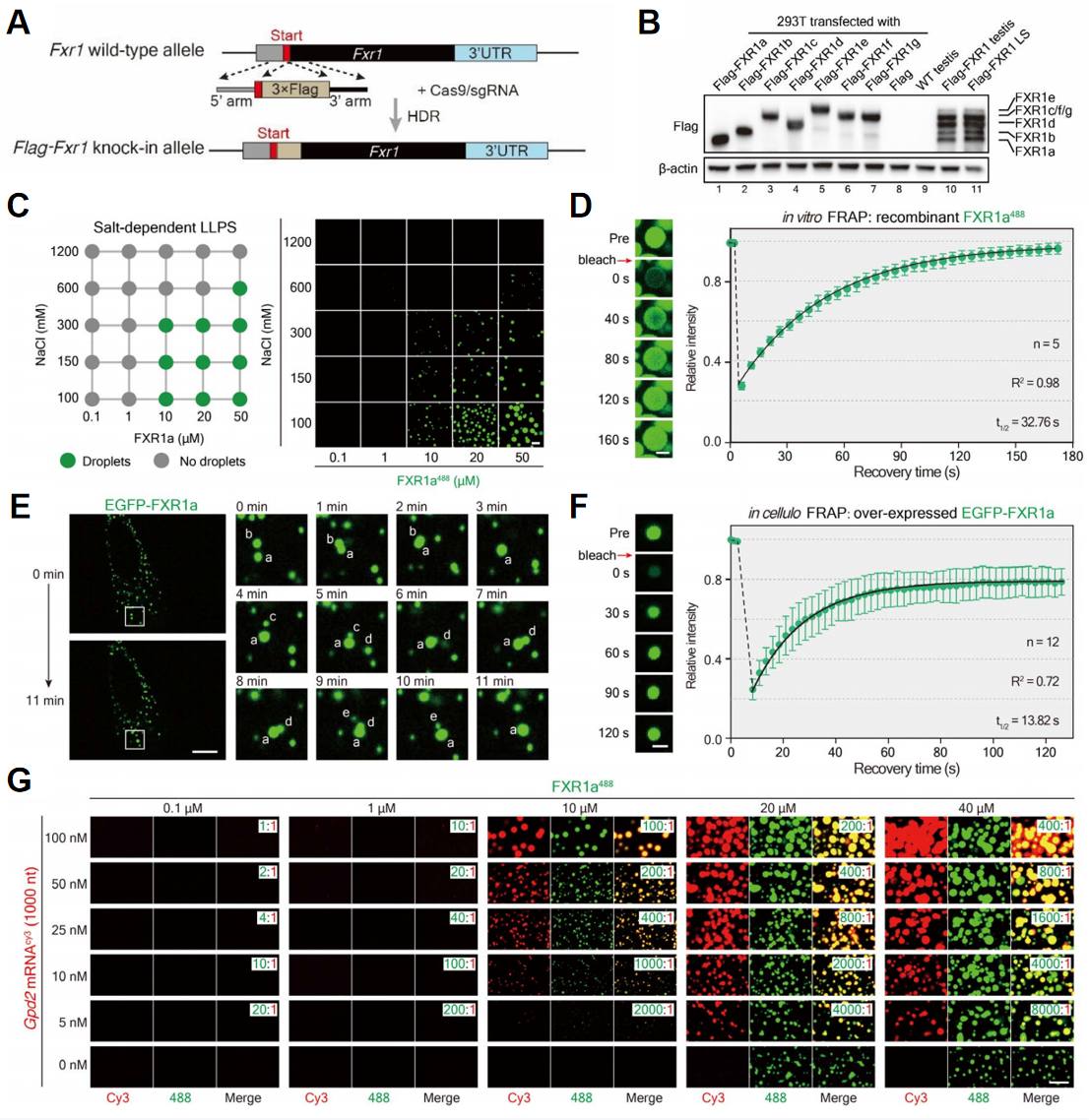
图五 FXR1通过LLPS与其靶mRNA形成mRNP颗粒[3]
接下来,研究者使用可表征RNA翻译状态的TRICK报告系统[6, 7]来验证FXR1颗粒与其靶mRNA翻译激活之间的关系。将NLS-PCP-GFP和NLS-MCP-RFP共转染C2C12细胞,发现细胞核中Gpd2 mRNA显示为双色标记(图六A,I),表明Gpd2 mRNA处于未翻译状态。共转染蓝色荧光蛋白(BFP)标记的FXR1a后,一部分Gpd2 mRNA出现在细胞质的蓝色FXR1a颗粒中,其中Gpd2 mRNA仅被RFP标记而没有被GFP标记(图六A,II);嘌呤霉素处理后导致GFP和RFP标记同时出现在FXR1a颗粒中(图六A,III),表明FXR1a将Gpd2 mRNA招募到FXR1a颗粒中并激活其翻译。而共表达BFP-FXR1aL351P破坏了FXR1a颗粒的形成,虽然它能将Gpd2 mRNA招募到细胞质中,但是在有或无嘌呤霉素处理的情况下都同时被GFP和RFP标记(图六A,IV和V),表明FXR1aL351P虽然可以将Gpd2 mRNA招募到细胞质中,但不能激活其翻译。在FXR1aL351P末端连接FUS蛋白的IDR序列可重建相分离能力,发现共表达FXR1aL351P-IDRFUS融合蛋白可在胞质中形成FXR1a颗粒,并有效激活定位其中的Gpd2mRNA翻译(图六A,VI和VII)。Western blot证实FXR1aL351P丧失了对Gpd2翻译的激活作用,而FXR1aL351P-IDRFUS恢复了GPD2的蛋白表达(图六B)。用FXR1-IRES-Cyto IV-EGFP慢病毒感染FXR1cko小鼠,发现异位表达的野生型FXR1或FXR1L351P-IDRFUS突变体可在后期精子细胞中重建FXR1颗粒(图六C),并且在不改变其mRNA水平的情况下恢复了靶基因的蛋白表达(图六D),进而在小鼠中检测到精子的产生(图六E),这些精子可以在体外与卵母细胞受精产生囊胚(图六F);而FXR1L351P没有上述重建能力。以上结果表明,FXR1的相分离是小鼠精子细胞发育所必需的,FXR1依赖LLPS形成mRNP颗粒,并招募翻译机器来激活其中储存的mRNA进行翻译(图六G)。
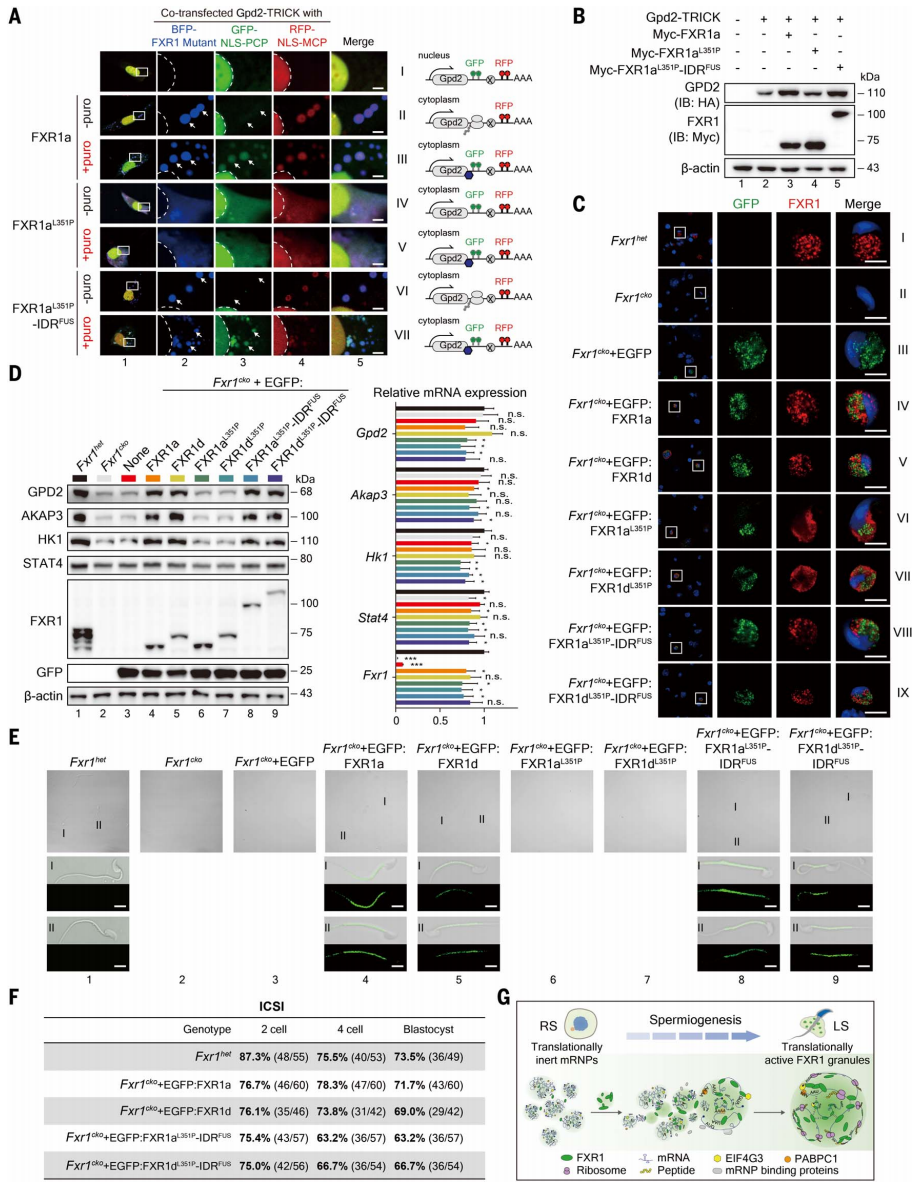
图六 FXR1的相分离能力对于靶mRNA翻译激活及精子形成至关重要[3]
最后,研究者利用CRISPR-Cas9结合半克隆技术构建了Fxr1L351P杂合点突变小鼠(图七A),并与Stra8-Cre介导的生精细胞特异性的Fxr1敲除小鼠杂交后获得Fxr1cki点突变小鼠(图七B)。发现在Fxr1cki小鼠后期精子细胞中FXR1靶mRNA的翻译减少(图七C),Fxr1cki雄性不育(图七D),在第15-16步(第IV-VIII阶段)曲细精管中的浓缩精细胞大量减少,且在后期精子细胞中检测到凋亡信号(图七E-G),附睾中几乎没有精子存在(图七H和I)。以上结果直接证明了FXR1的相分离能力对于精子细胞发育及雄性生殖能力至关重要。
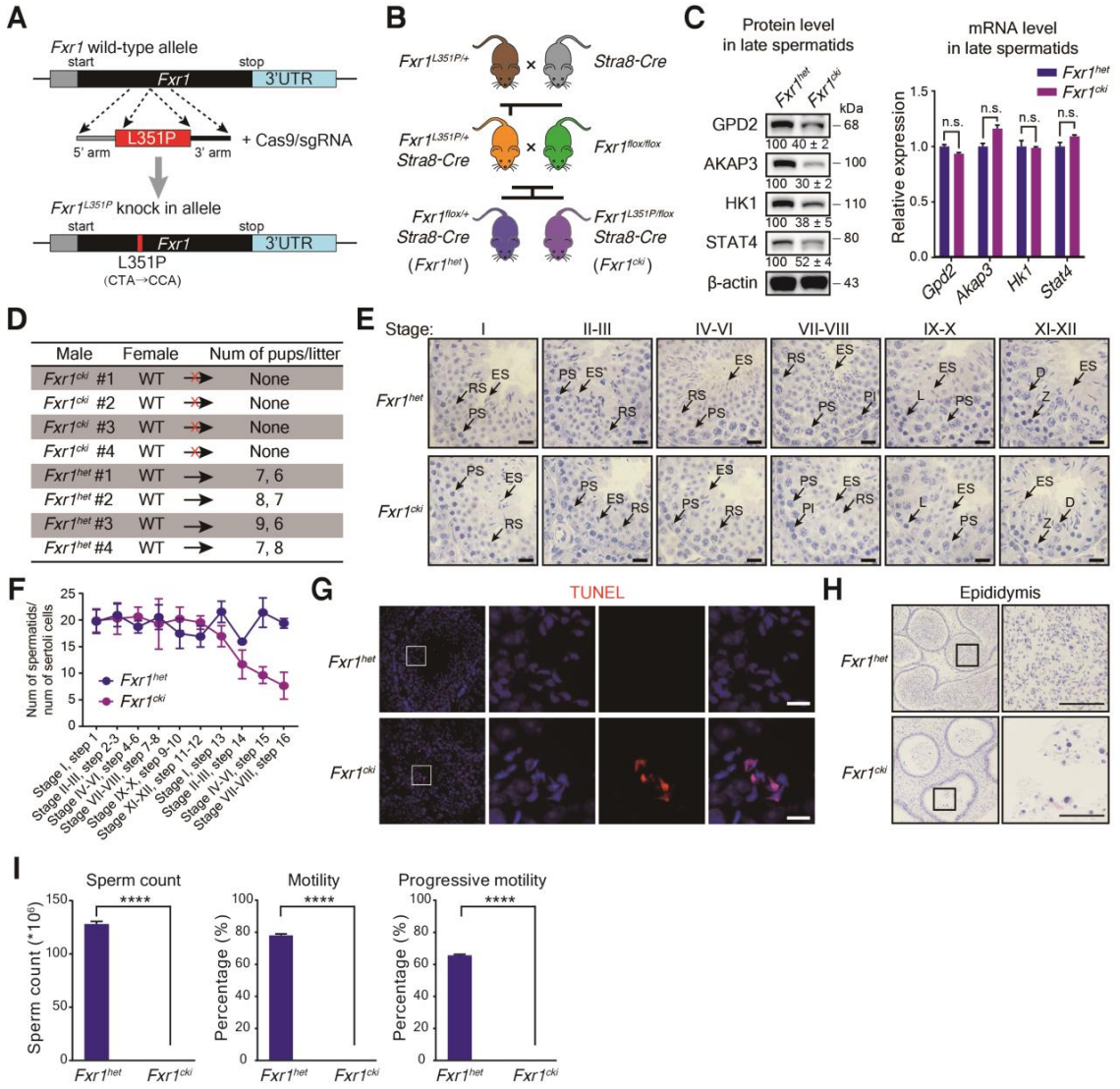
图七 Fxr1cki点突变小鼠的精子细胞发育表征[3]
综上所述,RNA结合蛋白FXR1是一种重要的翻译激活因子,它在小鼠后期精子细胞中高度表达,通过LLPS与靶mRNA形成mRNP颗粒,并招募EIF4G3等翻译机器,激活mRNP颗粒中储存的mRNA翻译,保障精子形成过程的正常进行,对小鼠雄性生殖能力具有重要作用。该研究揭示了FXR1的LLPS能力介导精子形成基因重新激活翻译的机制,为FXR1和LLPS在发育与疾病过程中的重要作用提供了重要理论依据。

文中涉及的Flag-Fxr1小鼠(图五A)和Fxr1L351P杂合点突变小鼠(图七A)的具体信息,可分别在GTP研发中心的标签小鼠(GTP ID: 18000128)和定制服务(GTP ID: G-21000061)版块的产品列表中进行查询。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:JY Kang
新媒体运营:suway
参考文献
1. Sassone-Corsi P. Unique chromatin remodeling and transcriptional regulation in spermatogenesis. Science 2002, 296(5576):2176-2178.
2. Idler RK, Yan W. Control of messenger RNA fate by RNA-binding proteins: an emphasis on mammalian spermatogenesis. Journal of andrology 2012, 33(3):309-337.
3. Kang JY, Wen Z, Pan D, Zhang Y, Li Q, Zhong A, Yu X, Wu YC, Chen Y, Zhang X et al. LLPS of FXR1 drives spermiogenesis by activating translation of stored mRNAs. Science 2022, 377(6607):eabj6647.
4. Sun F, Palmer K, Handel MA. Mutation of Eif4g3, encoding a eukaryotic translation initiation factor, causes male infertility and meiotic arrest of mouse spermatocytes. Development 2010, 137(10):1699-1707.
5. Kim TH, Tsang B, Vernon RM, Sonenberg N, Kay LE, Forman-Kay JD. Phospho-dependent phase separation of FMRP and CAPRIN1 recapitulates regulation of translation and deadenylation. Science 2019, 365(6455):825-829.
6. Halstead JM, Lionnet T, Wilbertz JH, Wippich F, Ephrussi A, Singer RH, Chao JA. Translation. An RNA biosensor for imaging the first round of translation from single cells to living animals. Science 2015, 347(6228):1367-1671.
7. Hocine S, Raymond P, Zenklusen D, Chao JA, Singer RH. Single-molecule analysis of gene expression using two-color RNA labeling in live yeast. Nature methods 2013, 10(2):119-121.



