技术分享:AKG通过Serpina1e信号抑制肝脏糖异生,改善糖尿病的高血糖症
2型糖尿病(T2DM)是一个日益严重的全球性健康问题,主要表现为血糖浓度持续性居于较高水平,从而引起体内代谢紊乱,降低患者的寿命[1]。葡萄糖是维持血糖稳态的生理基础,血糖稳态是由肝脏中的肝糖原合成和各代谢组织中的葡萄糖消耗共同维持的动态稳定过程[2]。有研究表明,通过运动产生的肌源代谢物可以部分改善血糖稳态,提示这些肌源代谢物是T2DM的潜在治疗靶点。α-酮戊二酸(AKG)作为三羧酸循环的中间产物,已被证明在多种生物学过程中起着至关重要的作用[3]。AKG对代谢平衡和血糖稳态具有有益作用,可以通过2-氧戊二酸受体1(OXGR1)依赖的作用方式来增加褐色脂肪组织温度、氧消耗和全身代谢,从而有效防止饮食诱导的肥胖(DIO)[4],还能改善高脂饮食(HFD)小鼠的葡萄糖耐受和胰岛素敏感性[5]。然而,AKG调控血糖稳态的分子机制尚不清楚。
2022年5月,Science Advances上发表文章揭示了AKG作为信号分子抑制肝脏糖异生进而改善T2DM高血糖症的分子机制。具体而言,细胞外的AKG与嘌呤能受体P2RX4结合,激活线粒体膜上转运蛋白SLC25A11介导的内源性AKG转运,随后诱导Serpina1e启动子区的H3K27me3去甲基化,减少肝脏糖异生,降低血糖浓度[6]。
首先,研究者分别验证了小鼠和人血浆中AKG与血糖浓度的关系。实验结果显示,不同群体雄性小鼠血浆中的AKG浓度与糖化血红蛋白HbA1c的浓度呈显著负相关(图一A),其中DIO和db/db(DB)小鼠血浆的AKG水平显著低于对照组小鼠(图一B)。人血浆中AKG浓度与HbA1c水平呈相似的负相关(图一C);并且相反地,AKG相关代谢产物的浓度与HbA1c呈正相关(图一D)。以上数据表明,AKG与血糖浓度存在负相关性,提示其在血糖调控方面具有生理作用。
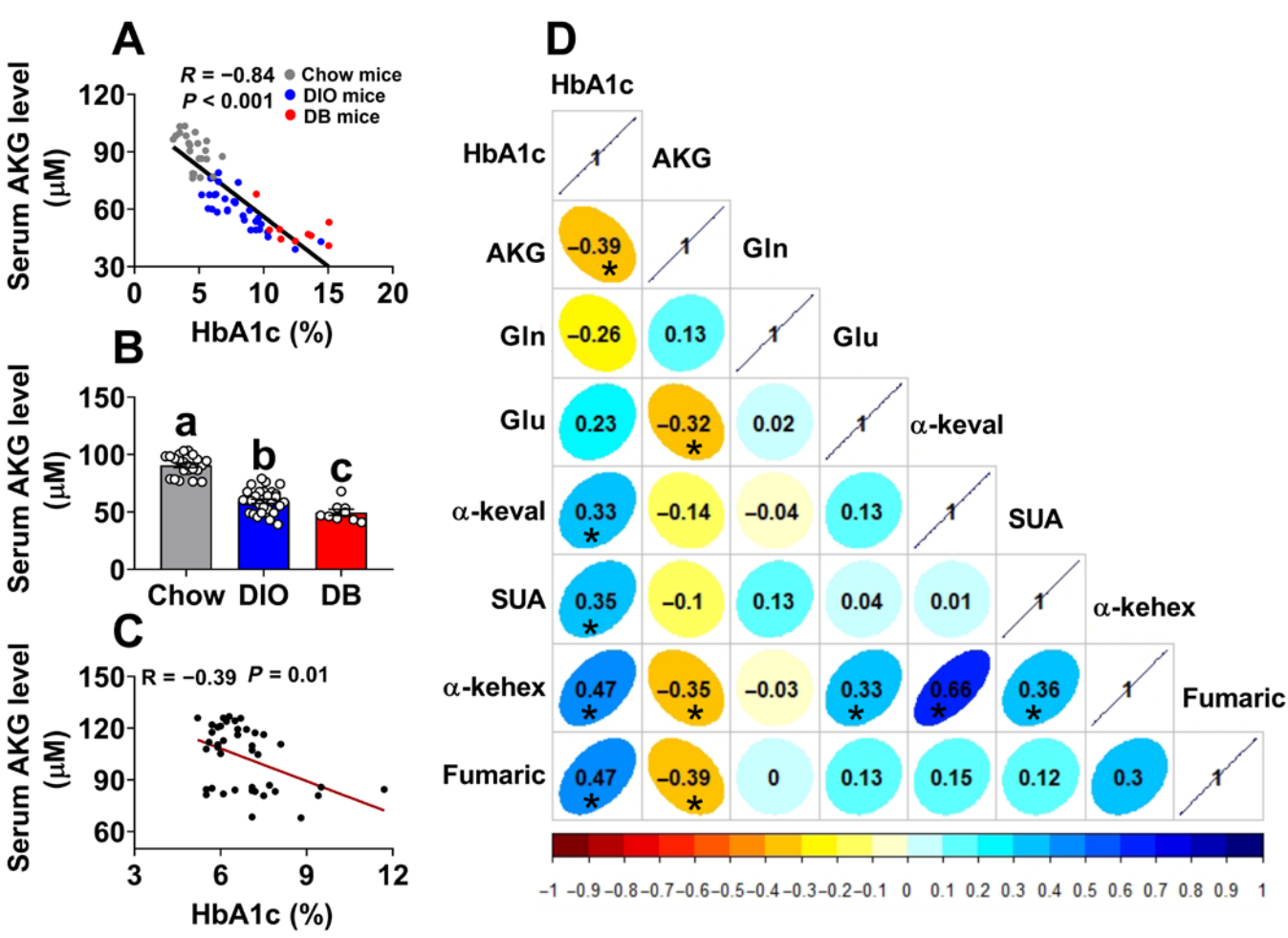
图一 血浆中AKG浓度与HbA1c浓度呈负相关[6]
随后,研究者研究AKG在血糖调控中的作用。分别在正常喂养和HFD喂养的雄性C57BL/6小鼠的饮用水中添加2% AKG,实验结果显示,AKG的慢性补充没有对正常喂养的小鼠血糖浓度造成变化(图二A),但显著降低了HFD小鼠的血糖和HbA1c浓度(图二B和C),显著升高了胰岛素浓度(图二D),但胰高血糖素没有明显变化(图二E)。对血糖稳态进一步表征,发现补充AKG没有改变HFD小鼠的葡萄糖耐受性(图二F),但显著增强了胰岛素耐受性(图二G)和丙酮酸耐受性(图二H),同时发现在丙酮酸处理后,补充AKG的HFD小鼠胰岛素浓度显著增加(图二I)。高胰岛素-正常血糖钳夹实验结果显示补充AKG提高了葡萄糖灌注率(图二J),但是葡萄糖代谢率没有受到影响(图二K),表明AKG显著增强了HFD小鼠的全身胰岛素敏感性。对基础和钳制条件下的内源性葡萄糖生成(EGP,主要是肝糖原合成)进行分析,发现在钳夹条件下,补充AKG可诱导EGP显著下降(图二L)。研究者进一步发现补充AKG显著降低了糖异生相关酶的表达和活性,包括磷酸烯醇丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸酶(G6Pase)和果糖-1,6-双磷酸酶(FBP)(图二M-P)。以上数据表明,慢性补充AKG可以改善肝脏葡萄糖代谢,AKG诱导的血糖浓度降低可能是由于增加胰岛素分泌、提高胰岛素敏感性、抑制葡萄糖来源(糖异生)的共同作用引起的。
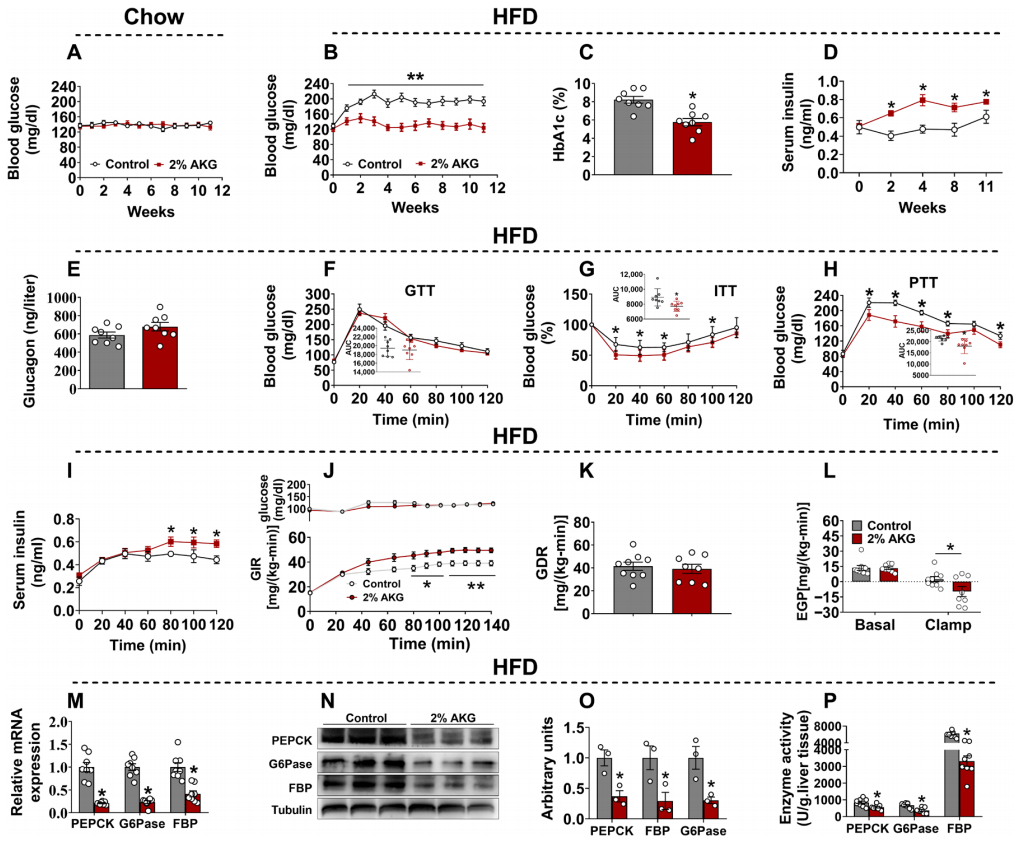
图二 慢性补充AKG可防止饮食引起的高血糖症[6]
接下来,研究者对AKG是否具有直接的降血糖作用进行研究。在体重相似的HFD喂养的雄性C57BL/6小鼠中单次腹腔注射AKG,使得AKG的血浆循环浓度快速增加(图三A),以达到慢性补充2%AKG后的相似水平。实验结果显示,小鼠在注射AKG后1、2和3小时的血糖浓度均显著降低(图三B),注射后2、3小时的胰岛素浓度显著升高(图三C),肝脏糖异生相关酶的mRNA表达、蛋白表达和酶活性均显著降低(图三D,F-H)。采用转录抑制剂放线菌素D与AKG共处理后,发现无法降低糖异生相关酶的mRNA表达(图三E)。以上数据表明,急性AKG处理同慢性补充的结果相似,都是通过刺激胰岛素分泌和抑制肝脏糖异生来介导降血糖作用,且AKG通过转录方式抑制肝脏糖异生。为了确定胰岛素分泌在此过程中的作用,研究者选择1型糖尿病(T1D)小鼠模型进行测试。结果发现,在T1D小鼠本底胰岛素水平很低的条件下(图三I),急性AKG处理同样可通过抑制肝脏糖异生来介导降血糖作用(图三J-M)。
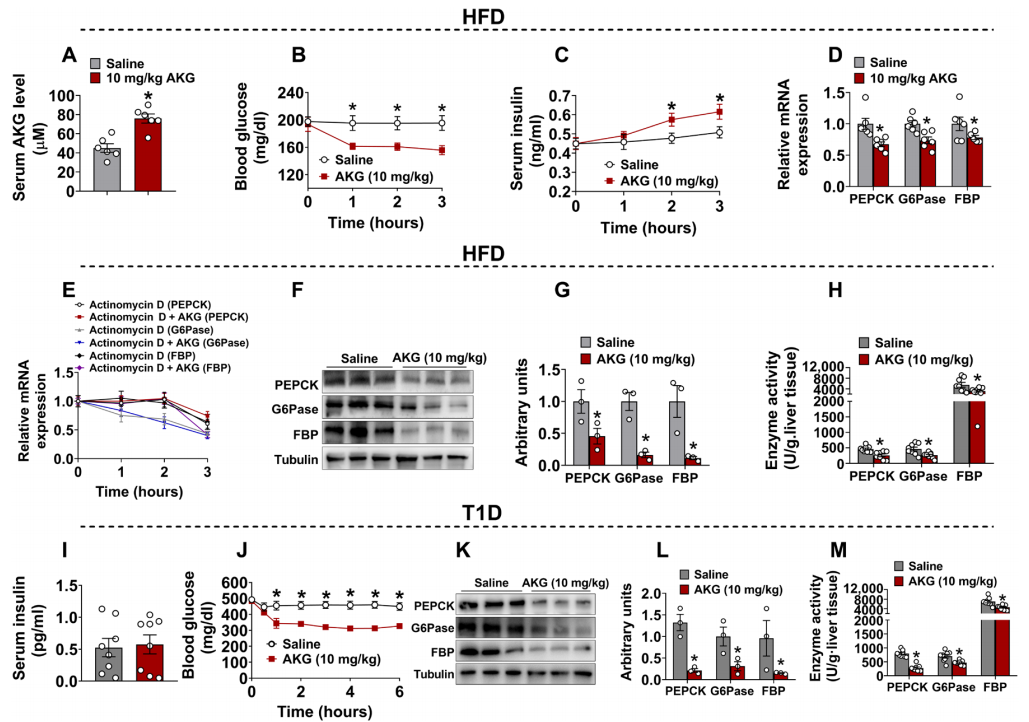
图三 急性AKG处理可防止由饮食和1型糖尿病引起的高血糖症[6]
进而,研究者对AKG抑制肝脏糖异生的作用机制进行研究。通过对慢性补充AKG的DIO小鼠肝脏进行转录组分析,发现许多基因的转录水平发生显著变化(图四A和B)。研究者选择了其中在肝脏中高表达且参与肝脏代谢的基因进行测试,使用siRNA在体外原代肝细胞中分别靶向Serpina1e、Selenbp2、Cyp2c70或Cyp4a12b。结果显示,与对照组相比,仅有通过siRNA敲低Serpina1e的表达(图四C),可显著消除AKG对糖异生相关蛋白酶表达和活性的抑制作用(图四D-F)。此外,研究者还发现DIO和DB小鼠肝脏中的Serpina1e mRNA表达显著低于正常喂养的小鼠(图四G);在长期补充AKG的小鼠中,Serpina1e下游信号的磷酸化FAK和磷酸化AKT的蛋白表达显著增加(图四H和I)。为进一步确定Serpina1e在AKG抑制肝脏糖异生中的作用,研究者将Alb-Cre小鼠与LSL-Cas9-EGFP小鼠杂交获得Alb-Cre/LSL-Cas9-EGFP(Alb-Cas9)小鼠,随后静脉注射携带靶向Serpina1e sgRNA的AAV,建立了Serpina1e肝脏特异性敲除小鼠模型(Alb-Serpina1e−/−)。实验结果显示,与对照组小鼠相比,Alb-Serpina1e−/−小鼠肝脏中Serpina1e mRNA的表达显著降低(图四J);Serpina1e的敲除消除了AKG对血糖浓度(图四K)、丙酮酸耐受性(图四L)以及糖异生相关蛋白酶表达和活性(图四N-P)的抑制作用,但没有消除AKG对胰岛素浓度(图四Q)和胰岛素耐受性(图四M)的影响。以上数据表明,AKG通过作用于Serpina1e抑制肝脏糖异生。
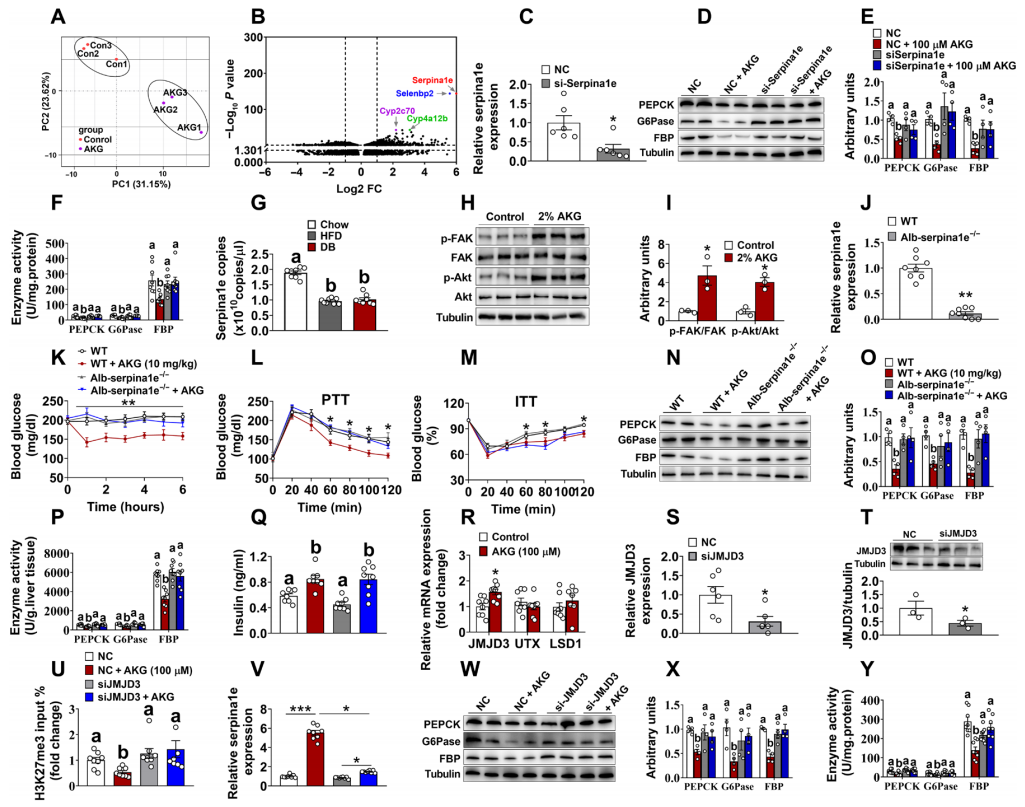
图四 Serpina1e是AKG抑制肝脏糖异生所必需的[6]
有研究表明,AKG可作为表观遗传修饰(包括RNA甲基化和组蛋白甲基化)的重要底物和辅助因子,在线粒体葡萄糖代谢中发挥作用[5, 7, 8]。由此,研究者测试了AKG对组蛋白去甲基化酶的作用,结果发现,AKG的补充显著性增加了组蛋白去甲基酶JMJD3的 mRNA表达(图四R)。进一步在原代肝细胞中敲低JMJD3(si-JMJD3),发现JMJD3的敲低(图四S和T)可消除AKG对Serpina1e启动子处H3K27me3水平的抑制作用(图四U),减弱AKG对Serpina1e mRNA表达的刺激作用(图四V),还减弱AKG对糖异生相关蛋白酶表达和活性的抑制作用(图四W-Y)。以上数据表明,AKG依赖JMJD3/H3K27me3/Serpina1e途径抑制肝脏糖异生。
先前研究表明AKG主要在线粒体中产生[9],且细胞外的AKG不能穿过细胞膜进入细胞内[10]。研究者采用13C-AKG体外处理肝细胞 24小时后,确实未在肝细胞中检测到放射性标记的AKG(图五A),但是外源13C-AKG的孵育上调了细胞内总的AKG水平(图五B)。其中,无线粒体的细胞质中的AKG水平显著升高(图五C),线粒体中的AKG水平也有升高的趋势(图五D),表明细胞膜上存在某种表面受体/传感器来调节内源性AKG从线粒体转运至细胞质。通过对AKG处理的雄性DIO小鼠肝脏进行转录组分析,发现转运蛋白Slc25a11和Slc13a2的mRNA表达显著升高(图五E)。经验证,在AKG处理后的原代肝细胞线粒体膜上,SLC25A11蛋白表达也显著升高(图五F)。siRNA实验结果显示,敲低Slc25a11可消除AKG对肝脏糖异生的抑制作用(图五G-J)。此外,敲低Slc25a11逆转了外源AKG对细胞质中AKG的增加作用(图五C)。以上数据表明,细胞外AKG通过增强肝细胞线粒体膜上SLC25A11的表达,提高细胞质中AKG水平,随后诱导JMJD3对Serpina1e启动子区域H3K27me3的去甲基化,增加Serpina1e的转录,实现抑制肝脏糖异生。
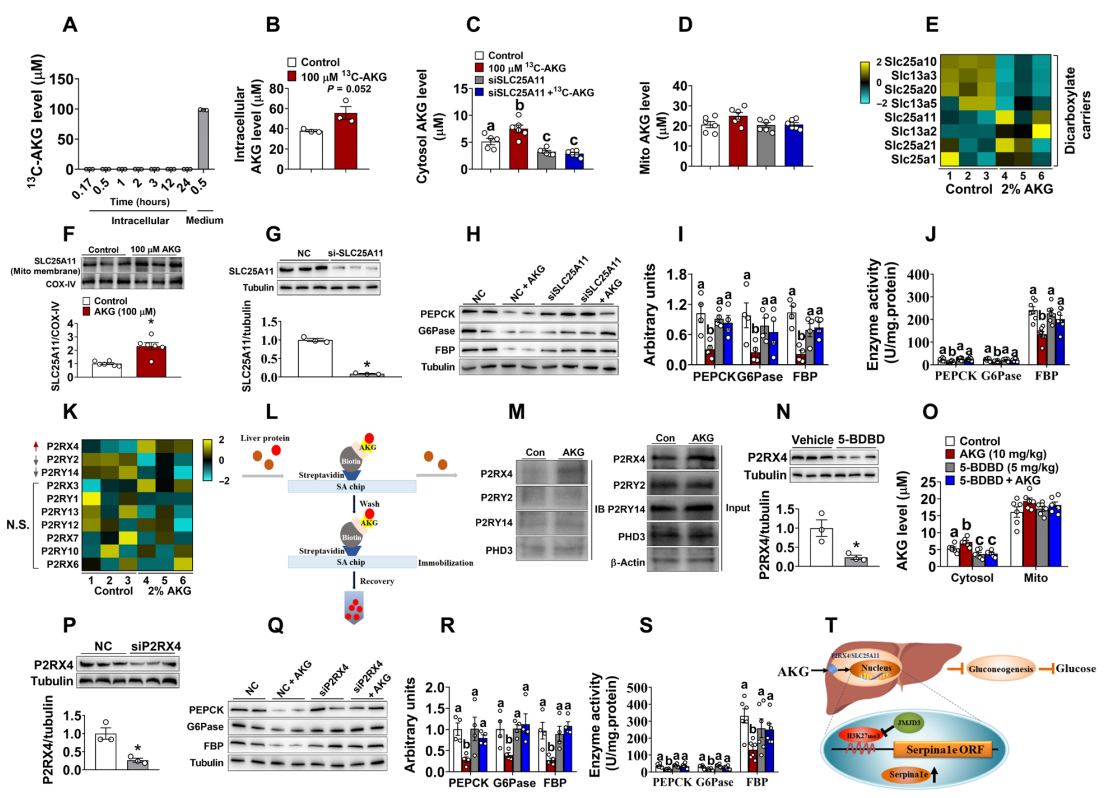
图五 P2RX4/SLC25A11介导AKG的细胞内转运[6]
最后,研究者对细胞外AKG是如何诱导肝细胞线粒体膜上SLC25A11的表达进行研究。研究者通过转录组测序发现,AKG显著增加了嘌呤能受体P2X4(P2rx4)的表达,并降低了P2ry2和P2ry14的表达(图五K)。这些嘌呤能受体与已知的AKG受体OXGR1具有序列相似性[11, 12]。研究者采用表面等离子共振(SPR)检测所有AKG结合蛋白及其富集程度(图五L),发现仅有P2RX4,而不是P2RY2或P2RY14,能与AKG显著性结合(图五M)。进一步使用P2X4R的拮抗剂5-BDBD来进行验证(图五N),发现5-BDBD和AKG的联合处理消除了AKG对细胞质中的AKG水平的增加作用(图五O)。同样地,敲低P2rx4可消除AKG对肝脏糖异生的抑制作用(图五P-S)。以上数据表明,P2RX4可能作为AKG表面结合蛋白介导肝细胞调控血糖。
综上所述,AKG通过P2RX4/JMJD3/H3K27me3/Serpina1e途径抑制肝脏糖异生,降低血糖浓度(图五T)。血浆循环中的细胞外AKG通过与嘌呤能受体P2RX4结合,增强肝细胞线粒体膜上SLC25A11的表达,促进内源性AKG由线粒体转运至细胞质中,进而介导JMJD3在Serpina1e启动子区域进行H3K27me3去甲基化,诱导Serpina1e表达,抑制肝脏糖异生,最终降低血糖浓度。该研究证明了AKG在血糖稳态中的重要作用及其分子机制,提示AKG-Serpina1e途径可作为T2DM的潜在治疗靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Zimmet P, Shi Z, El-Osta A, Ji L. Epidemic T2DM, early development and epigenetics: implications of the Chinese Famine. Nature reviews Endocrinology 2018, 14(12):738-746.
2. DeFronzo RA. Pathogenesis of type 2 diabetes mellitus. The Medical clinics of North America 2004, 88(4):787-835, ix.
3. Xiao D, Zeng L, Yao K, Kong X, Wu G, Yin Y. The glutamine-alpha-ketoglutarate (AKG) metabolism and its nutritional implications. Amino acids 2016, 48(9):2067-2080.
4. Yuan YX, Xu PW, Jiang QY, Cai XC, Wang T, Peng WT, Sun JJ, Zhu CJ, Zhang C, Yue D et al. Exercise-induced alpha-ketoglutaric acid stimulates muscle hypertrophy and fat loss through OXGR1-dependent adrenal activation. Embo J 2020, 39(7).
5. Tian Q, Zhao J, Yang Q, Wang B, Deavila JM, Zhu MJ, Du M. Dietary alpha-ketoglutarate promotes beige adipogenesis and prevents obesity in middle-aged mice. Aging cell 2020, 19(1):e13059.
6. Yuan Y, Zhu C, Wang Y, Sun J, Feng J, Ma Z, Li P, Peng W, Yin C, Xu G et al. alpha-Ketoglutaric acid ameliorates hyperglycemia in diabetes by inhibiting hepatic gluconeogenesis via serpina1e signaling. Science advances 2022, 8(18):eabn2879.
7. Liu PS, Wang HP, Li XY, Chao T, Christen TTS, Christen S, Di Conza G, Cheng WC, Chou CH, Vavakova M et al. alpha-ketoglutarate orchestrates macrophage activation through metabolic and epigenetic reprogramming. Nat Immunol 2017, 18(9):985-994.
8. Cieslar-Pobuda A, Ahrens TD, Caglayan S, Behringer S, Hannibal L, Staerk J. DNMT3B deficiency alters mitochondrial biogenesis and alpha-ketoglutarate levels in human embryonic stem cells. Stem cells 2020, 38(11):1409-1422.
9. Yang Q, Liang X, Sun X, Zhang L, Fu X, Rogers CJ, Berim A, Zhang S, Wang S, Wang B et al. AMPK/alpha-Ketoglutarate Axis Dynamically Mediates DNA Demethylation in the Prdm16 Promoter and Brown Adipogenesis. Cell metabolism 2016, 24(4):542-554.
10. Baracco EE, Castoldi F, Durand S, Enot DP, Tadic J, Kainz K, Madeo F, Chery A, Izzo V, Maiuri MC et al. alpha-Ketoglutarate inhibits autophagy. Aging 2019, 11(11):3418-3431.
11. Deen PM, Robben JH. Succinate receptors in the kidney. Journal of the American Society of Nephrology : JASN 2011, 22(8):1416-1422.
12. Qi AD, Harden TK, Nicholas RA. GPR80/99, proposed to be the P2Y(15) receptor activated by adenosine and AMP, is not a P2Y receptor. Purinergic signalling 2004, 1(1):67-74.



