技术分享:凝血因子XI可介导肝脏-心脏相互作用改善心力衰竭
内分泌因子如分泌蛋白介导的组织-组织相互作用,是维持组织正常生理稳态的重要机制[1]。心脏和肝脏在临床上表现出多方面的相互作用[2, 3],例如非酒精性脂肪性肝病会增加心脏舒张和收缩功能障碍导致心力衰竭的风险[4, 5],提示可能存在某种分泌蛋白介导肝脏和心脏之间的相互作用。一种常见的射血分数保留型心力衰竭(HFpEF),其特征是舒张功能障碍和射血分数保持,约占所有心力衰竭病例的一半。HFpEF通常还伴随着肥胖、糖尿病、高血压等其他并发症的发生,出现的慢性全身炎症和代谢紊乱不仅影响心肌,还影响其他器官,如肾、肺和骨骼肌[6, 7]。然而,对于其他器官如何与心脏发生相互作用及其调节HFpEF的病理机制知之甚少。
2022年9月,Science上发表的一篇文章揭示了肝脏特异性分泌的凝血因子XI(FXI)可以介导肝脏和心脏之间的相互作用。区别于在凝血中的作用,FXI依赖其蛋白水解活性可激活心脏的BMP-SMAD1/5通路,改善HFpEF的心脏舒张功能障碍,从而在HFpEF的心脏损伤中起保护作用[8]。
首先,为了筛选介导肝脏与心脏之间相互作用的内分泌因子,研究者利用之前发表的由100种不同近交系小鼠组成的HMDP数据库[9],分析肝脏和心脏转录组数据,计算肝脏分泌蛋白与心脏转录组的相关性(图一A),获得一个肝脏-心脏潜在作用分泌蛋白的相关性列表(图一B)。根据列表中分泌蛋白的相关性权重、肝脏特异性表达情况、文献报道和功能注释,研究者聚焦在肝脏特异性表达的F11基因(图一C),其编码的FXI蛋白与心脏关键通路以及多个HFpEF临床疾病特征显著相关(图一D),且经人类全基因组关联研究(GWAS)发现F11基因座与总胆固醇和BMP7表达水平具有相关性(图一E)。以上数据提示FXI在心力衰竭中具有潜在作用。
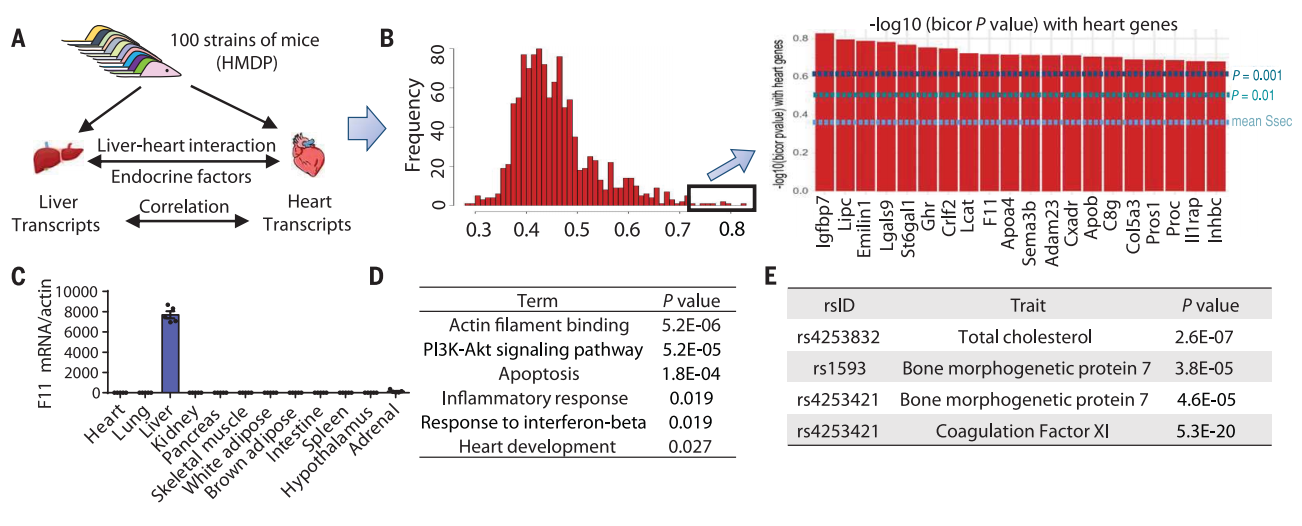
图一 肝脏-心脏组织相关性的系统遗传学分析[8]
进而,研究者在30种不同近交系小鼠中验证FXI与心力衰竭的关系。通过高脂饮食(HFD)和使用N-硝基-L-精氨酸甲酯(l-NAME)[10]联合诱导来进行小鼠HFpEF疾病造模,发现血浆中FXI的浓度与心脏舒张功能障碍呈负相关(图二A)。随后,研究者在HFpEF小鼠模型中过表达FXI,与对照组相比,AAV8-F11的注射增加了肝脏中FXI蛋白的表达,血浆中FXI浓度也显著升高(图二B和C),并显著降低了HFpEF病征中的心脏E/A指标和E/e’ 指标(图二D-F)以及心脏和肺的重量(图二H和I),但左室射血分数(LVEF)基本不变(图二G)。FXI过表达还改善了HFpEF小鼠的运动不耐受(图二J),但对血液中的凝血酶-抗凝血酶复合物没有显著影响(图二K)。此外,FXI过表达显著降低了心脏中炎症基因的表达(图二L),显著减少了心脏组织中的炎症细胞(图二M和N)以及心肌纤维化(图二O和P)。以上数据表明,FXI的过表达可以改善HFpEF小鼠心脏的舒张功能,减少心脏组织的炎症和纤维化的发生。
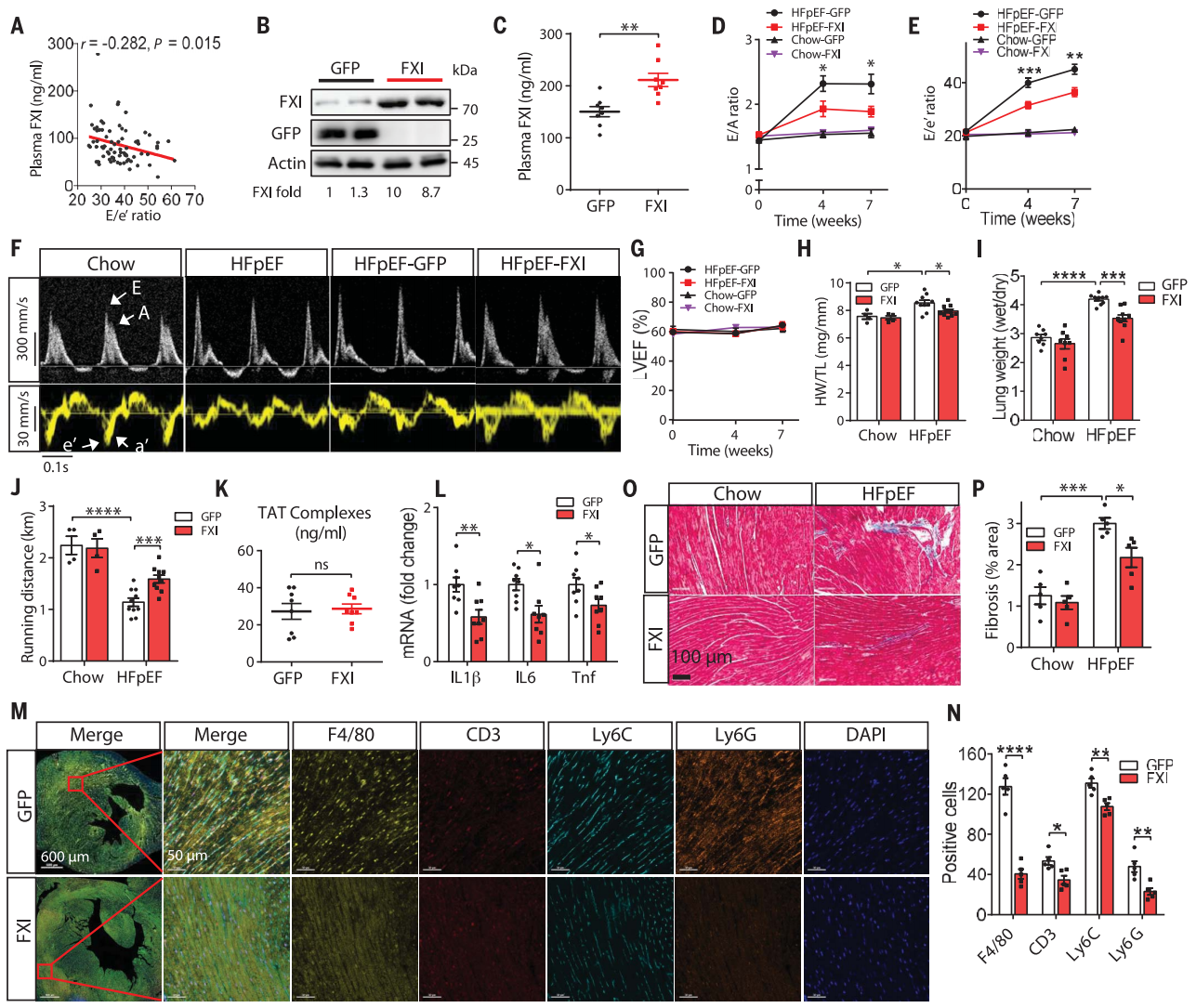
图二 FXI过表达可以改善HFpEF小鼠的疾病表型[8]
接下来,研究者对HMDP数据分析富集到的信号通路相关基因进行检测,以研究FXI影响心脏的分子机制。结果显示,FXI过表达显著增加HFpEF小鼠心脏中SMAD1/5磷酸化(p-SMAD1/5),显著减少TNF-α(图三A)和炎症基因Col5a3的表达(图三B),但在其他受检组织中均没有显著影响。为了测试FXI蛋白是否可以直接激活心肌细胞中的BMP-SMAD1/5通路,研究者将新生大鼠心室肌细胞(NRVM)、人胚胎干细胞诱导的心肌细胞和其他细胞系在添加人活化FXI蛋白(FXIa)的培养基中孵育24小时,结果显示在前两种细胞中p-SMAD1/5水平升高(图三C),炎症基因Nppa、Nppb、Col5a3和Adam19的表达显著降低(图三D),但在其他细胞系中没有明显变化。另外,在HFpEF疾病造模小鼠中过表达FXI的疗效,可在注射1型BMP受体选择性抑制剂DMH1后被减弱,结果显示为p-SMAD1/5表达被降低(图三E),心脏体积、舒张功能和LVEF没有被改善(图三F-H)。以上数据表明,FXI通过激活BMP通路来缓解HFpEF小鼠表型。
FXI蛋白在人、小鼠、大鼠等物种中保守,是由四个苹果结构域和一个催化结构域组成。为了测试FXI在心脏中的功能是否需要催化结构域,研究者在HFpEF疾病造模小鼠中过表达F11错义突变的突变型F11(mF11-Mut2)。结果显示,虽然过表达FXI组和突变型FXI组的小鼠血浆中FXI浓度都显著增加(图三I),但突变型FXI组的心脏p-SMAD1/5水平、心脏体积、舒张功能和LVEF都没有改善(图三J-M)。以上数据表明,FXI的催化结构域对其发挥HFpEF保护作用至关重要。
FXIa作为一种丝氨酸蛋白酶,可催化底物蛋白水解。经分析BMP7蛋白的精氨酸裂解位点是常见的FXIa裂解位点,而且BMP7的前体蛋白与心脏细胞外基质结合。研究者实验证明,FXI过表达显著增加心脏中BMP7生长因子二聚体和单体蛋白形式(图三N),在NRVM中敲低BMP7或用BMP7抗体治疗可显著降低FXIa对SMAD1/5的激活(图三O和P)。以上数据表明,FXI通过裂解BMP7的前体蛋白,使其从心脏细胞外基质中释放二聚体和单体生长因子,从而结合BMP受体并激活SMAD1/5。
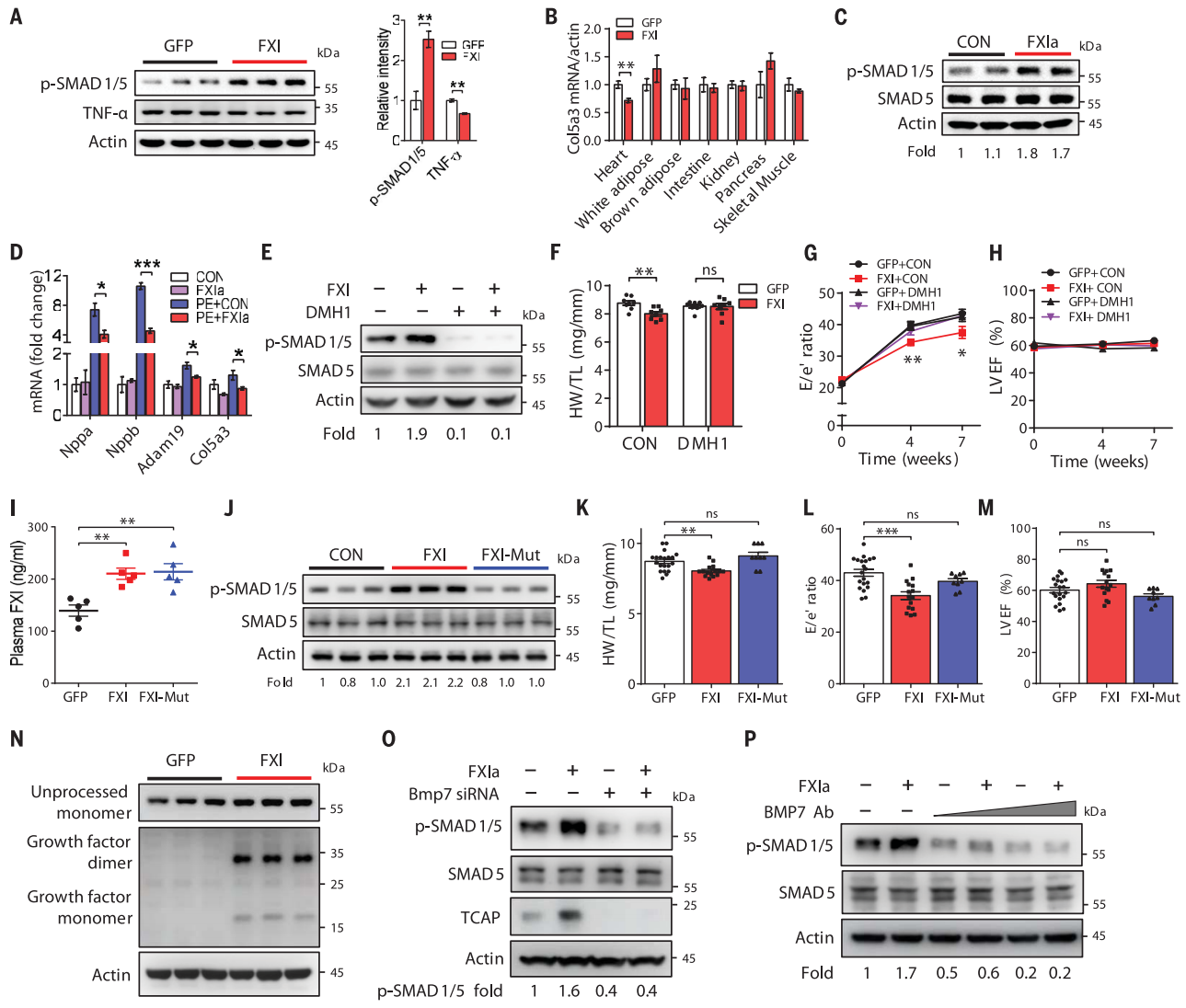
图三 FXI激活心脏中的BMP-SMAD1/5通路[8]
最后,研究者使用FXI基因敲除雄性小鼠来检测FXI对心脏的保护作用。结果发现,与WT小鼠相比,杂合小鼠(F11 Het)肝脏中F11的转录显著减少约50%(图四A)。随后,将成年WT小鼠和F11 Het小鼠分别进行HFpEF疾病造模,发现F11 Het疾病小鼠心脏中的p-SMAD1/5表达水平减少(图四B),且表现出更严重的舒张功能障碍,如E/A指标、E/eʹ指标和LV质量显著增加,LVEF仍然保持不变(图四C-G),心脏和肺重量显著增加(图四H和I),运动耐受性显著降低(图四J)。以上数据表明,在FXI缺陷的HFpEF疾病小鼠中,心脏舒张功能的障碍表现更加严重。
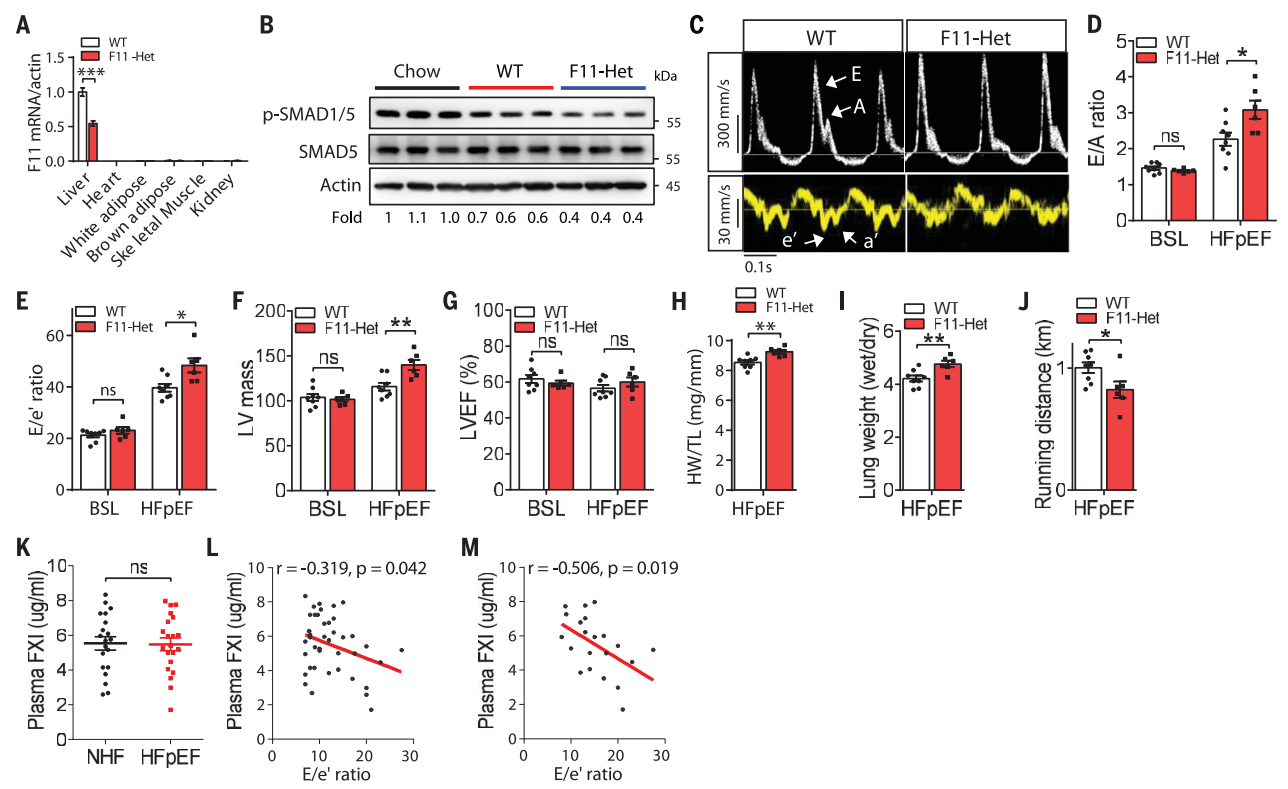
图四 FXI表达下调与小鼠和人的心脏舒张功能障碍相关[8]
为了确定FXI的临床相关性,研究者量化了HFpEF患者和正常人的血浆FXI浓度,发现虽然两组人群之间的血浆FXI水平没有显著差异(图四K),但是所有参与者(图四L)以及HFpEF患者(图四M)的血浆FXI浓度与E/e′指标呈现显著负相关,表明FXI保护HFpEF的舒张功能障碍在病人中也有类似作用。
综上所述,研究者通过系统遗传学分析筛选出介导肝脏-心脏相互作用的肝源性FXI分泌蛋白,独立于传统凝血功能,可通过激活BMP7-SMAD1/5通路特异性调节心肌细胞,改善HFpEF中的心脏舒张功能障碍、心肌纤维化和炎症。该研究解析了调控肝脏-心脏相互作用新分子的功能机制,提示BMP7-SMAD1/5通路可作为HFpEF的潜在治疗靶点,并为FXI抑制剂的临床试验提示可能存在影响心肌的风险。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Friedman JM, Halaas JL. Leptin and the regulation of body weight in mammals. Nature 1998, 395(6704):763-770.
2. Moller S, Bernardi M. Interactions of the heart and the liver. European heart journal 2013, 34(36):2804-2811.
3. Baskin KK, Bookout AL, Olson EN. The heart-liver metabolic axis: defective communication exacerbates disease. EMBO molecular medicine 2014, 6(4):436-438.
4. Packer M. Atrial Fibrillation and Heart Failure With Preserved Ejection Fraction in Patients With Nonalcoholic Fatty Liver Disease. The American journal of medicine 2020, 133(2):170-177.
5. Pacifico L, Di Martino M, De Merulis A, Bezzi M, Osborn JF, Catalano C, Chiesa C. Left ventricular dysfunction in obese children and adolescents with nonalcoholic fatty liver disease. Hepatology 2014, 59(2):461-470.
6. Hogg K, Swedberg K, McMurray J. Heart failure with preserved left ventricular systolic function; epidemiology, clinical characteristics, and prognosis. Journal of the American College of Cardiology 2004, 43(3):317-327.
7. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Trends in prevalence and outcome of heart failure with preserved ejection fraction. The New England journal of medicine 2006, 355(3):251-259.
8. Cao Y, Wang Y, Zhou Z, Pan C, Jiang L, Zhou Z, Meng Y, Charugundla S, Li T, Allayee H et al. Liver-heart cross-talk mediated by coagulation factor XI protects against heart failure. Science 2022, 377(6613):1399-1406.
9. Cao Y, Pan C, Wang YC, Zhou Z, Jedian V, Meng Y, Campbell G, Guardino K, Li C, Wang J et al. Identification of DNA Damage Repair Enzyme Ascc2 as Causal for Heart Failure With Preserved Ejection Fraction. Circulation 2022, 145(14):1102-1104.
10. Schiattarella GG, Altamirano F, Tong D, French KM, Villalobos E, Kim SY, Luo X, Jiang N, May HI, Wang ZV et al. Nitrosative stress drives heart failure with preserved ejection fraction. Nature 2019, 568(7752):351-356.



