技术分享:改良型rAAVs实现小胶质细胞的高效基因递送
作为中枢神经系统(CNS)中的常驻免疫细胞,小胶质细胞负责协调免疫反应和动态塑造CNS神经回路。小胶质细胞是CNS的关键调节细胞[1, 2],其功能障碍和特异性基因突变与许多CNS疾病有关,如神经退行性疾病[3]和脑部肿瘤[4]等。研究小胶质细胞的一个关键挑战在于难以对其进行有效标记和遗传操作。虽然重组病毒载体如低致病性的重组腺相关病毒(rAAVs)能够在哺乳动物体内实现多种细胞类型的基因递送,但是现有的rAAVs在小胶质细胞中的转导效率较低,无法达到足够的转基因表达水平,特别是在体内基因递送方面[5]。
2022年8月,Nature Methods上报道了三种改良型rAAVs变体AAV-cMG、AAV-MG1.1和AAV-MG1.2,分别能够在体外和体内高效地将基因递送到小胶质细胞中,实现转基因的特异性表达。利用AAV-MG1.1和AAV-MG1.2,研究者成功实现小胶质细胞的在体荧光标记、Ca2+信号和神经递质成像以及基因编辑[6]。
首先,研究者通过定向进化来体外筛选可高效转导小胶质细胞的rAAV变体。以野生型AAV9衣壳为起点,在AAV9 VP1蛋白的588和589位氨基酸之间随机插入7个氨基酸,构建一个rAAVs衣壳文库,并将它们转导到培养的小鼠小胶质细胞来递送mScarlet报告载体。转导成功的衣壳变体再次包装进行第二次转导实验,最后使用二代测序来确定两轮筛选后高度富集的衣壳变体(图一a)。经测序,研究者获得了两种rAAV新变体,其一是WPPKTTS序列插入的AAV-cMG.WPP,其二是QRPPREP序列插入的AAV-cMG.QRP(图一b)。这两种衣壳变体相比四种对照组AAV6TM、AAV5、AAV8和AAV9腺病毒,在培养的细胞中显示出更优的转导效率,其中AAV-cMG.WPP最优 (图一e),并且能驱动最强的mScarlet表达(图一g)。
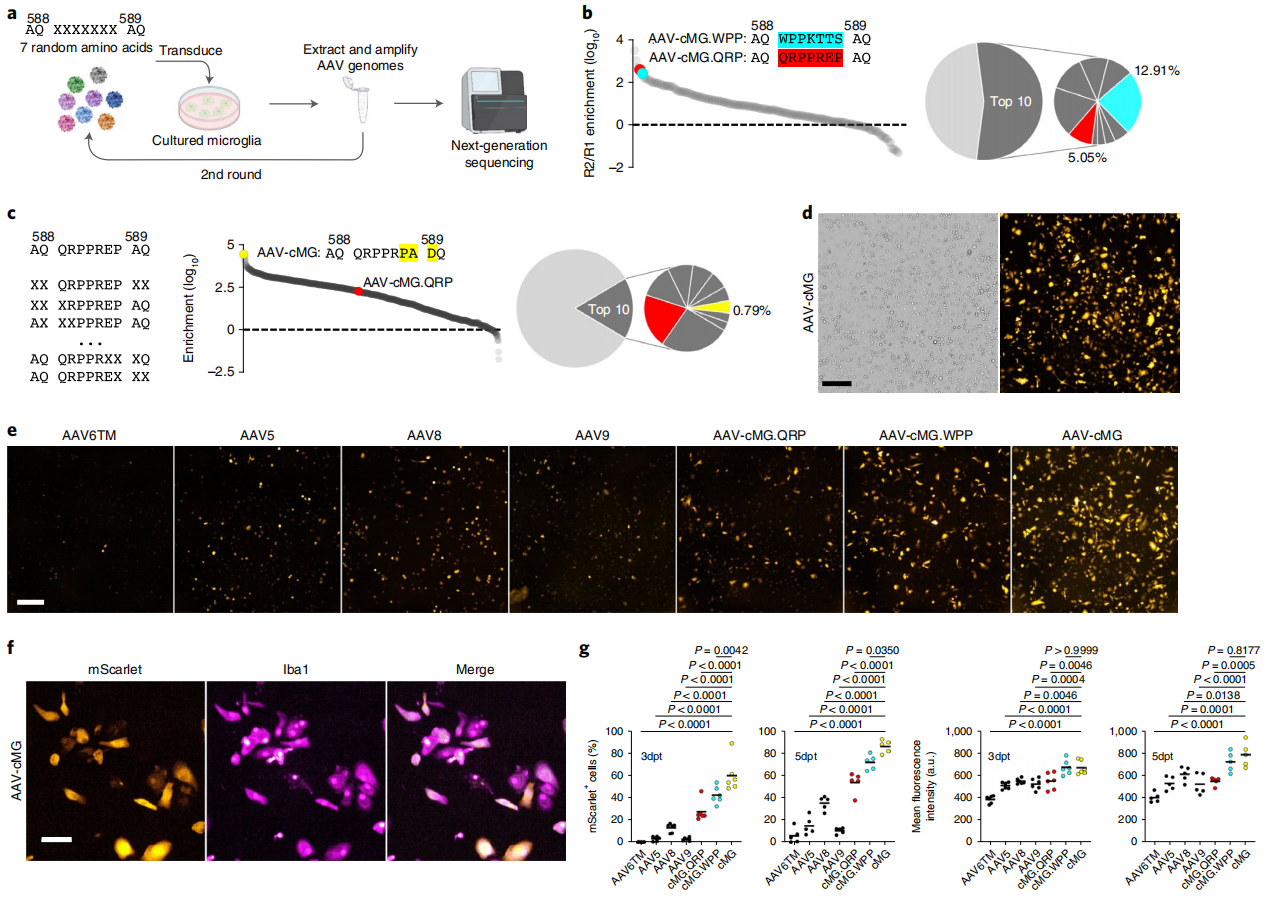
图一 AAV-cMG在体外小胶质细胞中介导高效的基因转导[6]
为获得更高转导效率的rAAV变体,研究者进一步定向进化AAV-cMG.QRP,通过半随机突变插入的七聚体和相邻的四个氨基酸来构建另一个衣壳文库。经过筛选,发现在594-596氨基酸序列为PAD的变体被高度富集,称为AAV-cMG(图一c和d),其细胞转导效率显著高于之前的AAV-cMG.WPP和AAV-cMG.QRP(图一e-g)。以上数据表明,新筛选到的rAAV变体AAV-cMG可以在体外高效转导培养的小胶质细胞。
接下来,研究者筛选可在体内高效转导小胶质细胞的rAAV变体。由于AAV-cMG.WPP和AAV-cMG.QRP在体转导效率不佳,研究者进一步定向进化AAV-cMG.WPP,还是通过半随机突变插入的七聚体和相邻的四个氨基酸来构建新的衣壳文库。将rAAV变体文库注射到Cx3cr1CreER小鼠的大脑中,该小鼠仅在小胶质细胞中表达受他莫昔芬调控入核的Cre重组酶,AAV递送成功的基因在Cre的作用下可见mScarlet荧光表达(图二a)。经过两轮筛选,研究者鉴定出两种高度富集的变体AAV-MG1.1和AAV-MG1.2(图二b),将单独包装的两种变体分别注射到Cx3cr1CreER小鼠大脑,相比对照组AAV都显示出广泛的mScarlet表达(图二c和d),注射部位核心区域中有大于80%的Iba1阳性小胶质细胞(图二e),mScarlet的表达依赖于Cre并且仅限于小胶质细胞(图二f和g)。以上数据表明,AAV-MG1.1和AAV-MG1.2变体可以在体内高效转导小胶质细胞。
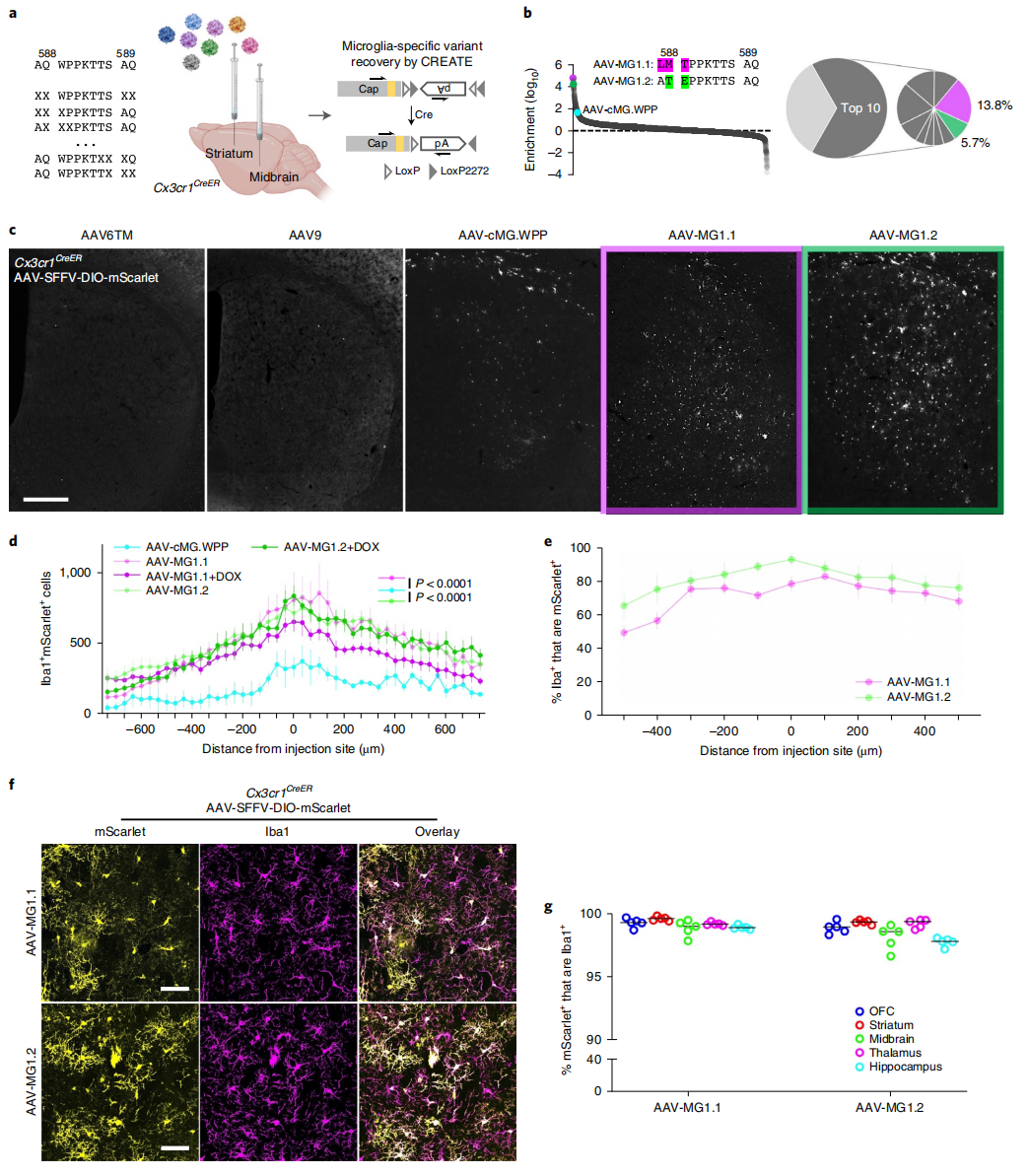
图二 AAV-MG1.1/1.2可高效介导小胶质细胞的在体基因转导[6]
然后,研究者利用AAV-MG1.2将基因递送到小胶质细胞中进行功能研究。首先将AAV注射入Cx3cr1CreER小鼠大脑S1皮层中来递送Cre依赖性钙指示剂jGCaMP8s表达载体,2周后腹腔注射LPS并进行双光子成像以示踪小胶质细胞中的Ca2+信号(图三a)。结果显示,LPS注射1小时后Ca2+信号显著增强,并在注射3小时后达到峰值,之后开始逐渐下降(图三b和c)。同样地,研究者使用AAV-MG1.2递送ATP荧光传感器GRABATP1.0,并监测GRAB荧光信号(图三a)。结果显示,LPS注射1小时后GRAB荧光信号显著增强,2小时后趋于稳定,6小时后仍保持在较高水平(图三d和e)。以上数据表明,AAV-MG1.2能够成功将基因在体递送至小胶质细胞,从而实现相关功能研究。
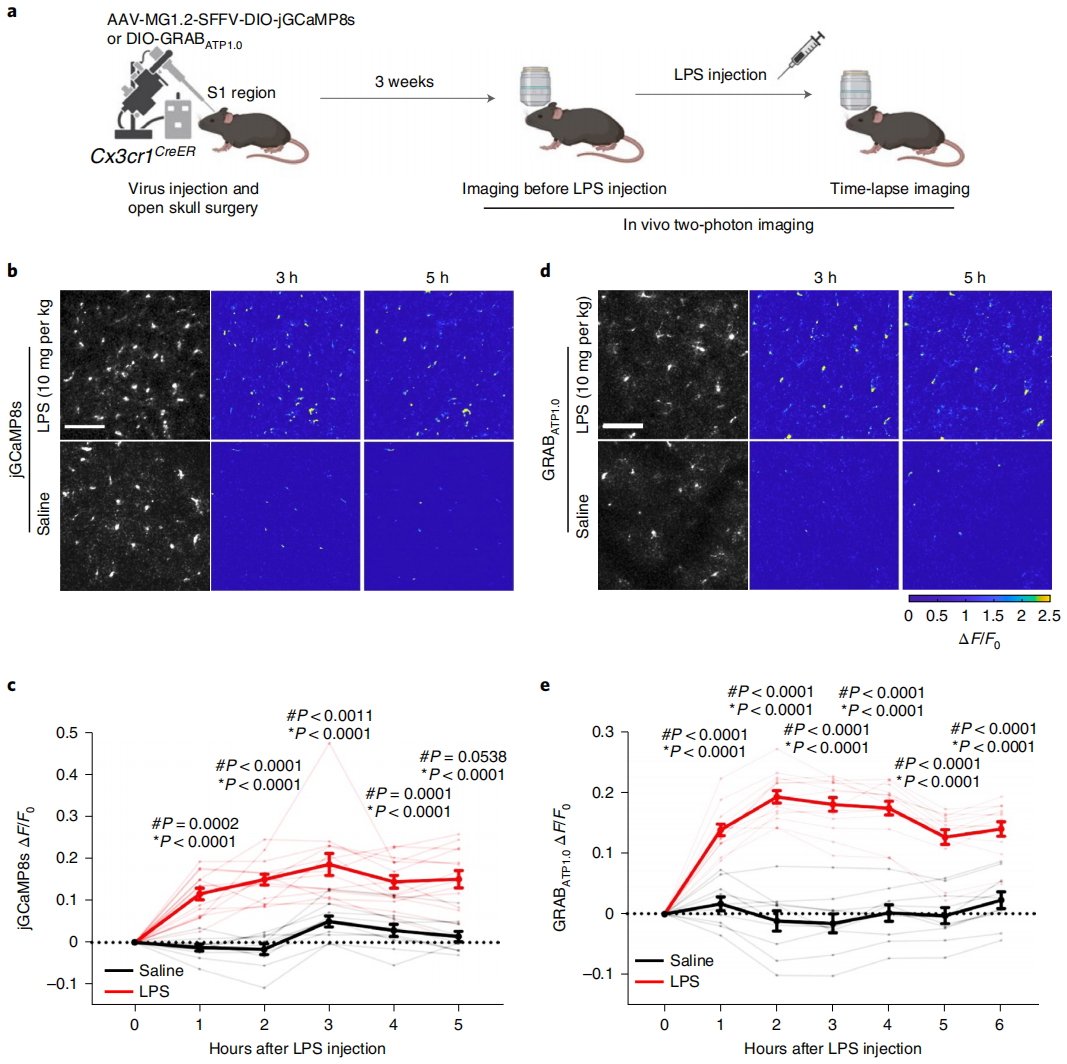
图三 AAV-MG1.2可介导体内小胶质细胞Ca2+和ATP信号成像[6]
最后,研究者测试AAV-MG1.1和AAV-MG1.2介导小胶质细胞中基因编辑的能力。将Cre依赖性Rosa26-LSL-Cas9-GFP报告小鼠与Cx3cr1CreER小鼠进行杂交,得到的子代小鼠Cx3cr1CreER:Rosa26-LSL-Cas9-GFP可通过他莫昔芬诱导小胶质细胞中Cas9的表达。分别使用AAV-MG1.1和AAV-MG1.2递送表达靶向小胶质细胞特异性基因Tmem119和Cd68的sgRNA载体,将AAV注射到Cx3cr1CreER:Rosa26-LSL-Cas9-GFP小鼠纹状体4周后,通过免疫荧光检测Tmem119或Cd68的蛋白表达情况。结果显示,与对照组相比,靶蛋白Tmem119(图四a-c)和Cd68(图四d-f)的免疫荧光信号都显著降低。以上数据表明,AAV-MG1.1和AAV-MG1.2均可高效介导小胶质细胞的在体基因编辑。
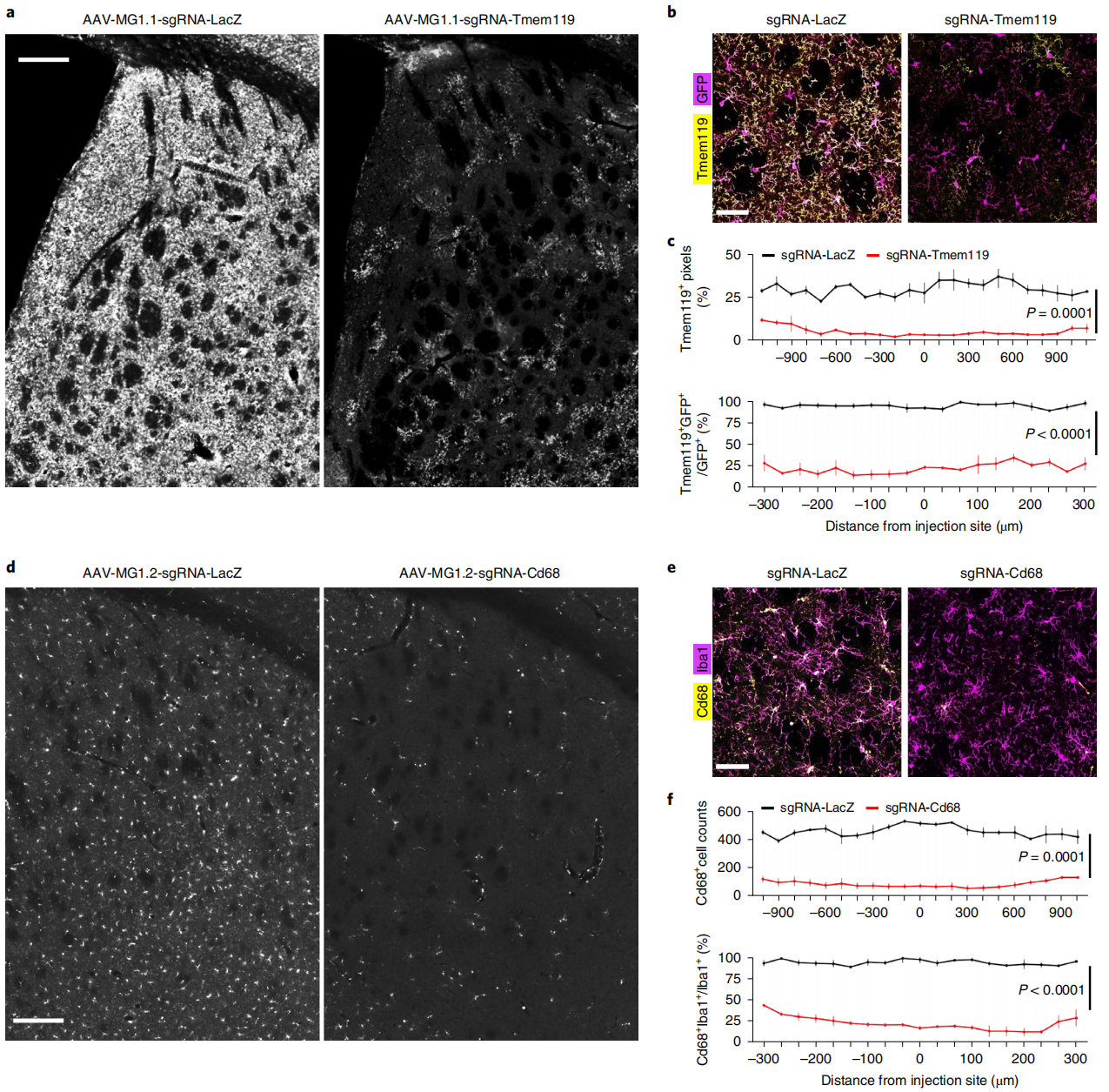
图四 AAV-MG1.1/1.2高效介导小胶质细胞的在体基因编辑[6]
综上所述,该研究组通过定向进化改良的工程化AAV-MG1.1和AAV-MG1.2,可以在体高效转导小胶质细胞,并实现特异性基因递送和转基因表达,从而用于小胶质细胞标记、在体监测和遗传操作等。该研究为小胶质细胞的生物学研究提供了新型rAAV病毒工具,可促进小胶质细胞相关的疾病机制研究。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Colonna M, Butovsky O. Microglia Function in the Central Nervous System During Health and Neurodegeneration. Annu Rev Immunol 2017, 35:441-468.
2. Prinz M, Jung S, Priller J. Microglia Biology. One Century of Evolving Concepts. Cell 2019, 179(2):292-311.
3. Hong S, Beja-Glasser VF, Nfonoyim BM, Frouin A, Li S, Ramakrishnan S, Merry KM, Shi Q, Rosenthal A, Barres BA et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science 2016, 352(6286):712-716.
4. Keane L, Cheray M, Blomgren K, Joseph B. Multifaceted microglia - key players in primary brain tumour heterogeneity. Nat Rev Neurol 2021, 17(4):243-259.
5. Maes ME, Wogenstein GM, Colombo G, Casado-Polanco R, Siegert S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Mol Ther Methods Clin Dev 2021, 23:210-224.
6. Lin R, Zhou Y, Yan T, Wang R, Li H, Wu Z, Zhang X, Zhou X, Zhao F, Zhang L et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nat Methods 2022, 19(8):976-985.



