技术分享:新型Cas9抑制剂的开发及其化学调控基因编辑
CRISPR-Cas系统的天然抑制剂,称为抗CRISPR(Anti-CRISPR,Acr)蛋白,已被开发为调节CRISPR-Cas基因编辑系统的有力工具[1, 2]。Acr蛋白是噬菌体和宿主细胞之间进化竞争的产物,由多种移动遗传元件(MGEs)编码以对抗原核生物中的CRISPR-Cas系统。截止目前,已经报道了88个不同的Acr家族,它们分别抑制I、II、III、V和VI型CRISPR-Cas系统[3, 4]。如AcrIIA家族蛋白对Cas9表现出多种抑制机制,分为干扰crRNA加载、阻断DNA结合和防止DNA裂解[5, 6]。其中AcrIIA2和AcrIIA4通过模拟DNA阻断Cas9与DNA的结合,AcrIIA6诱导Cas9的二聚化以降低Cas9与DNA的结合亲和力,AcrIIA14通过影响HNH结构域的活性来抑制Cas9切割DNA,AcrIIA15则直接与Cas9结合进而干扰sgRNA的加载。Acr蛋白的不同抑制机制丰富了人们对Acr在噬菌体-宿主进化竞争作用的认识,但只有少数Acr蛋白的抑制机制得到了深入的阐明。Acr蛋白作为调控基因编辑中Cas9活性的有效工具,仍有大量未知的Acr蛋白有待被挖掘,其开发应用仍然十分有限。
2022年2月,Nucleic Acids Research杂志上报道了9个新的Acr蛋白AcrIIA24-32,可以在细菌和人源细胞中通过多种机制有效抑制来源于链球菌的II-A型Cas9直系同源物SpyCas9、St1Cas9和St3Cas9。其中AcrIIA25.1和AcrIIA32.1可以阻断SpyCas9的DNA结合和切割,表现出独特的抗CRISPR特性,并进一步被研究者开发成化学诱导型抗CRISPR(iAcr)变体,可以在人源细胞中实现化学诱导调控CRISPR-Cas9介导的基因编辑[7]。
来源于链球菌基因组的不同Cas9直系同源物已被开发为各种基因编辑工具。然而,已知的Acr与大多数基因组并不匹配,表明链球菌基因组中可能存在多个未知的Acr。为了查找链球菌MGEs中潜在的Acr,研究者将AcrIIA6基因作为初始查询序列,通过BLAST程序进行生物信息学搜索,相关的相邻基因视为Acr候选基因(图一A)。随后在大肠杆菌中通过质粒干扰测定方法进行验证[8],针对广泛使用的链球菌Cas9系统SpyCas9、St1Cas9和St3Cas9对候选基因进行测试(图一B)。在质粒干扰测定中,编码Cas9、靶向sgRNA或错配sgRNA构建在同一质粒,与含有靶位点的质粒pT以及表达Acr蛋白的质粒共转化大肠杆菌(图一B)。通过计算大肠杆菌的cfu比例来测量每个Acr蛋白的抑制活性。经过几轮“搜索验证”过程,研究者筛选了30个Acr候选基因,并鉴定出9个不同的Acr基因,命名为AcrIIA24-32(图一C)。结果显示,AcrIIA24-32蛋白表现出对SpyCas9和St3Cas9相似的抑制作用,但对St1Cas9的抑制作用截然不同,AcrIIA30和AcrIIA31均强烈抑制St1Cas9活性(图一C),表明来自AcrIIA24-32的多个Acr可以在大肠杆菌中有效地抑制链球菌的Cas9直系同源物。
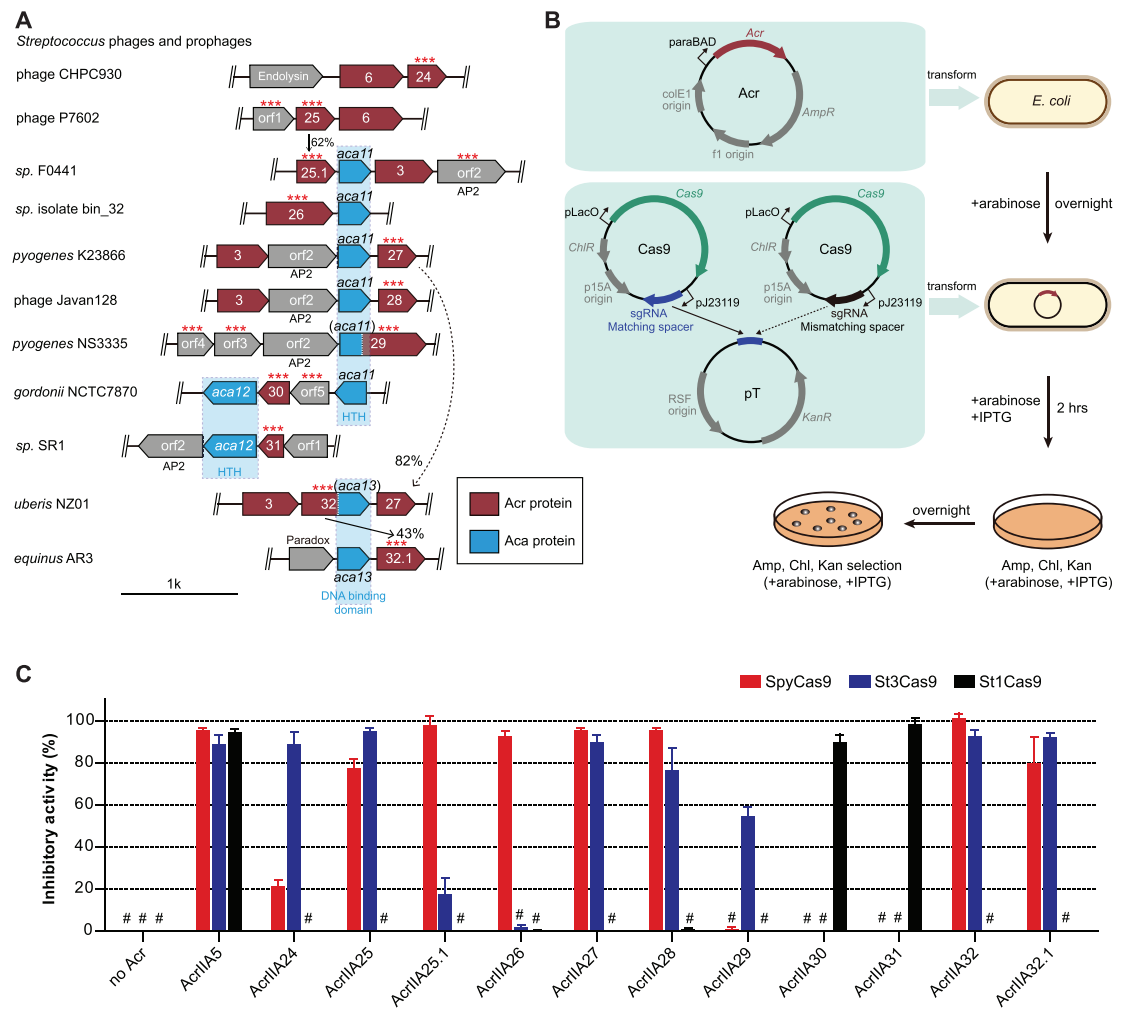
图一 9个AcrIIA家族蛋白的鉴定和验证[7]
为进一步研究AcrIIA24-32是否对Cas9具有广谱抑制作用,研究者进行了噬菌斑测定,检测AcrIIA24-32对各种Cas9直系同源物的抑制活性(图二A)。实验结果显示,targeting对照组所有的Cas9直系同源物都成功减少了噬菌体斑块,其中SpyCas9靶向噬菌体的效率略低;AcrIIA24-32中AcrIIA30和AcrIIA31可以特异性抑制St1Cas9,而其他Acr可以同时抑制SpyCas9和St3Cas9;AcrIIA24-32对SaCas9、NmeCas9和FnCas9没有检测到抑制活性(图二B和C)。以上数据表明,AcrIIA24-32蛋白是链球菌CRISPR-Cas9系统的特异性抑制剂。
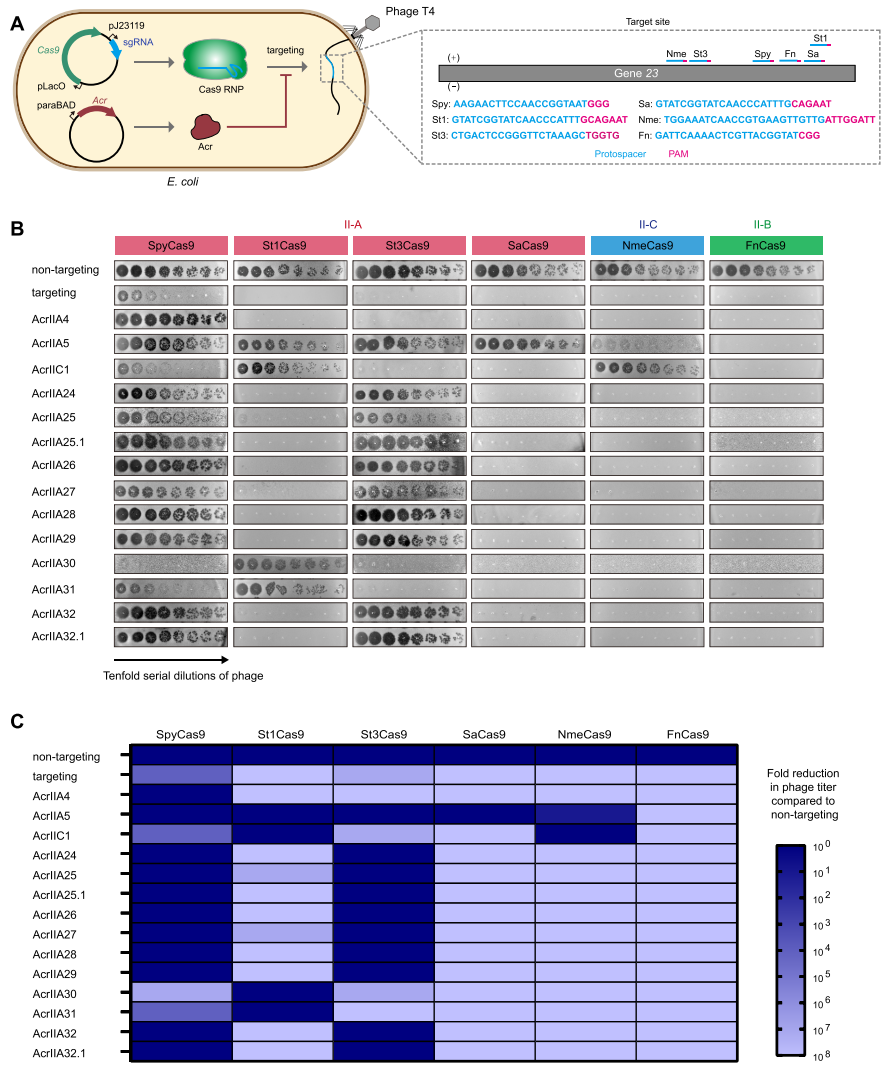
图二 AcrIIA24-32是链球菌CRISPR-Cas9系统的特异性抑制剂[7]
接下来,研究者验证了AcrIIA24-32是否可以在人源细胞中抑制链球菌Cas9直系同源物,将sgRNA、编码Cas9和Acr的质粒共转染HEK293T细胞,72小时后使用T7E1实验分析单个编辑效率(图三A)。结果显示,AcrIIA25.1、AcrIIA26、AcrIIA27、AcrIIA28、AcrIIA32和AcrIIA32.1几乎可以完全抑制SpyCas9的活性,抑制水平与已知的强效抑制剂AcrIIA5水平相当(图三B和C);多个Acr可以不同程度地抑制St3Cas9活性(图三D和E);AcrIIA30、AcrIIA31和AcrIIA31.1可以有效抑制St1Cas9的活性(图三F和G)。以上结果表明,AcrIIA24-32中的多个Acr可以在人源细胞中有效抑制链球菌Cas9直系同源物SpyCas9、St1Cas9和St3Cas9的活性。
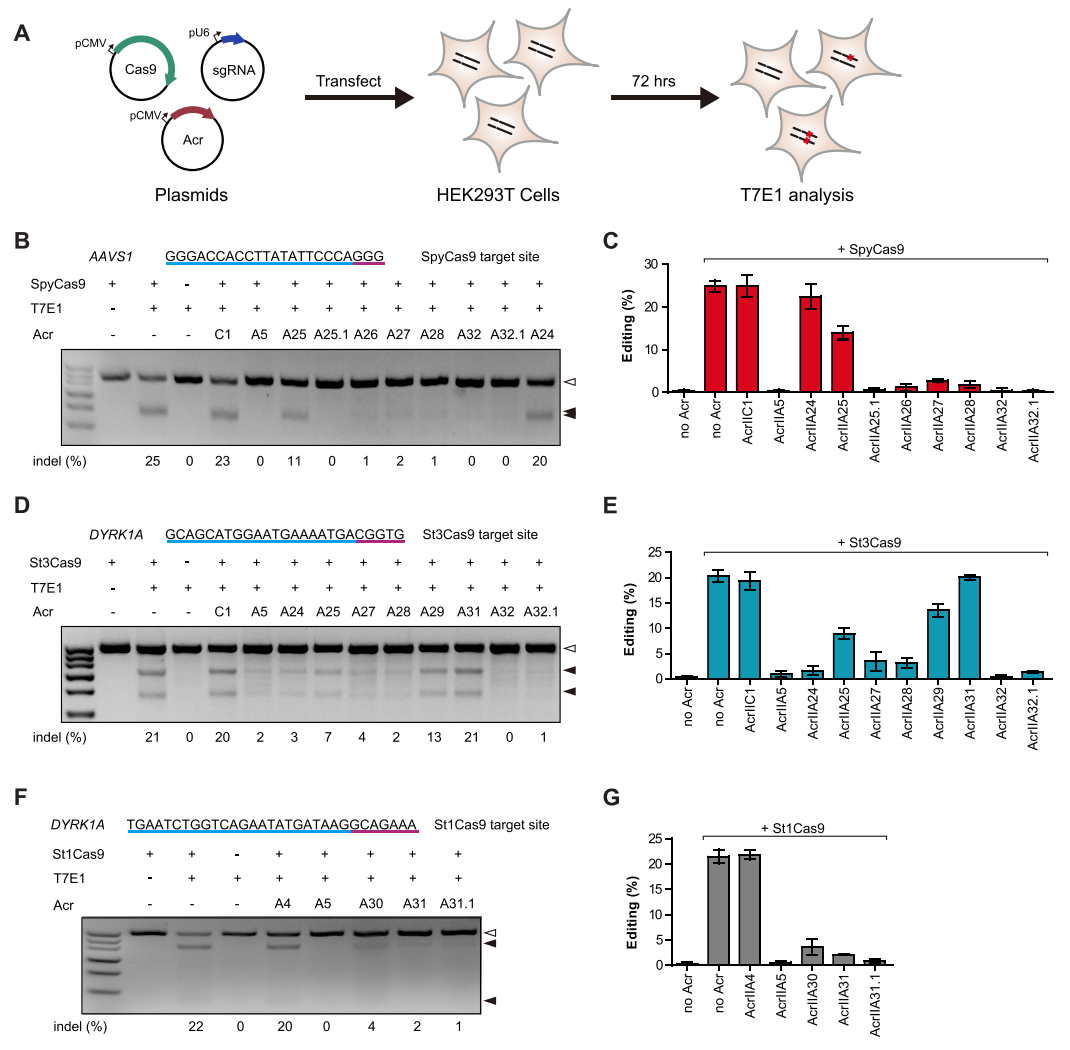
图三 AcrIIA24-32在人源细胞中抑制不同Cas9介导的基因编辑[7]
为了研究这些新发现的Acr蛋白抑制Cas9活性的机制,研究者将编码不同荧光蛋白及Cas9蛋白的序列与靶向人类端粒DNA序列的sgRNA构建在同一质粒,利用mCherry标记的链球菌Cas9直系同源物与端粒DNA的结合来评价Acr的抗CRISPR作用,利用sfGFP标记的NmeCas9来定位端粒,选择AcrIIA24、AcrIIA25.1、AcrIIA26、AcrIIA27、AcrIIA30、AcrIIA31和AcrIIA32.1来测试U2OS细胞中Cas9直系同源物与端粒的共定位荧光成像(图四A和B)。结果显示,在表达AcrIIA5的细胞中观察到Spy_dCas9-(mCherry)3和Nme_dCas9-(sfGFP)3在端粒的共定位,而在表达AcrIIA4、AcrIIA25.1、AcrIIA26、AcrIIA27或AcrIIA32.1的细胞中,在端粒定位的红色荧光显著减弱,但不影响由Nme_dCas9-(sfGFP)3标记的绿色荧光(图四C和D)。以上结果表明,AcrIIA25.1、AcrIIA26、AcrIIA27和AcrIIA32.1可以在人源细胞中有效阻断SpyCas9与DNA的结合。同样地,研究者建立类似的荧光成像系统来评价 Acr蛋白抑制St1Cas9和St3Cas9活性的机制(图四A和B)。结果显示,AcrIIA27和AcrIIA32.1、AcrIIA30和AcrIIA31分别减弱了St3_dCas9-(mCherry)3和St1_dCas9-(mCherry)3在端粒定位的红色荧光,然而AcrIIA24没有影响St3_dCas9-(mCherry)3和Nme_dCas9(sfGFP)3在端粒的共定位(图四E-H),提示AcrIIA24可能采用其他机制来抑制Cas9。以上结果表明,在人源细胞中,来自链球菌的Acr采用包括阻断Cas9与DNA结合在内的多种机制来抑制Cas9直系同源物的活性。
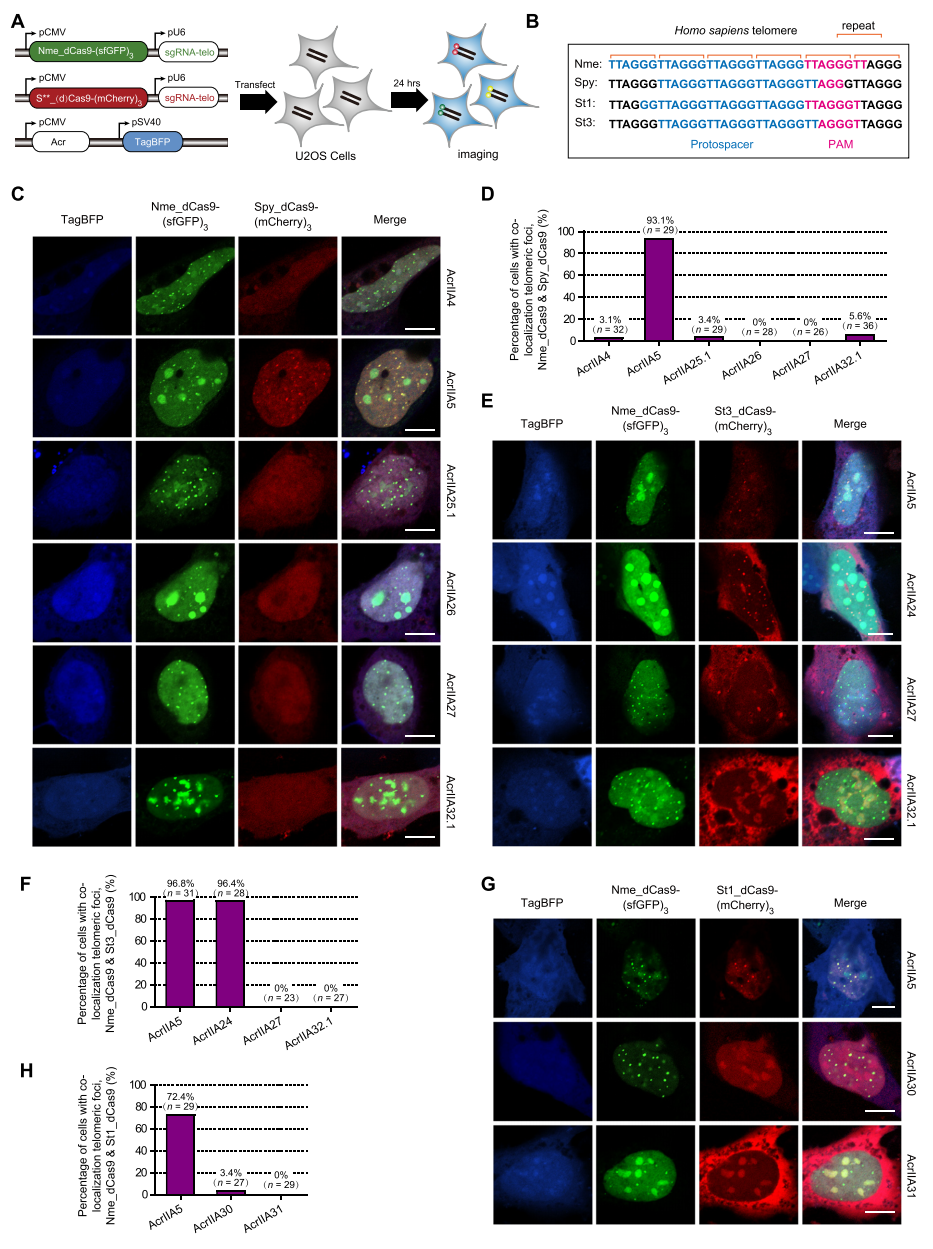
图四 在人源细胞中Acr蛋白采用多种策略抑制Cas9直系同源物[7]
通过进一步的实验,研究者发现AcrIIA25.1和AcrIIA32.1可以抑制Cas9的DNA结合和DNA切割活性,显示出调节基因编辑的强大潜力,于是选择这两种Acr蛋白来进一步开发成化学诱导型Acr。研究者将配体依赖性内含肽37R3-2融合AcrIIA25.1或AcrIIA32.1蛋白使其失去活性,而4-HT与内含肽结合可触发内含肽自我剪接并恢复Acr活性以抑制Cas9(图五A)。研究者在表达蓝色荧光蛋白(BFP)的HEK293T细胞中设计先导编辑器PE介导的BFP-to-GFP报告系统,PE可以将碱基CC替换为GT从而将BFP转换为GFP使细胞表达绿色荧光蛋白(图五B)。将靶向BFP的PegRNA、编码PE和内含肽-Acr的质粒共转染HEK293T-BFP细胞(图五B),存在或不存在4-HT的情况下,通过比较BFP与GFP比例来测量内含肽-Acr对Cas9的影响。结果显示,4-HT处理对细胞中PE和WT Acr的活性没有明显影响,内含肽-AcrIIA25.1(S76)和内含肽-AcrIIA32.1(T40)可以在4-HT存在下显著抑制PE介导的BFP-to-GFP编辑,表现出4-HT依赖性调节(图五C),这两种变体分别缩写为iA25.1和iA32.1。
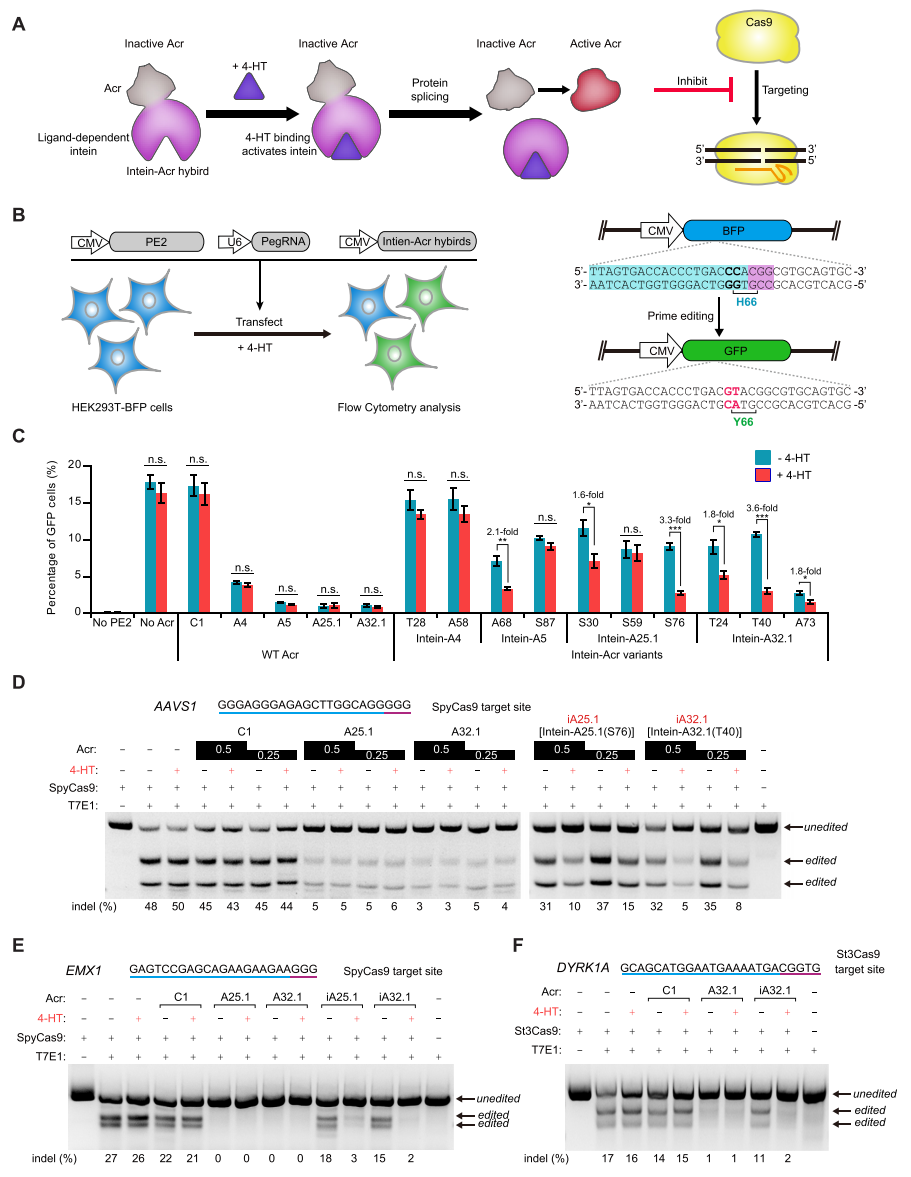
图片图五 化学诱导型Acr调控CRISPR-Cas9介导的基因编辑[7]
为进一步检验iA25.1和iA32.1依赖4-HT抑制Cas9介导基因编辑的效果,研究者在HEK293T细胞中进行了T7E1测定。结果显示,这两种变体在没有4-HT的情况下对SpyCas9活性有轻微的影响,但在4-HT存在下会切换到活性状态显著抑制SpyCas9(图五D和E),此外iA32.1还可以抑制细胞中St3Cas9介导的基因编辑(图五F)。以上结果表明,iAcr表现出4-HT依赖性调控人源细胞中CRISPR-Cas9介导的基因组编辑。
综上所述,该研究组从链球菌MGEs中发现了多个新的II-A型Acr,它们以多种不同的机制抑制Cas9直系同源物。基于这些Acr,研究者开发的化学诱导型iA25.1和iA32.1,可在人源细胞中表现出4-HT依赖性地调控CRISPR-Cas9介导的基因编辑。该项工作既扩展了II-A型抗CRISPR家族蛋白的多样性,又为开发Acr相关可控基因编辑工具的策略提供了新的见解。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Zhang F, Song G, Tian Y. Anti-CRISPRs: The natural inhibitors for CRISPR-Cas systems. Animal models and experimental medicine 2019, 2(2):69-75.
2. Marino ND, Pinilla-Redondo R, Csorgo B, Bondy-Denomy J. Anti-CRISPR protein applications: natural brakes for CRISPR-Cas technologies. Nature methods 2020, 17(5):471-479.
3. Li Y, Bondy-Denomy J. Anti-CRISPRs go viral: The infection biology of CRISPR-Cas inhibitors. Cell host & microbe 2021, 29(5):704-714.
4. Bondy-Denomy J, Davidson AR, Doudna JA, Fineran PC, Maxwell KL, Moineau S, Peng X, Sontheimer EJ, Wiedenheft B. A Unified Resource for Tracking Anti-CRISPR Names. The CRISPR journal 2018, 1:304-305.
5. Dong D, Guo M, Wang S, Zhu Y, Wang S, Xiong Z, Yang J, Xu Z, Huang Z. Structural basis of CRISPR-SpyCas9 inhibition by an anti-CRISPR protein. Nature 2017, 546(7658):436-439.
6. Jia N, Patel DJ. Structure-based functional mechanisms and biotechnology applications of anti-CRISPR proteins. Nature reviews Molecular cell biology 2021, 22(8):563-579.
7. Song G, Zhang F, Tian C, Gao X, Zhu X, Fan D, Tian Y. Discovery of potent and versatile CRISPR-Cas9 inhibitors engineered for chemically controllable genome editing. Nucleic acids research 2022, 50(5):2836-2853.
8. Song G, Zhang F, Zhang X, Gao X, Zhu X, Fan D, Tian Y. AcrIIA5 Inhibits a Broad Range of Cas9 Orthologs by Preventing DNA Target Cleavage. Cell reports 2019, 29(9):2579-2589.e2574.



