技术分享:心脏特异性递送的Cas9/MNP磁复合体实现心肌梗塞的在体治疗
心血管疾病发生在心脏和血管中,是全球第二大死亡原因。引起心血管疾病的主要原因包括冠状动脉疾病、心肌梗塞(MI)和心律失常[1, 2]。目前的一些治疗方法,包括传统的小分子治疗[3]、基因治疗[4]、细胞重编程[5]和干细胞移植[6],虽然已被开发用于急性心肌梗塞后的心脏再生,但尚无治愈心肌梗塞的方法。CRISPR/Cas9介导的基因编辑技术由于其简便性、稳定性和高效性,已成为一种备受瞩目的治疗难治性疾病的新方法,被用于多种疾病的基因治疗中。然而,由于心脏的靶向递送难度高,使得CRISPR/Cas9系统用于心肌梗塞等心脏疾病的治疗仍然具有挑战性。
2022年2月,Biomaterials杂志上报道了一种利用磁力吸引的CRISPR/Cas9递送系统,通过磁性纳米颗粒(MNPs)偶联CRISPR/Cas9形成稳定的Cas9/MNP磁复合体,将其注入血液后利用外部磁场引导至心脏,从而实现心脏特异性靶向递送的在体基因编辑。研究者利用该系统证实了靶向miR34a的Cas9/MNP磁复合体,可促进心肌梗塞小鼠的心肌细胞获得有效再生,提示该系统可广泛用于治疗各种心脏疾病[7]。
首先,研究者将带负电荷的CRISPR/Cas9基因与阳离子磁性纳米颗粒(MNPs)进行偶联构建了Cas9/MNP磁复合体,并对其理化性质进行表征。凝胶阻滞分析结果表明CRISPR/Cas9基因和MNPs的比例在1:0.5时可开始形成磁复合体(图一b);原先CRISPR/Cas9的Zeta电位值为负值,当与MNPs以1:1的比例偶联后,可增加到51.2±1.4 mV(图一c);MNPs和Cas9/MNP的平均粒径大小分别为218.4±43.5 nm和217.2±47.1 nm(图一d);MNPs的元素组成仅为铁和氧元素,而Cas9/MNP磁复合体还增加了氮和磷(图一e),表明CRISPR/Cas9的DNA确实在磁复合体中。另外,MTT测定显示Cas9/MNP的处理不会显著影响细胞活力(图一f)。随后,研究者测试外部磁场的刺激能否改变磁复合体在小鼠体内的分布,使其富集定位于心脏。通过静脉注射荧光染料标记的Cas9/MNP后,并将外部磁场设置于左胸(图一a)。结果显示,在没有外部磁场刺激的条件下,Cas9/MNP荧光主要分布在肝脏和肺部;在左胸局部施加外部磁场后,则定位改变成主要分布于心脏(图一g)。分离器官进行离体成像也得到相同的结论(图一h和i)。以上结果表明,静脉注射的Cas9/MNP可以在血清中保持稳定,并在外部磁场的引导下选择性地定位到小鼠的心脏。
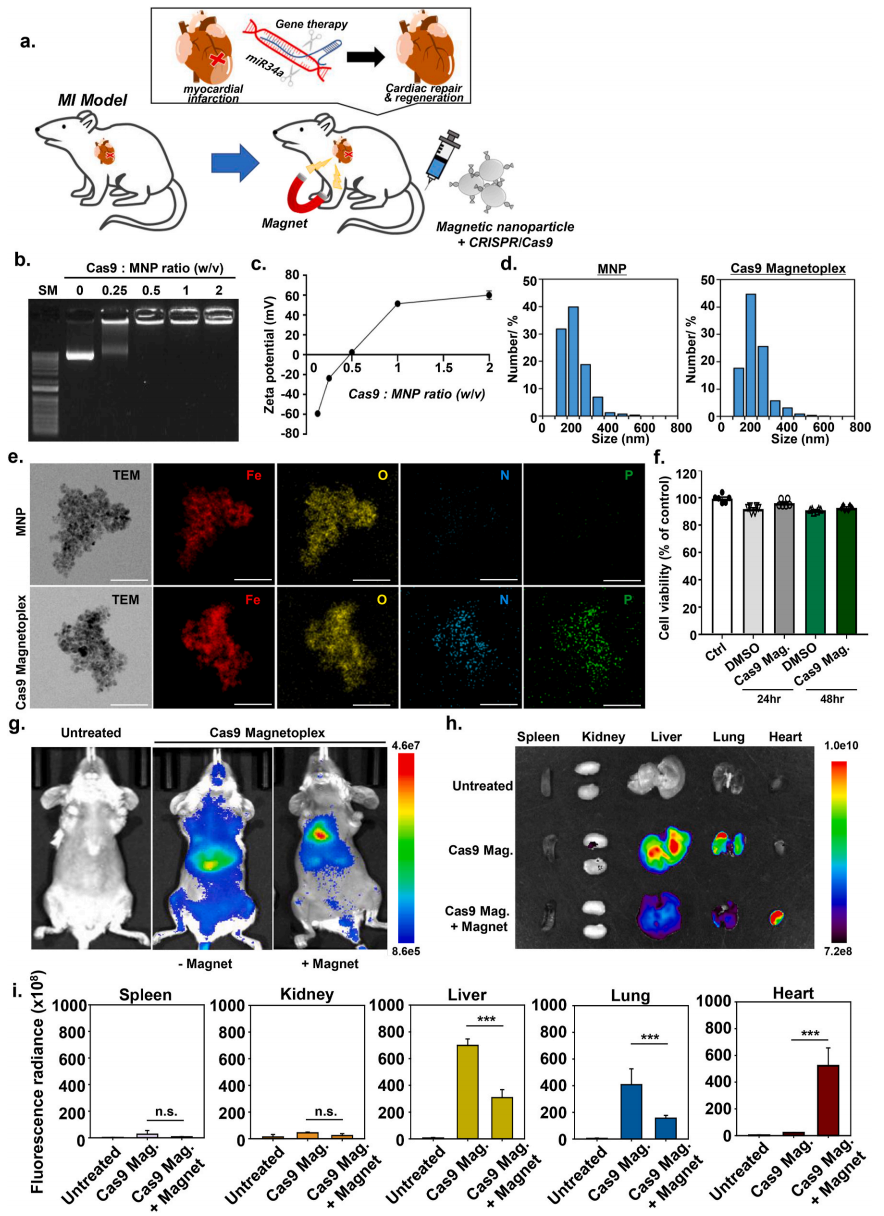
图一 Cas9/MNP磁复合体的性质表征和分子成像[7]
miR34a的缺失已被证明可以显著降低心肌梗塞后的心肌细胞死亡和心肌纤维化,并促进心肌功能的再生[8]。接下来,研究者设计了靶向基因组miR34a的sgRNA,体外测试Cas9/MNP的基因编辑能力(图二a-b)。用miR34a-Cas9/MNP处理NIH/3T3细胞后,可在靶位点上检测到高比例的序列插入与缺失(图二c,d,f);miR34a的表达确实被显著性敲降(图二e) ;并且预测排名前5的sgRNA脱靶位点的脱靶效应非常低(图二g)。此外,miR34a的敲降伴随着下游作用靶点如Notch1和Pnuts的mRNA及蛋白质表达水平显著升高(图二h-j)。以上结果表明,Cas9/MNP在外部磁场的引导下,可在体外细胞中高效地敲降miR34a,并激活心脏修复所需的下游基因。
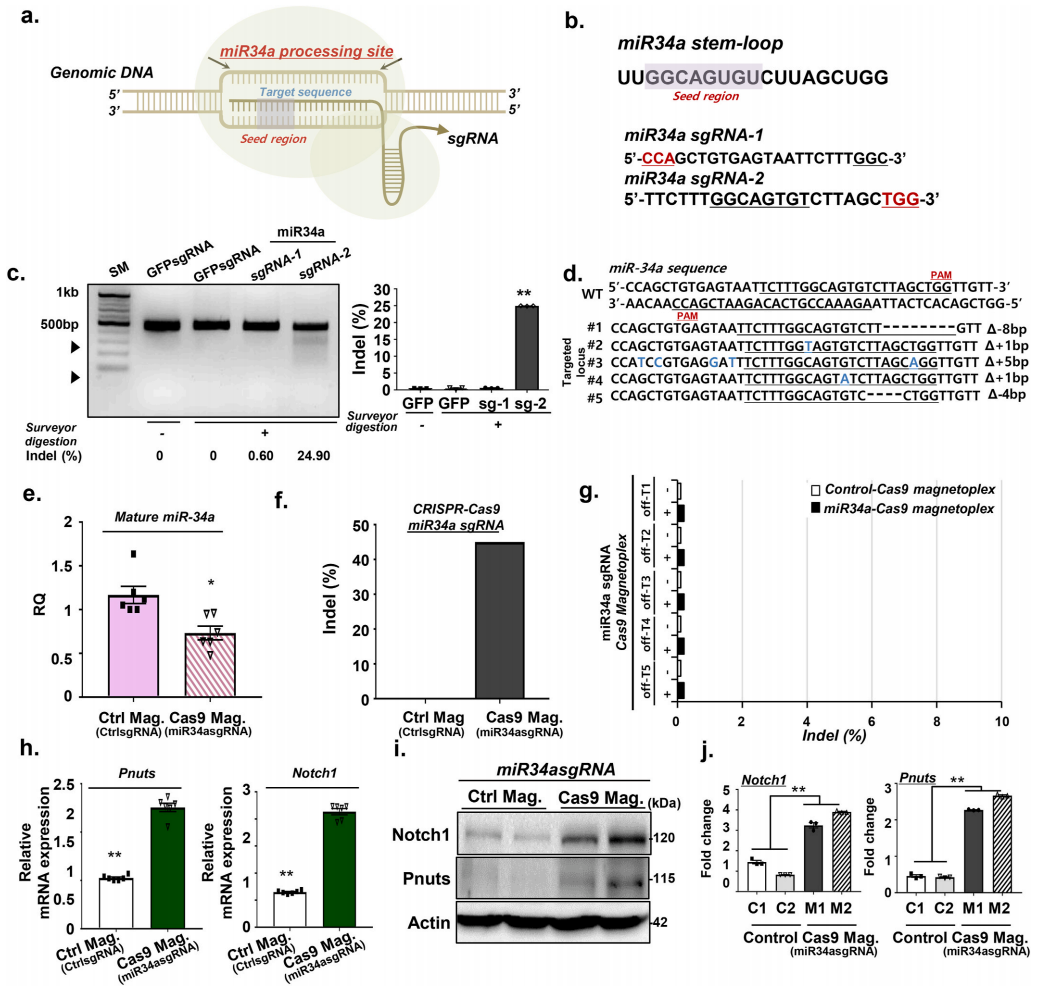
图二 Cas9/MNP在体外细胞中可介导高效的基因编辑[7]
最后,研究者在心肌梗塞(MI)小鼠模型中测试靶向miR34a的Cas9/MNP能否通过在体敲降心脏器官的miR34a来改善心肌梗塞后的心脏修复与再生。将miR34a-Cas9/MNP静脉注射到MI小鼠体内,并在心脏附近放置1小时的外部磁场以吸引和定位miR34a-Cas9/MNP(图三a)。经miR34a-Cas9/MNP处理3周后,MI小鼠的心肌肥大症状被有效改善(图三b),心肌细胞的纤维化显著减少(图三c和d),miR34a的表达证实被有效抑制(图三e),纤维化标志基因Col1、Col3、Postn、Fn的表达显著降低(图三f),心肌细胞特异性基因Myh6、Myh7、Myl7、Myl2等的表达显著上调(图三g-i)。此外,研究者进行转录组分析后,在miR34a-Cas9/MNP处理的心脏中获得了1068个差异表达基因,包括978个下调基因和90个上调基因(图三j)。经GO富集分析发现,下调基因主要与炎症和纤维化过程相关;而上调基因主要与心脏修复过程相关,例如心脏发育、心肌调节、心肌组织形态发生和DNA复制(图三k)。以上结果表明,Cas9/MNP介导的miR34a基因敲降可以有效促进心肌梗塞造成的受损心肌细胞的存活与再生,促使心脏修复以治疗心肌梗塞。
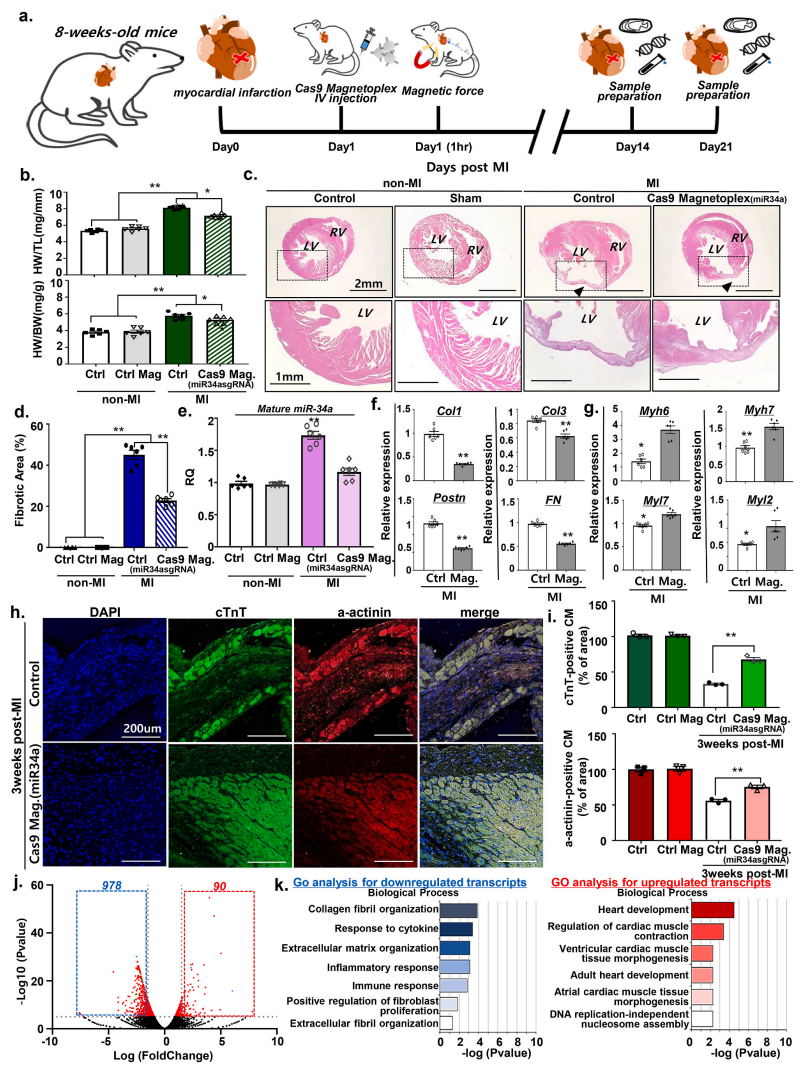
图三 miR34a-Cas9/MNP有助于心肌梗塞后的心脏修复[7]
综上所述,Cas9/MNP磁复合体是一种有效的在体递送系统,在外部磁场的刺激下可以在心肌梗塞小鼠模型体内将CRISPR/Cas9基因高效地、有针对性地递送至小鼠心脏,进行心脏特异性的基因编辑,从而促进心脏损伤的修复和再生。该方法同时能减少CRISPR/Cas9系统在其他组织器官中进行基因编辑而造成不良副作用以及脱靶效应,从而最大化心脏区域的治疗效果。未来,Cas9/MNP磁复合体递送系统可进一步发展优化,为各种心血管疾病的治疗提供了一种新的治疗方法。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Anderson KM, Odell PM, Wilson PW, Kannel WB. Cardiovascular disease risk profiles. Am Heart J 1991, 121(1 Pt 2):293-298.
2. Fox K, Borer JS, Camm AJ, Danchin N, Ferrari R, Lopez Sendon JL, Steg PG, Tardif JC, Tavazzi L, Tendera M et al. Resting heart rate in cardiovascular disease. J Am Coll Cardiol 2007, 50(9):823-830.
3. Stein AB, Guo Y, Tan W, Wu WJ, Zhu X, Li Q, Luo C, Dawn B, Johnson TR, Motterlini R et al. Administration of a CO-releasing molecule induces late preconditioning against myocardial infarction. J Mol Cell Cardiol 2005, 38(1):127-134.
4. Li Q, Bolli R, Qiu Y, Tang XL, Guo Y, French BA. Gene therapy with extracellular superoxide dismutase protects conscious rabbits against myocardial infarction. Circulation 2001, 103(14):1893-1898.
5. Miyamoto K, Akiyama M, Tamura F, Isomi M, Yamakawa H, Sadahiro T, Muraoka N, Kojima H, Haginiwa S, Kurotsu S et al. Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction. Cell Stem Cell 2018, 22(1):91-103 e105.
6. Berry MF, Engler AJ, Woo YJ, Pirolli TJ, Bish LT, Jayasankar V, Morine KJ, Gardner TJ, Discher DE, Sweeney HL. Mesenchymal stem cell injection after myocardial infarction improves myocardial compliance. Am J Physiol Heart Circ Physiol 2006, 290(6):H2196-2203.
7. Park H, Kim D, Cho B, Byun J, Kim YS, Ahn Y, Hur J, Oh YK, Kim J. In vivo therapeutic genome editing via CRISPR/Cas9 magnetoplexes for myocardial infarction. Biomaterials 2022, 281:121327.
8. Boon RA, Iekushi K, Lechner S, Seeger T, Fischer A, Heydt S, Kaluza D, Treguer K, Carmona G, Bonauer A et al. MicroRNA-34a regulates cardiac ageing and function. Nature 2013, 495(7439):107-110.



