技术分享:低旁切效应的高保真Cas13新变体
CRISPR-Cas系统能够在各种类型的细胞和生物体中进行基因组编辑[1]。CRISPR-Cas13是2类VI型RNA核酸内切酶,已被证明在RNA靶向方面具有高效性和特异性[2],广泛用于酵母、植物、果蝇、斑马鱼和哺乳动物中的RNA切割和随后的RNA降解。然而,Cas13蛋白激活后不仅会切割靶向RNA,同时也会切割降解周围任意非靶向RNA。这种“旁切效应”在哺乳动物细胞和个体中普遍存在[3, 4],因此限制了CRISPR-Cas13系统在体内治疗中的应用。
2022年8月,Nature Biotechnology杂志在线发表了hfCas13d和 hfCas13X两种高保真Cas13新变体,在细胞系和转基因小鼠中展现出与野生型Cas13相似的高效RNA靶向降解活性,并具有极低的旁切效应,大大提升了Cas13系统的安全性[5]。
首先,研究者建立了一个快速灵敏的双荧光报告系统来评价Cas13系统的旁切效应。将Cas13a或Cas13d与EGFP装载在一个质粒上,另一个质粒表达gRNA序列和mCherry,并将两个质粒一起共转染HEK293T细胞(图一a)。转染48小时后经流式检测显示,Cas13a或Cas13d在靶向mCherry gRNA(g1- g3)的引导下,mCherry荧光显著降低,然而EGFP荧光也显著降低(图一b),qPCR结果也证明了EGFP和mCherry的mRNA显著降低(图一d和e)。表明靶向mCherry gRNA可激活Cas13从而降解mCherry,然而瞬时过表达的EGFP也一起被降解了,具有显著的旁切效应。另外,当靶向内源基因RPL4时,EGFP和RPL4的mRNA表达也有所降低,不同gRNA的旁切效应程度有所不同(图一c和f)。以上结果表明,Cas13介导的RNA降解会在哺乳动物细胞中产生显著的旁切效应。
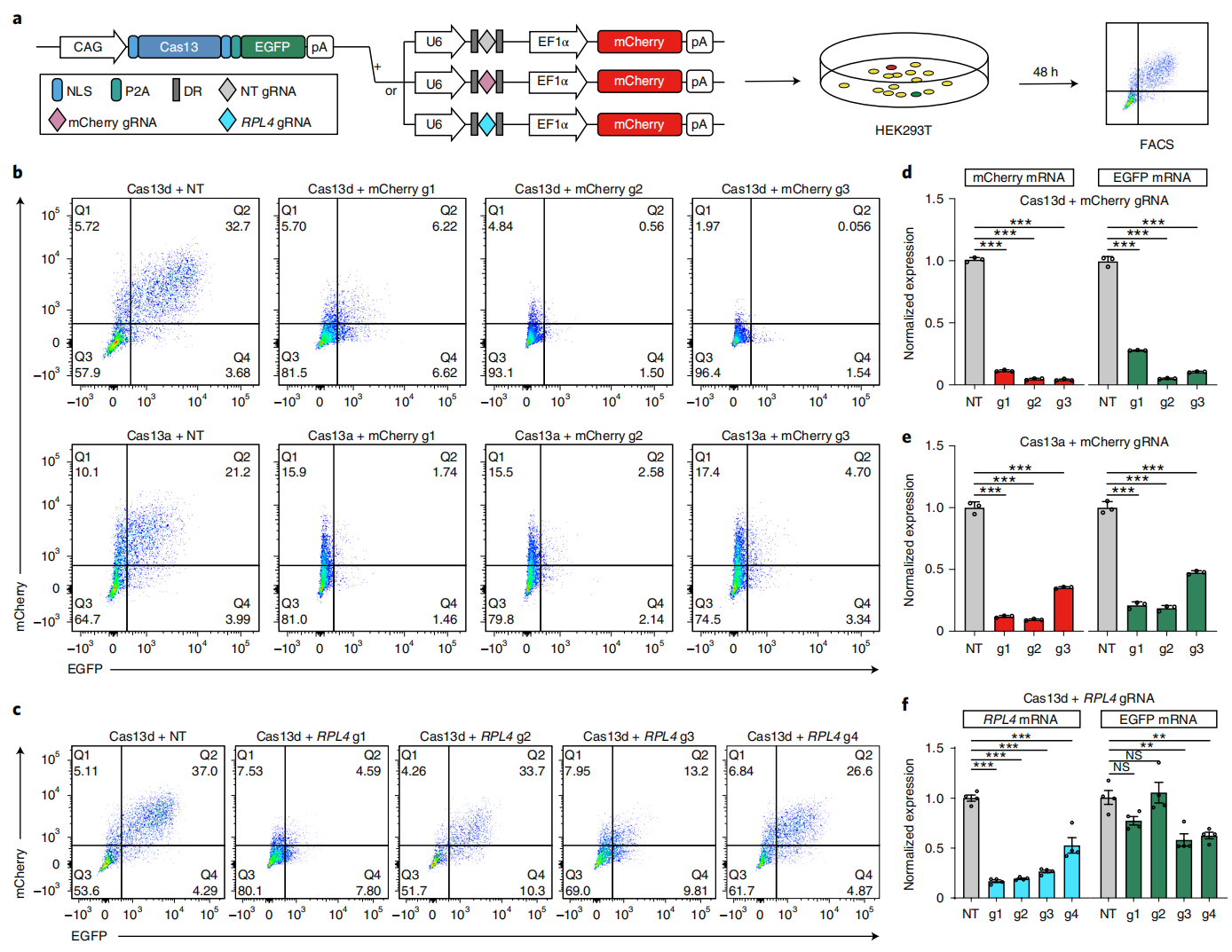
图一 双荧光报告系统评价Cas13系统的旁切效应[5]
为了消除Cas13的旁切效应,研究者通过诱变工程改造Cas13d来筛选获得无旁切效应的变体。研究者同样利用双荧光方法构建无偏筛选系统,将不同Cas13d突变体、靶向EGFP的gRNA、EGFP和mCherry装载在一个质粒上,在瞬转单个质粒后利用流式筛选具有高靶向性(低EGFP荧光)和低旁切效应(高mCherry荧光)的变体(图二a)。基于Cas13的结构分析和生化表征,研究者选择HEPN结构域中靠近RxxxxH催化位点的RNA结合裂隙(图二b)进行设计并生成包含100多个Cas13d 变体的诱变文库,每个变体都包含21个片段之一的突变(图二c)。实验结果显示,在N1、N2、N3或N15片段中,特别是N1V7、N2V7、N2V8、N3V7和N15V4变体,表现出相对较低的EGFP阳性细胞比例和较高的mCherry阳性细胞比例,表明这些变体具有高靶向活性和低旁切活性(图二d和 f)。其中,具有四个突变位点的Cas13d-N2V8变体在靶向RNA降解方面具有最高的特异性(图二e),被命名为高保真Cas13d(hfCas13d)。体外切割实验显示,与Cas13d相比,hfCas13d系统在不同浓度下的旁切活性均明显降低(图二g和h),即使hfCas13d和高浓度gRNA长时间孵育,旁切活性也非常低(图二i)。以上结果表明,与野生型Cas13d 相比,hfCas13d的旁切活性显著降低,同时保留了高靶向活性。
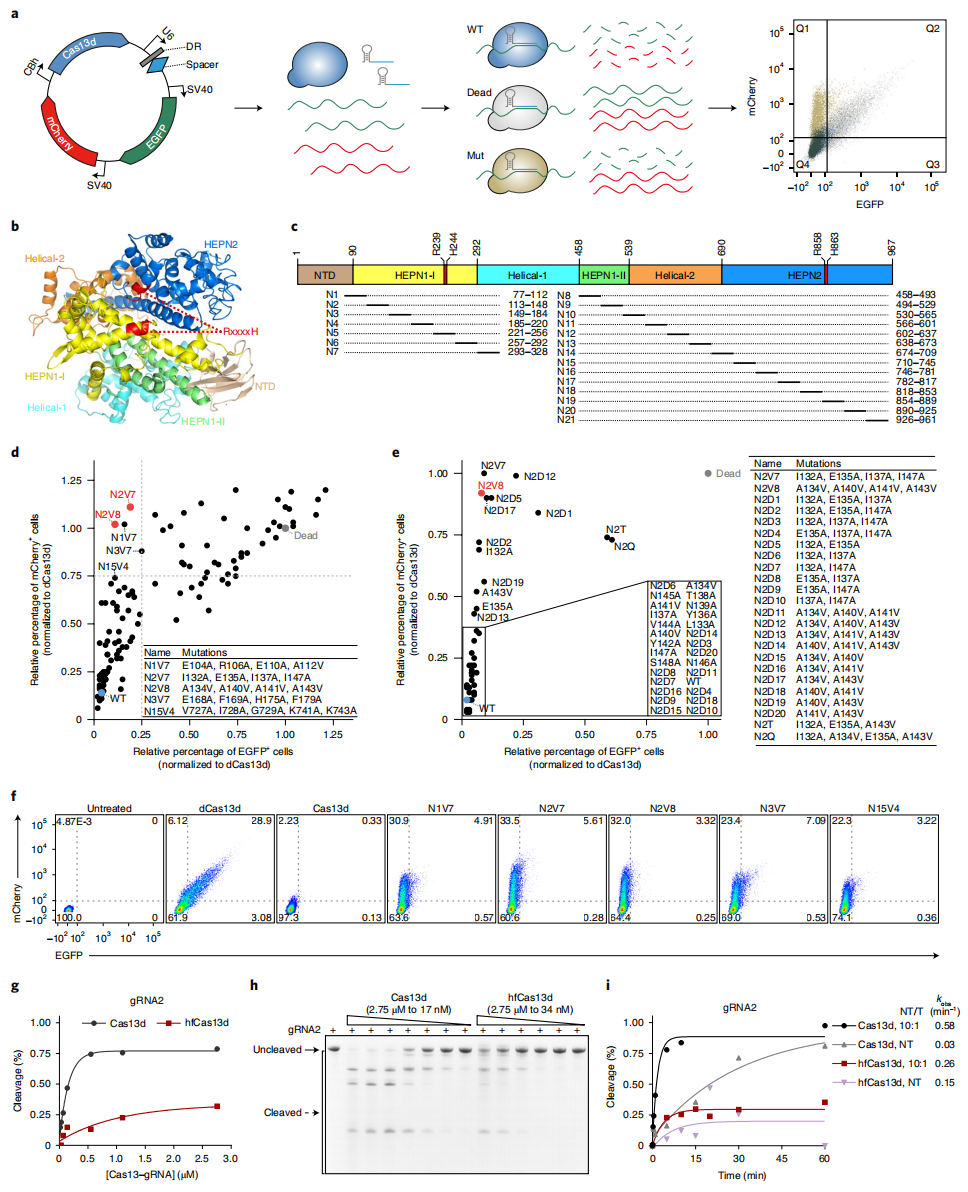
图二 诱变筛选获得低旁切活性的Cas13d突变体[5]
研究者进一步评价hfCas13d在内源基因RNA降解中的旁切效应。选择23个具有不同功能和表达水平的内源基因进行测试,每个基因设计了1-7个gRNA(图三a),构建含有Cas13d或hfCas13d、靶向内源基因的gRNA、EGFP和mCherry的单个质粒转染HEK293细胞。结果发现,当内源靶基因的表达水平较高时,Cas13d会诱导出更多的旁切效应(图三b和 c),相比之下,hfCas13d几乎没有旁切效应(图三d和e);qPCR结果显示,与Cas13d 相比,尽管hfCas13d的靶向RNA降解效率略有下降,但仍然表现出对靶向RNA的高效降解(图三f-i)。以上结果表明,Cas13d介导的旁切效应与内源基因的转录水平呈正相关,而hfCas13d几乎没有旁切效应且保留有高效靶向活性。
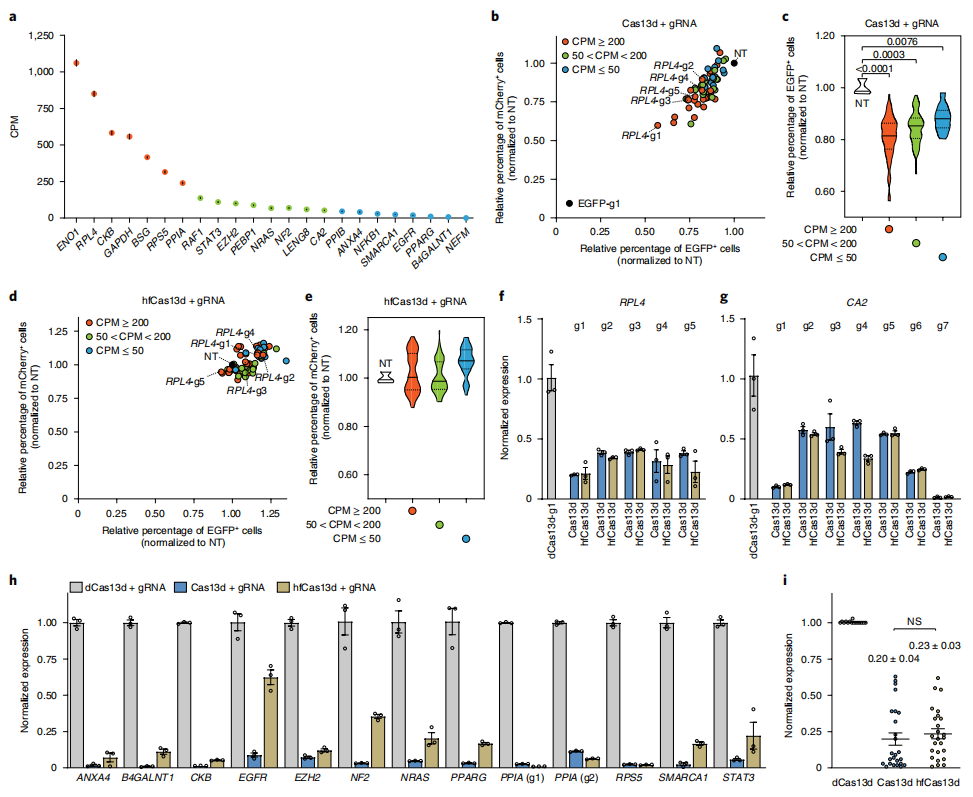
图三 hfCas13d在HEK293细胞中具有高效、特异的靶向活性[5]
接下来,研究者评价Cas13d的旁切效应对细胞与个体功能的影响。先建立了强力霉素(DOX)诱导的稳定细胞系,用于Cas13d或hfCas13d介导RPL4 RNA降解(图四a)。经过DOX处理,Cas13d组和hfCas13d组的RPL4 mRNA水平显著减少,但Cas13d组的细胞表现出明显的生长迟缓,而hfCas13d组细胞的生长不受影响(图四b-f)。表明Cas13d的旁切效应导致了严重的细胞生长迟缓,而hfCas13d由于几乎没有旁切效应,不会影响细胞生长。研究者进一步研究Cas13d的在体旁切效应,将包含Cas13d或hfCas13d、靶向Tyr基因的gRNA、EGFP的转座子质粒载体与转座酶mRNA一起注入小鼠受精卵中,获得的F0代转基因小鼠与野生型C57小鼠进行杂交(图四g)。在F1代小鼠中观察到表达Tyr gRNA的小鼠毛色具有白化表型(图四h),Tyr mRNA确实被显著降低(图四 j),表明Cas13d 和hfCas13d都具有在体RNA靶向活性。小鼠生存曲线分析显示,单独携带Cas13d的小鼠和携带Cas13d、Tyr gRNA的小鼠存活都没有超过8周,并且携带Tyr gRNA的Cas13d小鼠生存率更低(图四 i);相比之下,携带Tyr gRNA的hfCas13d小鼠都能存活到成年且无观测到异常(图四h和i)。另外,三种转基因小鼠的插入拷贝数没有显著差异(图四k)。以上在体数据表明,Cas13d本身存在脱靶致死现象,受靶向gRNA激活后,其旁切效应会引起更严重的致死反应,而hfCas13d可以消除这些不良反应。
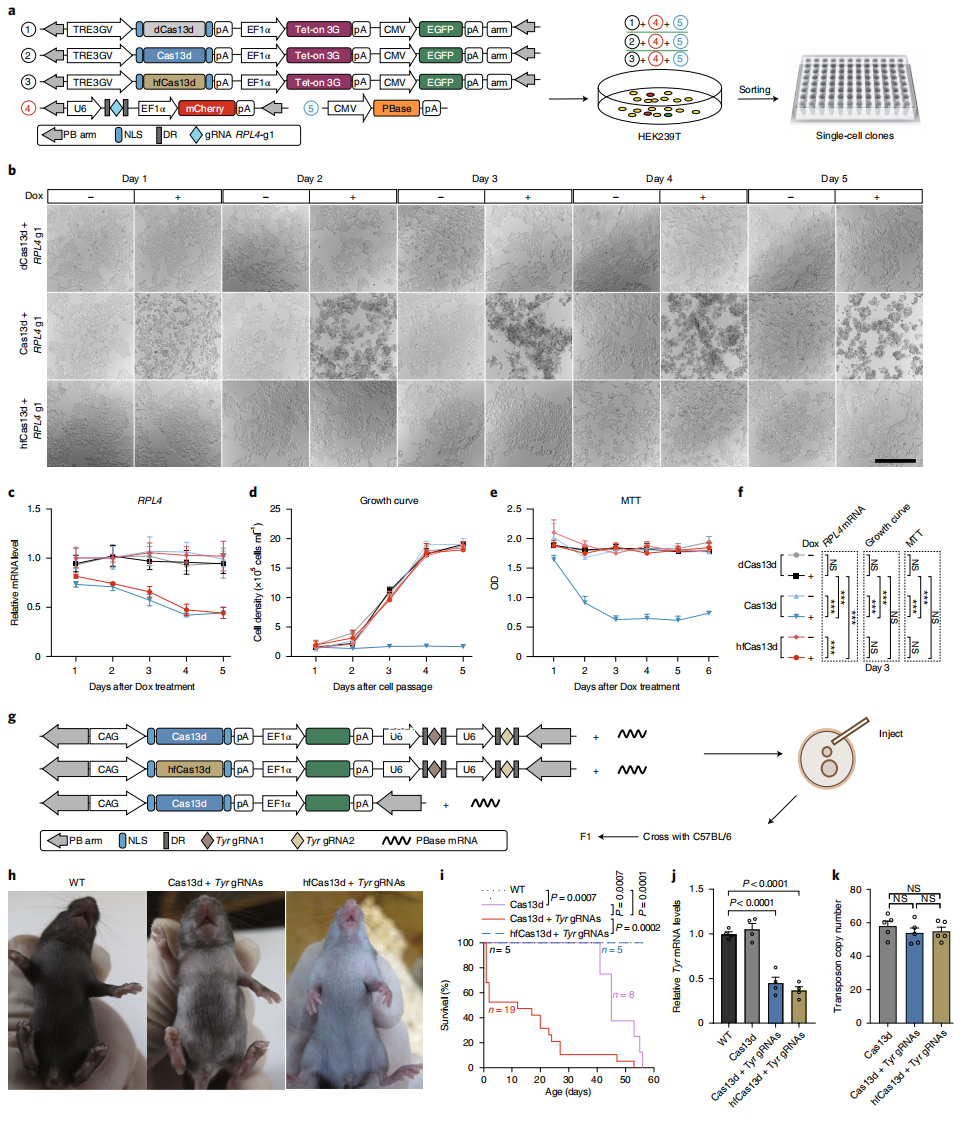
图四 hfCas13d可在细胞以及在体水平上消除旁切效应[5]
综上所述,研究者通过诱变Cas13d开发的hfCas13d,在细胞和个体水平均保留有高靶向RNA切割活性,并且具有低旁切活性。基于hfCas13d的成功筛选,研究者利用同样诱变方法对Cas13X也进行了升级改造,最终获得低旁切活性的hfCas13X(Cas13X-M17YY)。hfCas13d和hfCas13X显著提升了Cas13系统的应用性和安全性,在基于RNA编辑的基因治疗领域和未来的临床转化应用中展现出巨大的应用潜力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Pickar-Oliver A, Gersbach CA. The next generation of CRISPR-Cas technologies and applications. Nature reviews Molecular cell biology 2019, 20(8):490-507.
2. Abudayyeh OO, Gootenberg JS, Essletzbichler P, Han S, Joung J, Belanto JJ, Verdine V, Cox DBT, Kellner MJ, Regev A et al. RNA targeting with CRISPR-Cas13. Nature 2017, 550(7675):280-284.
3. Wang Q, Liu X, Zhou J, Yang C, Wang G, Tan Y, Wu Y, Zhang S, Yi K, Kang C. The CRISPR-Cas13a Gene-Editing System Induces Collateral Cleavage of RNA in Glioma Cells. Advanced science (Weinheim, Baden-Wurttemberg, Germany) 2019, 6(20):1901299.
4. Ai Y, Liang D, Wilusz JE. CRISPR/Cas13 effectors have differing extents of off-target effects that limit their utility in eukaryotic cells. Nucleic acids research 2022, 50(11):e65.
5. Tong H, Huang J, Xiao Q, He B, Dong X, Liu Y, Yang X, Han D, Wang Z, Wang X et al. High-fidelity Cas13 variants for targeted RNA degradation with minimal collateral effects. Nature biotechnology 2022.



