技术分享:在体蛋白质组学研究新方法——细胞特异性生物素标记
蛋白质组学研究(proteomics)是指系统研究某一特定时间、特定条件下,某一种特定组织细胞中所表达的所有蛋白质,包括组成蛋白质一级结构的氨基酸序列,蛋白质的丰度,蛋白质的修饰以及蛋白质之间的相互作用等。大脑由不同细胞类型组成,包括神经元、胶质细胞和血管细胞等。脑细胞类型在发育、衰老等生理过程和病理状态中表现出复杂而细微的DNA、mRNA、蛋白质分子组成变化[1]。描绘不同脑细胞类型的蛋白质组学特征可以为发育、衰老和神经病理学的细胞机制提供重要启示。
蛋白质组学研究通常需要从不同时期的组织中分离出特定细胞类群进行研究,这就会带来一些局限性,例如某些细胞分离困难、细胞获得量少、细胞间污染、细胞处理过程的人为激活等。因此,在体细胞特异性标记技术可以避免细胞分离这一步骤,更好地分析在体细胞的蛋白质组学。使用工程生物素连接酶的邻近标记方法(proximity labeling, PL)是研究活细胞内互作蛋白质组和亚细胞结构蛋白质组的重要技术[2]。该方法的原理是将一个具有特定催化连接活性的工具酶如TurboID与目的蛋白质融合, 通过添加小分子底物如生物素, 在TurboID的催化作用下生物素被活化并共价连接到TurboID邻近的内源蛋白质上, 被标记的蛋白质经富集后进行质谱分析, 可鉴定出目的蛋白质的互作或邻近的蛋白质信息[3]。但由于缺乏合适的小鼠模型,使得在体利用TurboID标记特异性细胞的蛋白质组学研究受到限制。
2022年5月,Nature Communications上描述了一种细胞类型特异性表达TurboID的小鼠模型,可用于在体蛋白质的生物素化标记,称为细胞特异性在体蛋白质生物素化(CIBOP)[4]。研究者利用该小鼠模型对海马泛神经元的蛋白质进行标记,定量了2000多种神经元蛋白质,这些蛋白质涵盖突触蛋白、转运蛋白、离子通道和疾病相关药物靶点等。同时对比了Camk2a神经元和Aldh1l1星形胶质细胞的蛋白质组,鉴定出这两种细胞类群中大脑区域特异性蛋白质组的差异,并揭示了神经元和星形胶质细胞来源的特异性信号磷酸蛋白和细胞因子。
首先,研究者构建了Cre依赖启动TurboID表达的小鼠,即Rosa26TurboID小鼠,将LSL-TurboID元件插入小鼠的Rosa26基因座(图一a)。为了测试其生物素标记效果,研究者将携带hSyn启动子表达Cre重组酶的AAV9(AAV9-hSyn-Cre)定向注射到3月龄Rosa26TurboID/wt小鼠双侧海马体中,使得泛神经元表达TurboID。4周后,给小鼠喂食生物素[5],持续喂食2周后进行检测(图一b)。免疫荧光成像结果显示大多数海马CA2/3神经元(NeuN)的生物素化(BIOTIN)(图一c);蛋白质印迹分析前脑裂解物证实Rosa26TurboID/wt/hSyn小鼠中TurboID的表达(V5)和蛋白质生物素化(图一d和e)。通过无标记定量质谱(LFQ-MS)分析富集后的生物素化蛋白质,共定量到2307种蛋白质,其中显著高于2倍富集的蛋白质有2143种(图一f);经基因集富集分析(GSEA),它们主要富集在神经元投射和突触结构,还有细胞骨架、底物特异转运等多种分子功能(图一g);它们的细胞定位涵盖了整个细胞蛋白质组,没有偏向于特定的亚细胞区室(图一h)。以上结果表明,Rosa26TurboID小鼠可以细胞特异性在体生物素化标记蛋白质,无需分离细胞,直接用于蛋白质组分析。
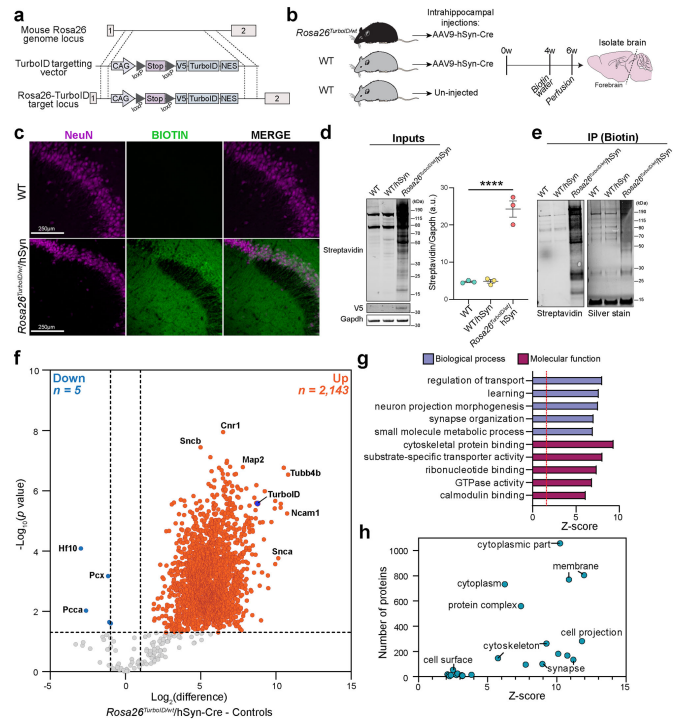
图一 Rosa26TurboID小鼠开发及其细胞特异性在体生物素标记蛋白质验证[4]
接下来,研究者将Rosa26TurboID/wt小鼠与Camk2a-CreErt2转基因小鼠[6]交配,测试能否实现Camk2a神经元特异性生物素化标记蛋白质。给6周龄Rosa26TurboID/wt/Camk2a小鼠腹腔注射他莫昔芬,4周后持续喂食2周生物素再进行检测(图二a)。分别对不同大脑区域(皮质、海马、纹状体/丘脑、脑桥/髓质和小脑)进行蛋白质印迹分析和免疫荧光成像,结果显示TurboID的表达(V5)以及蛋白质的生物素化标记(图二b和c);Map2与生物素的免疫荧光共定位证实整个海马体的神经元特异性标记(图二d);且电生理学研究表明TurboID表达和蛋白质生物素化没有影响Camk2a神经元的功能(图二e和f)。上述结果表明利用转基因策略(Tg-CIBOP)构建的Rosa26TurboID/wt/Camk2a小鼠可用于神经元特异性蛋白质的在体生物素标记,同时结合质谱(LFQ-MS)、主成分分析 (PCA) 和基因集富集分析(GSEA)等方法能够全面表征成体小鼠大脑中Camk2a神经元的蛋白质组,解析不同脑区(皮质、海马、纹状体/丘脑、脑桥/髓质和小脑)的Camk2a神经元的蛋白质组区域性差异。
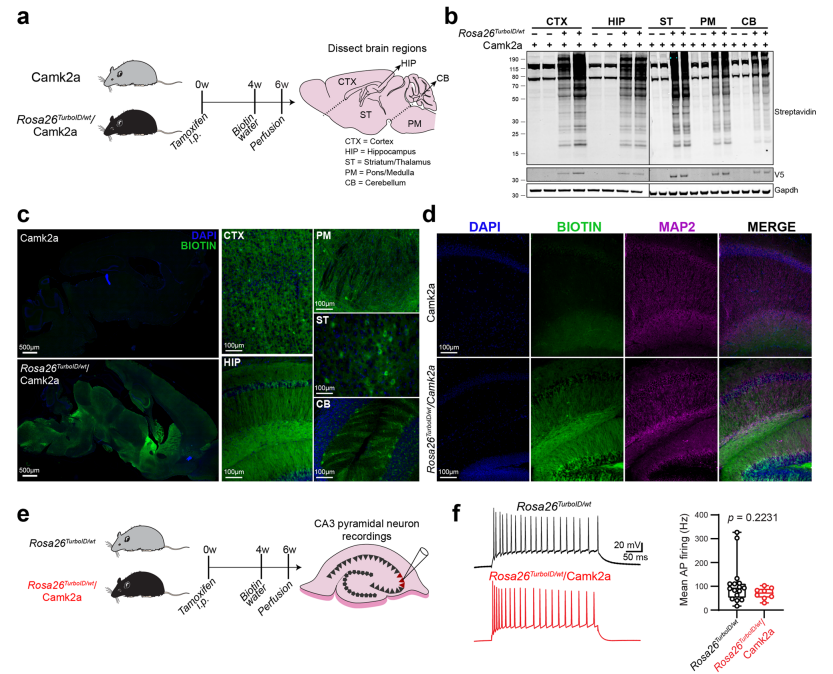
图二 成体小鼠大脑Camk2a神经元的特异性生物素标记[4]
最后,研究者同样利用Tg-CIBOP策略交配获得Rosa26TurboID/wt/Aldh1l1小鼠来特异性标记Aldh1l1星形胶质细胞(图三a)。Rosa26TurboID/wt/Aldh1l1小鼠与Rosa26TurboID/wt/Camk2a小鼠相比,两种小鼠在相同脑区具有不同的生物素化蛋白质模式,后者显示出更高程度的生物素标记(图三b和c)。Rosa26TurboID/wt/Aldh1l1小鼠大脑的生物素化与GFAP和NDRG2阳性的星形胶质细胞显示共定位(图三d),与β3TUB阳性神经元和IBA1阳性小胶质细胞没有共定位(图三e),表明该小鼠可用于星形胶质细胞特异性的蛋白质生物素标记。经数据分析,显著高于2倍富集的星形胶质细胞特异性蛋白质有1380种,将其中显著高于其他脑区4倍富集的蛋白质进行聚类分析,获得星形胶质细胞在特定脑区区域的特异性蛋白质,并描绘了在皮质/海马和小脑脑区的核心蛋白质网络(图三f)。进一步对脑区特异性星形胶质细胞蛋白质进行GSEA分析,显示小脑区域主要富集在代谢过程,皮质/海马区域主要富集在谷氨酸受体和离子通道活性,脑桥/髓质区域主要富集在微管和钙调蛋白结合,和脊髓区域主要富集在蛋白质异二聚化和细胞外基质(图三g)。通过比较Rosa26TurboID/wt/Aldh1l1小鼠与Rosa26TurboID/wt/Camk2a小鼠脑区的蛋白质组,获得细胞类型特异性差异蛋白质共1061种,其中925种蛋白质在星形胶质细胞中特异性高表达,136种在神经元中特异性高表达(图三h),并对其进行GSEA分析(图三i)。对磷酸化蛋白质进行分析发现,星形胶质细胞中的丰度显著低于神经元(图三j),表明在小鼠正常生理下,Camk2a神经元的MAPK和Akt/mTOR信号活性更强。以上数据表明,利用Tg-CIBOP策略以及细胞特异性Cre工具鼠,可以对细胞特异性的蛋白质进行生物素标记,从而描绘特定细胞类型天然状态下的蛋白质组学特征。
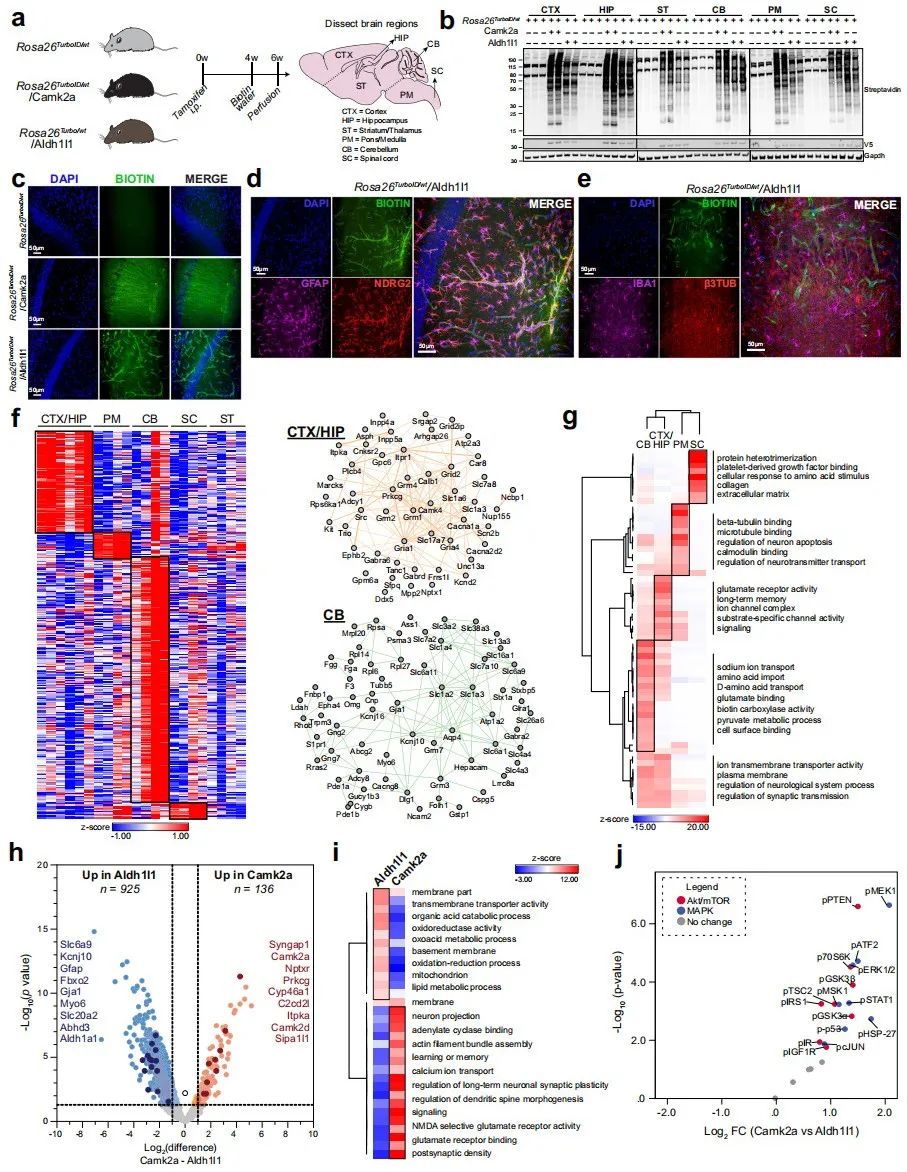
图三 在体生物素标记揭示星形胶质细胞的区域特异性蛋白质组学特征及其与Camk2a神经元的差异[4]
综上所述,研究者构建的Rosa26TurboID工具小鼠,利用Tg-CIBOP策略,可细胞特异性生物素标记在体蛋白质,无需分离细胞,直接用于天然状态下的蛋白质组研究,使得研究更为简便与精确。研究者举例展示了神经元和星形胶质细胞特异性蛋白质的生物素标记,描绘了它们的蛋白质组特征,并分析比较获得差异蛋白质。这些天然状态下的蛋白质组数据,丰富了神经科学领域的重要资源,为生理或病理状态下的细胞机制研究提供重要线索。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. De Strooper B, Karran E. The Cellular Phase of Alzheimer's Disease. Cell 2016, 164(4):603-615.
2. Branon TC, Bosch JA, Sanchez AD, Udeshi ND, Svinkina T, Carr SA, Feldman JL, Perrimon N, Ting AY. Efficient proximity labeling in living cells and organisms with TurboID. Nat Biotechnol 2018, 36(9):880-887.
3. Cho KF, Branon TC, Udeshi ND, Myers SA, Carr SA, Ting AY. Proximity labeling in mammalian cells with TurboID and split-TurboID. Nat Protoc 2020, 15(12):3971-3999.
4. Rayaprolu S, Bitarafan S, Santiago JV, Betarbet R, Sunna S, Cheng L, Xiao H, Nelson RS, Kumar P, Bagchi P et al. Cell type-specific biotin labeling in vivo resolves regional neuronal and astrocyte proteomic differences in mouse brain. Nature communications 2022, 13(1):2927.
5. Riveron-Negrete L, Fernandez-Mejia C. Pharmacological Effects of Biotin in Animals. Mini reviews in medicinal chemistry 2017, 17(6):529-540.
6. Harris JA, Hirokawa KE, Sorensen SA, Gu H, Mills M, Ng LL, Bohn P, Mortrud M, Ouellette B, Kidney J et al. Anatomical characterization of Cre driver mice for neural circuit mapping and manipulation. Frontiers in neural circuits 2014, 8:76.



