技术分享:Spacer-nick设计可实现精准基因修复并显著减少脱靶和非预期靶向突变
CRISPR-Cas9基因编辑技术是一种强大的基因编辑工具,Cas9蛋白酶在sgRNA的引导下靶向基因组DNA进行切割,形成双链断裂(DSBs),同源定向修复(HDR)可以精准地完成损伤后的修复[1],但其仍存在脱靶效应。目前,降低脱靶效应的方法主要有两种,一种是设计高特异性sgRNA[2]或截短sgRNA[3]或在sgRNA 5’端添加两个鸟嘌呤碱基[4];另一种是使用高保真的SpCas9突变体[5]或是Cas9切口酶。此前,Ran和Mali等人[6, 7]报道利用Cas9 D10A切口酶(Cas9n)在两个相距38-68 bp的sgRNA引导下,分别切割靶点两侧的DNA双链各生成一个单链切口,从而构成双切口(double-nick)。该方法虽然可以将脱靶效应降低50-1000倍,但仍然导致频繁的靶基因插入、缺失和无义突变。
2022年6月,Science advances在线发表了一种精准基因修复方法,称为spacer-nick系统,通过将Cas9n和一对以200-350 bp间隔距离的sgRNA相结合,可以实现精确且安全的基因校正,最大限度地减少脱靶和非预期靶向突变[8]。结合AAV6递送的供体模板,该系统在人类造血干细胞和祖细胞(HSPCs)以及T细胞中实现了有效的HDR修复,可达到20%- 50%的基因校正效率,并最大限度地减少了非同源末端连接(NHEJ)介导的非预期靶向突变。
为了量化spacer-nick系统的HDR和NHEJ效率,研究者首先在HSPCs和T细胞中设计了一种靶向报告系统。在人B2M和CD48基因的最后一个外显子处插入荧光标记蛋白mCherry的编码序列,并且在终止密码子附近分别设计sgB2M-1和sgCD48-2(图一A和B,红色三角表示)。同时分别设计与sgB2M-1、sgCD48-2相距不同距离的多个sgRNA(图一A和B,蓝色三角表示)。研究者将含有Cas9和一个或两个sgRNA组成的核糖核蛋白复合物(RNPs)、Cas9n和一对sgRNA组成的RNPs分别电穿孔转染到HSPCs和T细胞,随后通过AAV6递送各自的donor供体模板至细胞。通过流式检测荧光标记蛋白mCherry表达,发现sgRNA之间距离的增加与HDR效率呈现负相关(图一C-F)。通过对HSPCs细胞的基因组目标序列扩增测序分析,发现Cas9n(double-nick)组和Cas9对照组存在约40%(B2M)和30%(CD48)左右的NHEJ效率,而实验组Cas9n(spacer-nick)在两个sgRNA相距大于200 bp时,几乎完全采用HDR(图一G和H)。以上数据表明,spacer-nick系统可以在人类HSPCs和T细胞中介导高效的HDR和低靶向NHEJ。
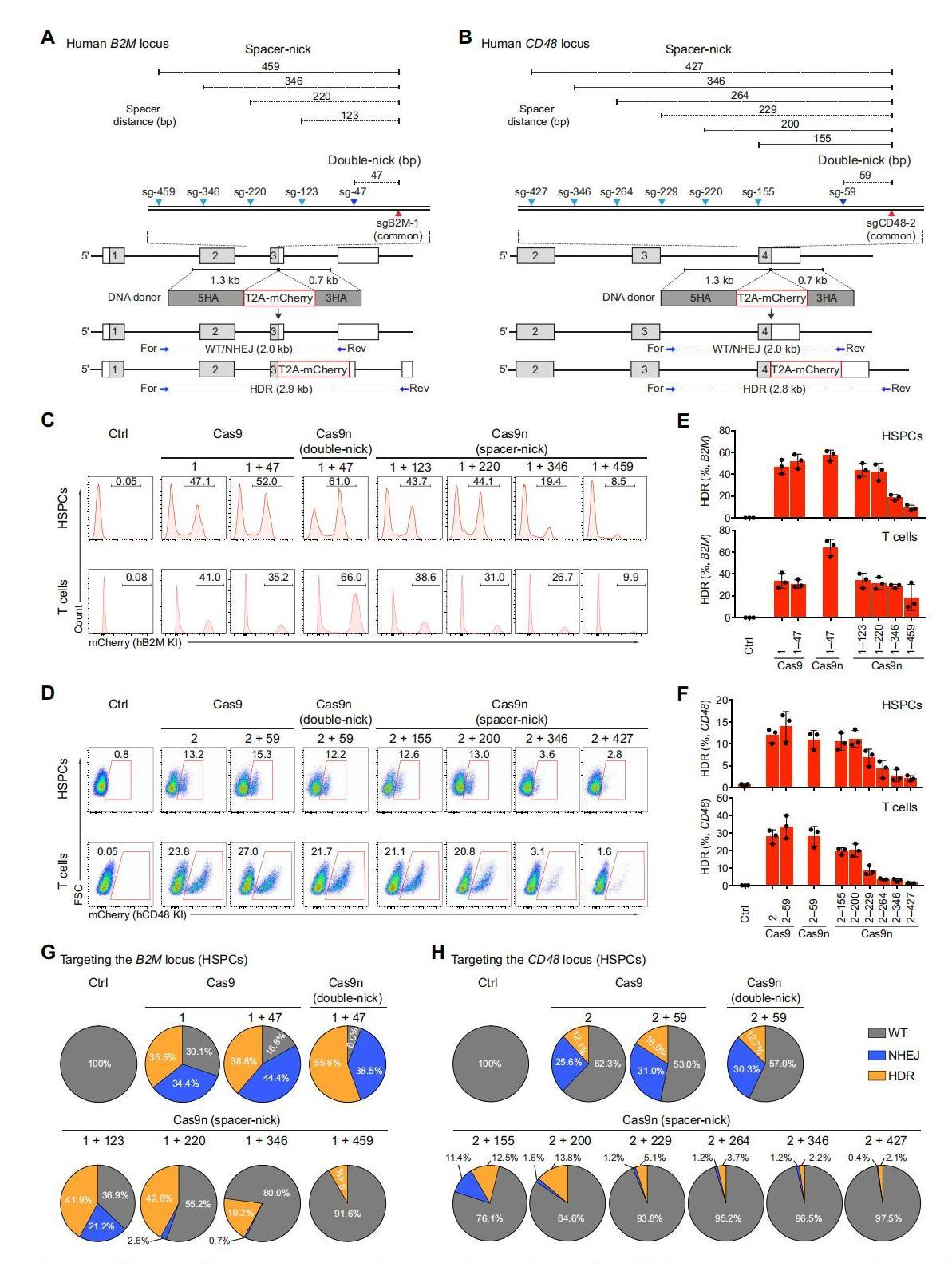
图一 spacer-nick系统在HSPCs和T细胞中介导高效HDR和最小化NHEJ事件[8]
随后,研究者选择在原代免疫细胞临床相关位点上测试spacer-nick系统。针对HBB、ELANE、IL7R和 PRF1基因中的已知突变设计sgRNA,选择距离为200-350 bp的最有效的一对sgRNA用于HSPCs和T细胞中的基因校正(图二A)。将基于AAV6的donor供体模板与RNPs共同递送至细胞(图二B)。与B2M/CD48的发现一致,Cas9n(spacer-nick)实验组和Cas9组在所有目标位点都能产生有效的HDR,并且spacer-nick组的NHEJ事件显著降低(图二B),与此同时HDR/NHEJ的比值更高(图二C)。以上数据表明,spacer-nick系统能够修复HSPCs和T细胞中多个基因的突变,并且具有最小化的非预期靶向突变。
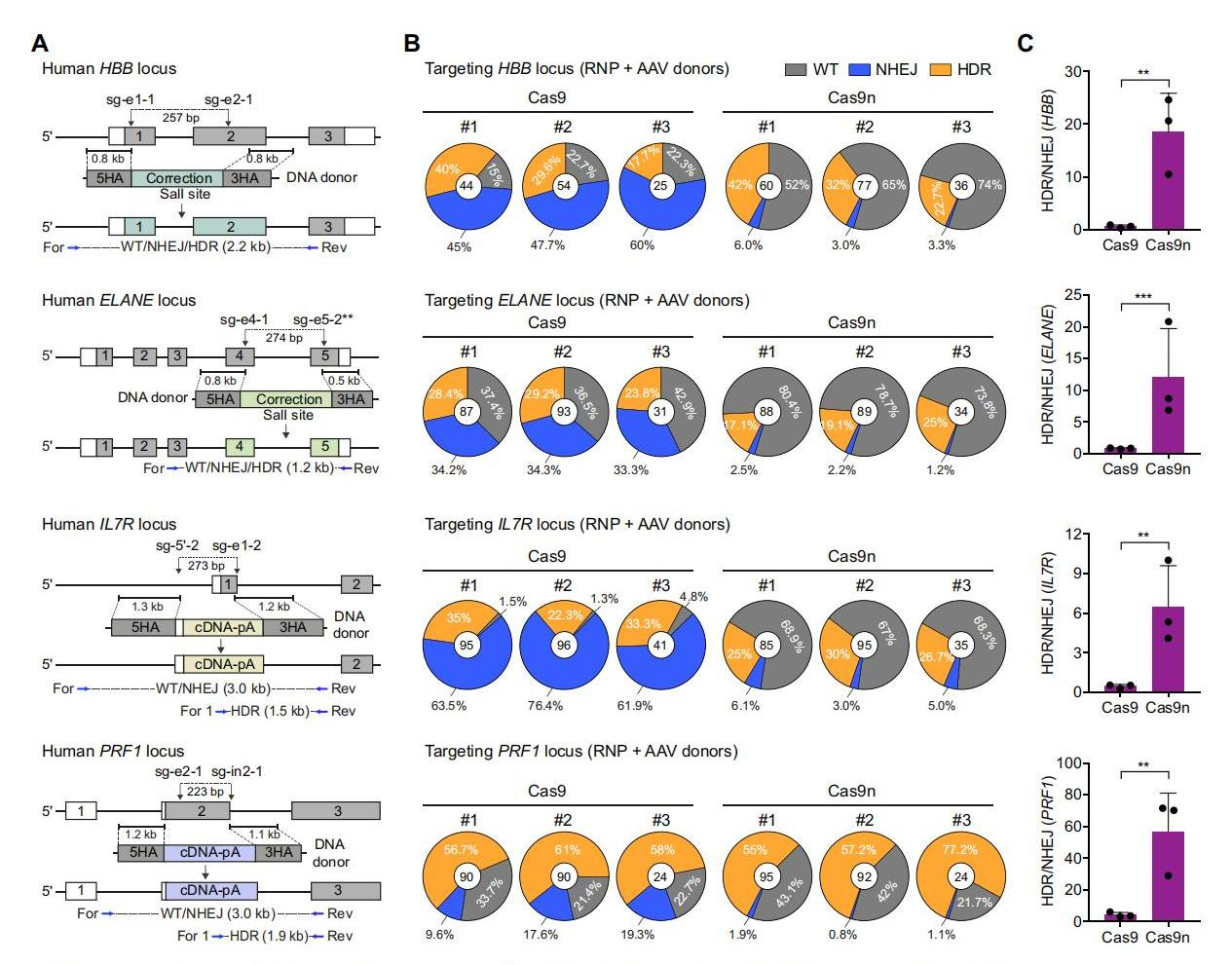
图二 spacer-nick系统可校正HSPCs细胞中多个位点的基因突变[8]
接下来,研究者在长期造血干细胞(LT-HSCs)中测试spacer-nick系统。研究者将上述针对B2M基因座的一对sgRNA(图一A)和Cas9n以及基于AAV6-B2M-mCherry供体donor递送至人源CD34+细胞。3天后,流式检测显示对照组、Cas9、double-nick和spacer-nick组的HSC群、多能祖细胞亚群MPP1和MPP2比例相似(图三A和B),且基于mCherry表达的HDR效率也相似(图三C和D)。通过Sanger测序对LT-HSCs中的HDR和NHEJ事件进行量化,结果显示三个实验组具有相似的HDR效率,但是Cas9组和double-nick组的NHEJ约为42%,而spacer-nick组的NHEJ降低了20倍以上(图三E-F)。另外,同样测试了HBB位点,也得到相似的结论(图三G-I)。以上数据表明,spacer-nick系统可实现人源LT-HSCs的精确且高效的HDR,并具有最小化的非预期靶向突变。
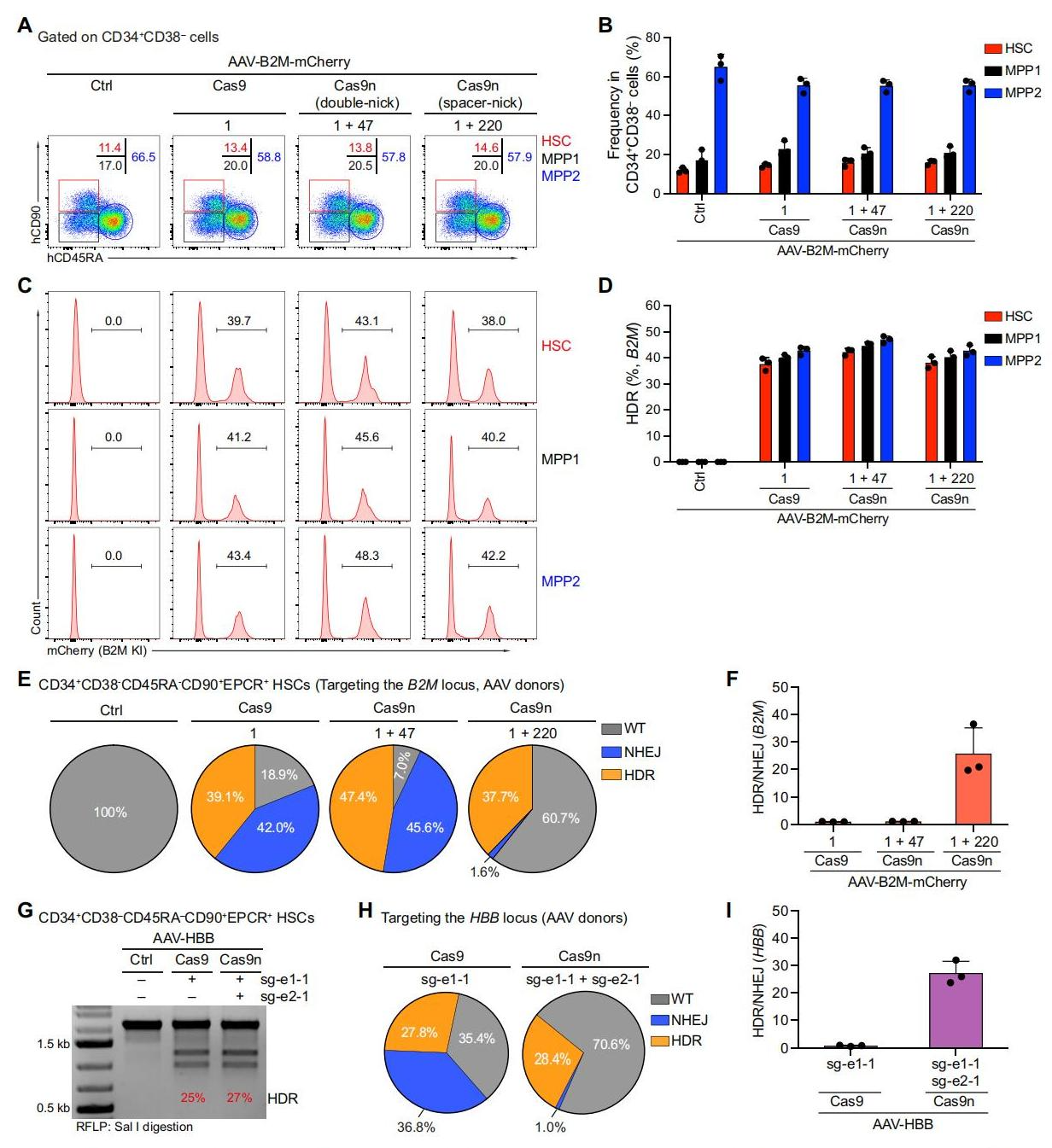
图三 spacer-nick系统在长期造血干细胞中可实现精确且高效的HDR并具有最小化的NHEJ[8]
基于spacer-nick系统实验组的NHEJ降低,研究者推测该系统有利于减少脱靶。进而对全基因组的脱靶突变进行量化,对图二处理的相关基因在没有AAV6供体模板的HSPCs中进行GUIDE-seq分析。GUIDE-seq会在DSBs处整合进双链寡脱氧核苷酸(dsODN)。结果显示,Cas9n(spacer-nick)实验组的HSPCs的目标读数显著减少约260倍,且未检测到任何的dsODN整合位点(图四A-D)。对GUIDE-seq实验中获得的基因组DNA进行扩增子深度测序,结果显示与Cas9组相比,Cas9n(spacer-nick)实验组的HSPCs在目标位点的插入或缺失事件显著减少,接近背景水平(图四E),而dsODN的整合仅存在于Cas9组的HSPCs中(图四F)。以上数据表明,spacer-nick系统显著减少不需要的靶向和全基因组范围内的脱靶突变。
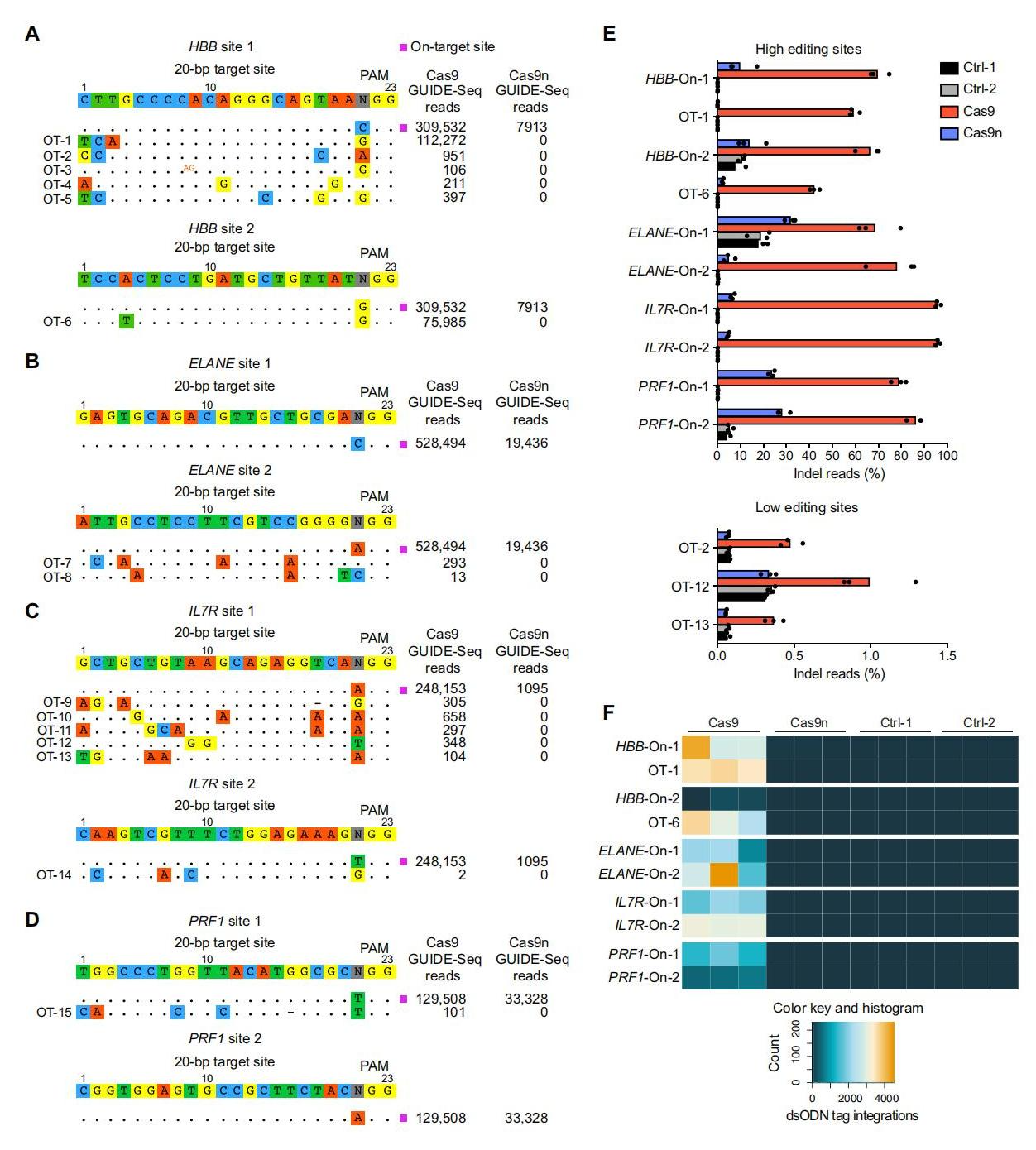
图四 spacer-nick系统可在全基因组范围内减少脱靶突变[8]
综上所述,spacer-nick系统可实现精确且高效的HDR和最小化的NHEJ,最大限度减少了脱靶和非预期靶向突变,可以修复HBB、ELANE、IL7R 和 PRF1 基因中的热点突变,在人类HSPCs和T细胞中实现高达20%-50%的基因校正。因此,这是一种安全有效的基因编辑方法。未来,spacer-nick系统可用于治疗β地中海贫血、严重的先天性中性粒细胞减少症、严重的联合免疫缺陷、家族性噬血细胞性淋巴组织细胞增多症和其他单基因血液疾病,在治疗单基因疾病方面具有巨大潜力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Chu VT, Weber T, Wefers B, Wurst W, Sander S, Rajewsky K, Kuhn R: Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nature biotechnology 2015, 33(5):543-548.
2. Akcakaya P, Bobbin ML, Guo JA, Malagon-Lopez J, Clement K, Garcia SP, Fellows MD, Porritt MJ, Firth MA, Carreras A et al: In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature 2018, 561(7723):416-419.
3. Tsai SQ, Zheng Z, Nguyen NT, Liebers M, Topkar VV, Thapar V, Wyvekens N, Khayter C, Iafrate AJ, Le LP et al: GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nature biotechnology 2015, 33(2):187-197.
4. Cho SW, Kim S, Kim Y, Kweon J, Kim HS, Bae S, Kim JS: Analysis of off-target effects of CRISPR/Cas-derived RNA-guided endonucleases and nickases. Genome research 2014, 24(1):132-141.
5. Vakulskas CA, Dever DP, Rettig GR, Turk R, Jacobi AM, Collingwood MA, Bode NM, McNeill MS, Yan SQ, Camarena J et al: A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nat Med 2018, 24(8):1216-1224.
6. Ran FA, Hsu PD, Lin CY, Gootenberg JS, Konermann S, Trevino AE, Scott DA, Inoue A, Matoba S, Zhang Y et al: Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell 2013, 154(6):1380-1389.
7. Mali P, Aach J, Stranges PB, Esvelt KM, Moosburner M, Kosuri S, Yang L, Church GM: CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nature biotechnology 2013, 31(9):833-838.
8. Tran NT, Danner E, Li X, Graf R, Lebedin M, de la Rosa K, Kuhn R, Rajewsky K, Chu VT: Precise CRISPR-Cas-mediated gene repair with minimal off-target and unintended on-target mutations in human hematopoietic stem cells. Sci Adv 2022, 8(22):eabm9106.



