技术分享:RAD51通过增强IHR显著提高纯合编辑效率
目前,CRISPR/Cas9技术成为基因编辑的首选工具。Cas9蛋白特异性切割目标DNA序列,产生DNA双链断裂(DSB),然后启动细胞内的DNA修复机制来修复DSB。DNA修复机制包括有同源重组修复(HR)和非同源末端连接(NHEJ)。利用HR修复机制,通过引入同源修复donor序列,可在DSB处引入外源DNA实现基因敲入(knockin,KI)。2016年,一项针对兔胚胎的研究表明,RS1可显著增强KI效率[1]。RS1是链交换因子RAD51的化学激动剂,而RAD51对HR至关重要。在无DNA损伤的细胞中,RAD51形成小的、酶失活的七聚环[2]。当DSB发生后,BCCIP蛋白质促进BRCA2阻断RAD51的自主装,使得RAD51富集到DSB上[3]。然后,RAD51在末端切除产生的单链突出端上形成长核丝,积极搜索同源修复序列和完成链交换[4]。
基于上述发现以及RAD51在HR修复机制中的关键作用,来自美国麻省理工学院的研究团队进一步探索RAD51在基于CRISPR/Cas9的KI事件中的作用。最终发现RAD51可以通过增强同源间修复(interhomolog repair,IHR),显著提升纯合KI效率,并用于无需外源模板的等位基因修复。该研究成果发表在2021年6月的Cell上[5]。
首先,研究者在构建自闭症相关的Chd2R1684H(c.5051G > A)点突变小鼠模型的过程中,测试添加RAD51对KI效率的影响(图一A)。Chd2R1684H小鼠是利用受精卵原核注射法来获得,利用显微注射技术将SpyCas9、crRNA、tracrRNA、ssDNA供体、以及加或不加RAD51的RNPs混合液注入受精卵原核中。重构胚胎在体外培养到桑椹胚或囊胚后进行DNA纯化、巢式PCR基因型鉴定和Sanger测序(图一B)。由于CRISPR/Cas9在小鼠受精卵发育过程中都可能进行基因编辑,该方法经常会产生基因型嵌合的个体[6]。结果显示,添加RAD51后虽然仅略微提高了获得Chd2R1684H小鼠的整体KI效率(图一C左),但是显著提高了基因型嵌合的纯合KI效率(图一C中),以及全纯合KI效率(图一C右)。研究者另外构建TyrC89S(c.265T > A)小鼠进行了同样测试(图一D),可简单通过小鼠皮肤的白化程度来快速确定F0小鼠的基因型(图一E),并经测序确定(图一F)。同样地,添加RAD51后能显著性提高基因型嵌合以及全纯合的纯合KI效率(图一G)。
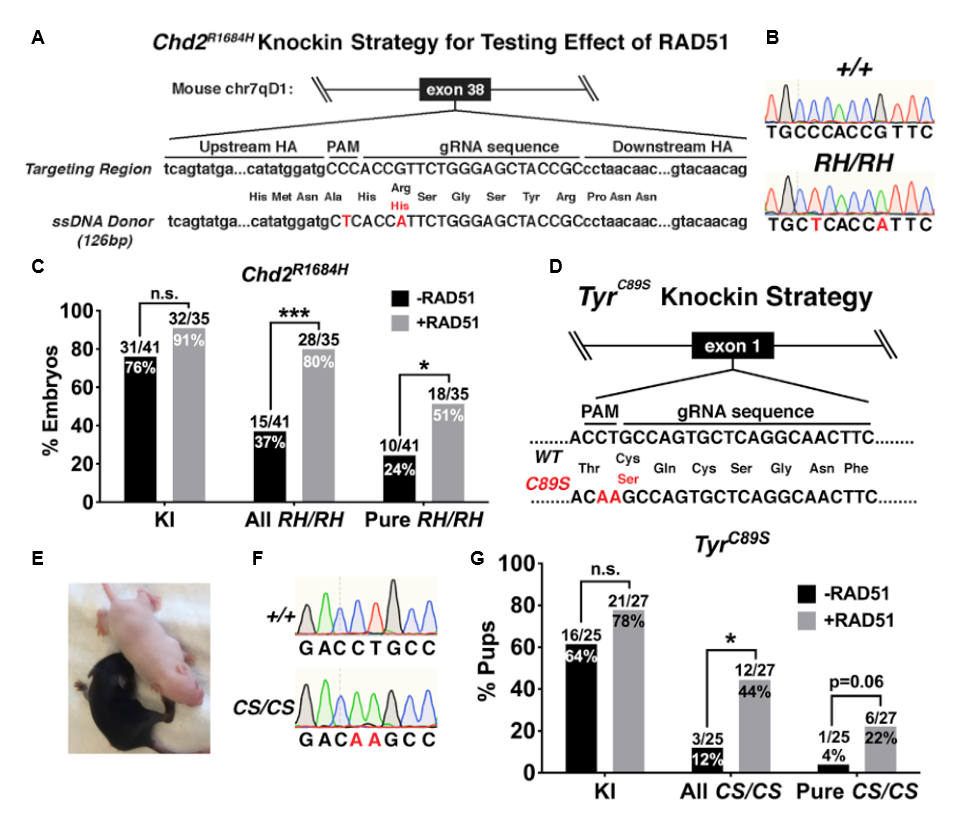
图一 RAD51可提高多个位点的纯合KI效率[5]
由于RAD51对整体KI效率的提高并不明显,而是显著增加了纯合KI效率,不仅是正确基因型还包括了错误基因型的纯合效率。有研究报道Cas9造成DNA双链断裂(DSB)后可诱发胚胎IHR[7]。IHR主要发生在减数分裂时期,是指当一条染色体发生DSB后以另一条同源染色体为模板来进行修复。由此,研究者推测RAD51可能通过IHR的方式来增加纯合KI效率,设计了不使用外源供体模板的实验来进行测试。将Chd2RH/RH的雄鼠精子与野生型卵子经体外受精获得Chd2RH/+杂合受精卵,原核注射SpyCas9、crRNA、tracrRNA、以及加或不加RAD51的RNPs混合液(图二A),获得的重构胚胎进行基因型鉴定(图二B)。结果显示,不加RAD51的Cas9基因编辑后能产生Chd2RH/RH基因型,表明确实发生了IHR;添加RAD51后可显著性增加基因型嵌合以及全纯合的IHR比例(图二C)。研究者进一步利用免疫化学成像,观测到RAD51仅在雄原核与雌原核融合后的S/G2期时凝聚成小点定位于DNA上(图二D)。经统计,RAD51小点的数目在无显微注射的情况下并不存在,随着Cas9的注射而显著性增多(图二E),提示RAD51小点的形成是DSB依赖的,可在Cas9基因编辑时添加外源RAD51来促进IHR。
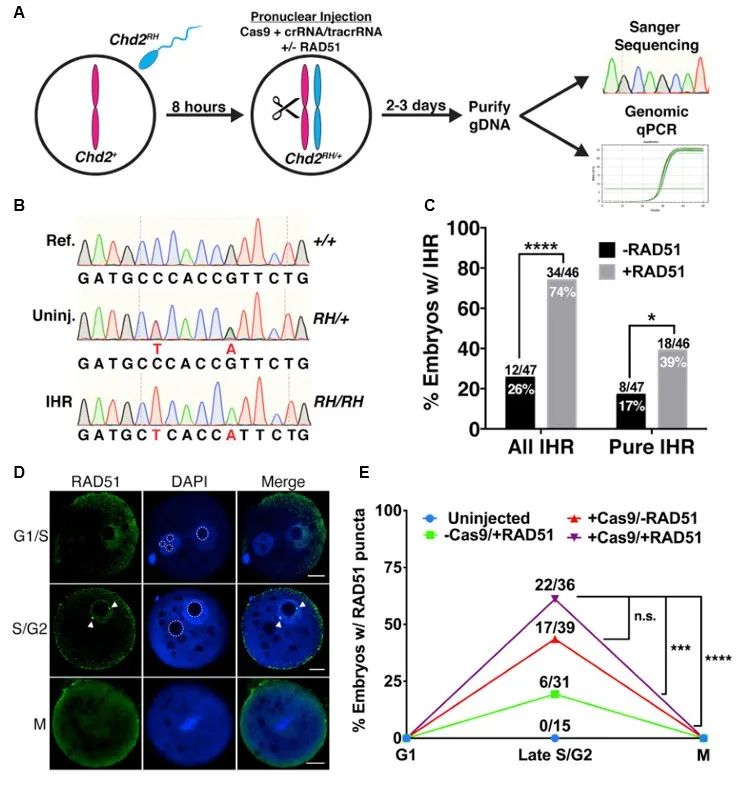
图二 RAD51可增加IHR且定位于Cas9诱导的DSB上[5]
接着,研究者在多条染色体的多个位点评价RAD51增强IHR的效果。除上述实验使用的位于小鼠7号染色体上的Chd2和Tyr基因,X染色体上的Mecp2基因、11号染色体上Acs16和1号染色体上Kcnb2基因的结果都显示,内源性IHR在早期小鼠胚胎中具有广谱活性,添加RAD51后可以进一步提高IHR比例(图三A-C)。经过TOPO克隆和测序分析切割位点的上下游基因组序列,IHR发生区域在不同编辑位点各不相同,长度总区间约1.5-3 kb(图三D)。
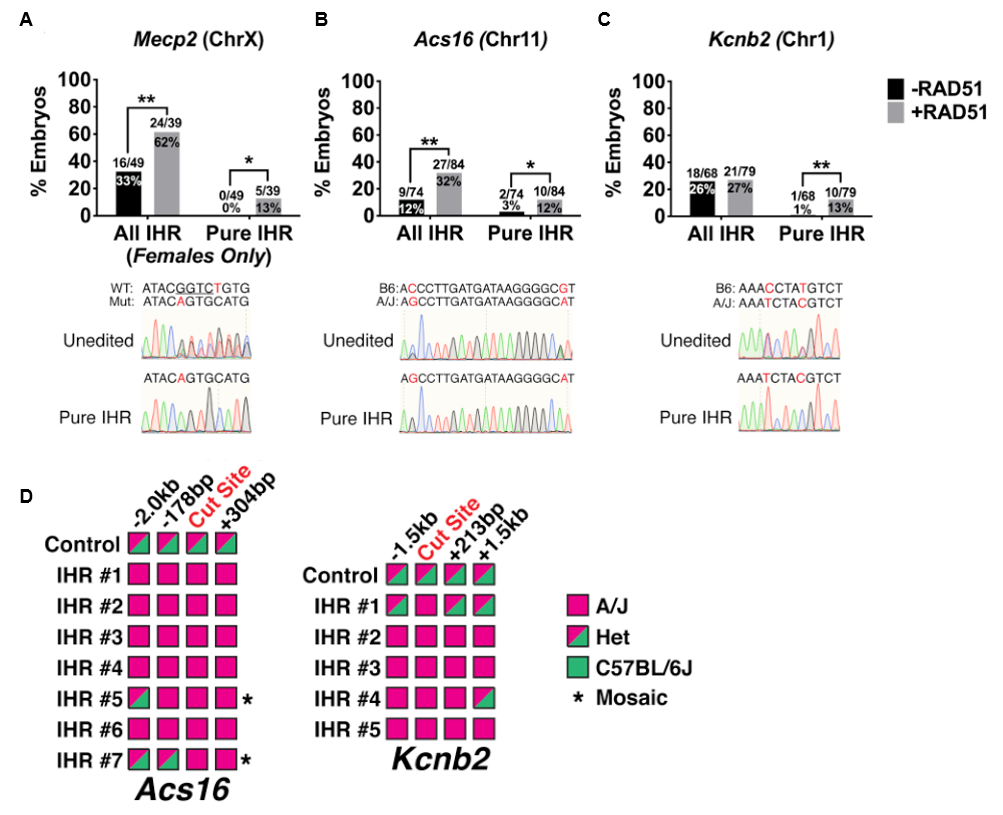
图三 RAD51增强多条染色体多个位点的IHR[5]
最后,研究者鉴定了一系列DSB修复相关蛋白是否具有增强IHR的效果。结果显示,促进HR机制的USP1/WDR48和BCCIP均能够促进IHR,而促进MMEJ的XRCC1和促进NHEJ的XRCC4均不能促进IHR。表明早期胚胎中的IHR是由典型HR途径驱动的。
综上所述,在小鼠胚胎时期,RAD51、BCCIP和USP1/WDR48可在Cas9基因编辑后产生的DSB位点上促进IHR的发生,从而显著提高纯合KI效率。这项研究可用于提高当前受精卵注射法获得纯合KI小鼠的效率,并为将来在体细胞中通过增强IHR直接修复致病突变的新型基因与细胞治疗提供了基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂的调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Song J, Yang D, Xu J, Zhu T, Chen YE, Zhang J: RS-1 enhances CRISPR/Cas9- and TALEN-mediated knock-in efficiency. Nature communications 2016, 7:10548.
2. Yu DS, Sonoda E, Takeda S, Huang CL, Pellegrini L, Blundell TL, Venkitaraman AR: Dynamic control of Rad51 recombinase by self-association and interaction with BRCA2. Molecular cell 2003, 12(4):1029-1041.
3. Lu H, Guo X, Meng X, Liu J, Allen C, Wray J, Nickoloff JA, Shen Z: The BRCA2-interacting protein BCCIP functions in RAD51 and BRCA2 focus formation and homologous recombinational repair. Molecular and cellular biology 2005, 25(5):1949-1957.
4. Krejci L, Altmannova V, Spirek M, Zhao X: Homologous recombination and its regulation. Nucleic acids research 2012, 40(13):5795-5818.
5. Wilde JJ, Aida T, Del Rosario RCH, Kaiser T, Qi P, Wienisch M, Zhang Q, Colvin S, Feng G: Efficient embryonic homozygous gene conversion via RAD51-enhanced interhomolog repair. Cell 2021, 184(12):3267-3280 e3218.
6. Jiang J, Zhao AQ, Xie T, Chen SW, Li JS: Construction of genome-wide protein tagging cell and mouse libraries. Yi chuan = Hereditas 2021, 43(7):704-714.
7. Wu Y, Liang D, Wang Y, Bai M, Tang W, Bao S, Yan Z, Li D, Li J: Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell stem cell 2013, 13(6):659-662.


