技术分享:人工设计重组酶特异性修复血友病A的基因组倒位
Tips:在“基因治疗小鼠常染色体隐性耳聋模型”技术分享中,我们介绍了利用胞嘧啶碱基编辑器(CBE)和SaCas9-KKH编辑器来基因治疗单基因致病突变。本期将分享利用人工设计的RecF8重组酶来基因治疗血友病A的大片段基因组倒位。
核酸酶基因组编辑技术在治疗单基因致病突变的基因治疗中应用广泛,但对于基因组大片段倒位的基因治疗仍存在挑战。血友病A是最常见的遗传性凝血因子缺乏性疾病,由X染色体上编码凝血因子Ⅷ(FⅧ)的F8基因缺陷导致。F8基因的1号内含子中存在1041 bp的int1h-1,与远端F8基因外约140 kb的int1h-2为同源序列,二者仅有1个错配位点(图一a)。一种重型血友病A的发病机理是由于int1h-1和int1h-2发生同源重组,导致启动子和1号外显子(E1)序列发生倒位,无法产生FⅧ[1, 2]。
2022年1月,Nature Communications发表了一篇文章,研究者通过分子定向进化技术开发了一种偶联异源二聚体重组酶RecF8/loxF8系统,可特异性修复血友病A的基因组倒位。经体外瞬转RecF8治疗由病人iPS细胞分化而来的内皮细胞,可将12%的140 kb致病倒位反转回正常,恢复约6%的FⅧ mRNA表达[3]。
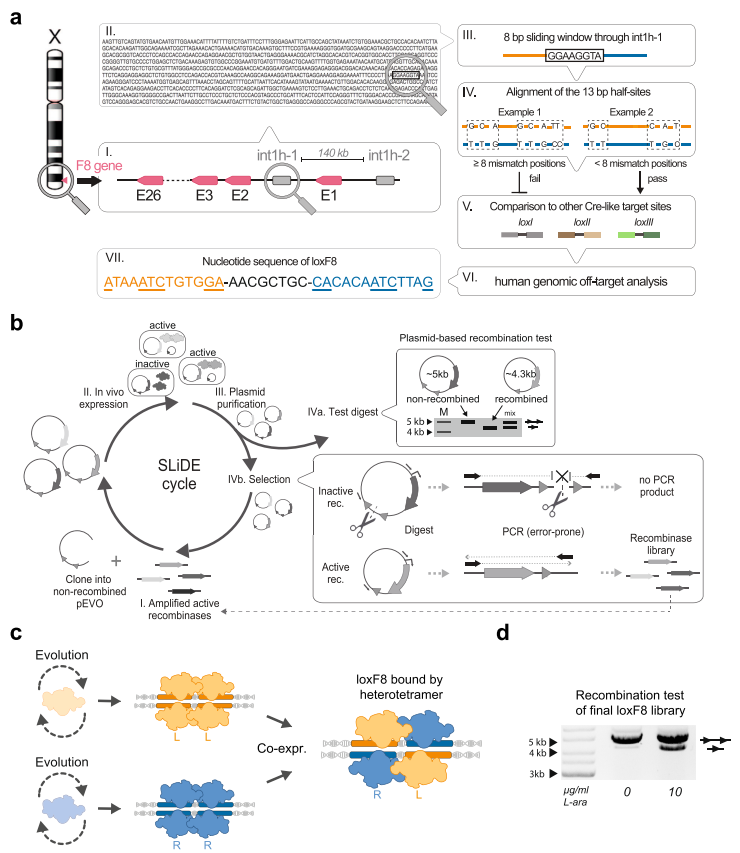
图一 构建loxF8位点特异性异源二聚体重组酶文库的示意图[3]
首先,研究者在int1h-1和int1h-2的同源序列中寻找可供位点特异性重组酶(SSRs)翻转的靶点序列。传统Cre重组酶的识别位点由8 bp的间隔序列与两侧各13 bp的反向重复序列构成,然而在int1h中不存在这种完全对称的反向重复序列。因此研究者从中寻找两侧13 bp少于8个错配位点的不完全对称序列作为潜在靶点,共计筛选出82个,并获得评分最高的仅有6个错配的loxF8位点(图一a)。接着,研究者利用SLiDE定向进化技术来快速筛选特异性识别loxF8位点的新型重组酶,通过限制性内切酶酶切以及PCR扩增可快速富集有活性的重组酶变体,并用于下一轮的定向进化(图一b)。研究者将loxF8位点两侧13 bp序列单独进行同源重组酶定向进化,分别获得各自特异性最高的重组酶。再组合成异源二聚体重组酶来评价对loxF8位点的特异性重组作用(图一c)。最后获得可特异性识别重组loxF8位点的异源二聚体重组酶文库(图一d)。
接下来,研究者对构建的异源二聚体重组酶文库在人源细胞中进行功能测试,筛选出在细胞水平耐受性良好,且对loxF8位点具有剂量依赖性最佳重组活性的D7异源二聚体重组酶(图二a)。D7/loxF8与Cre/loxP或Brec1/loxBTR系统的重组活性相当(图二b)。D7-L左单体的氨基酸序列与Cre相比有46个变化(13%),D7-R右单体有39个变化(11%)(图二c),这表明蛋白质序列的重大变化对于在新靶位点上实现高活性是必要的。
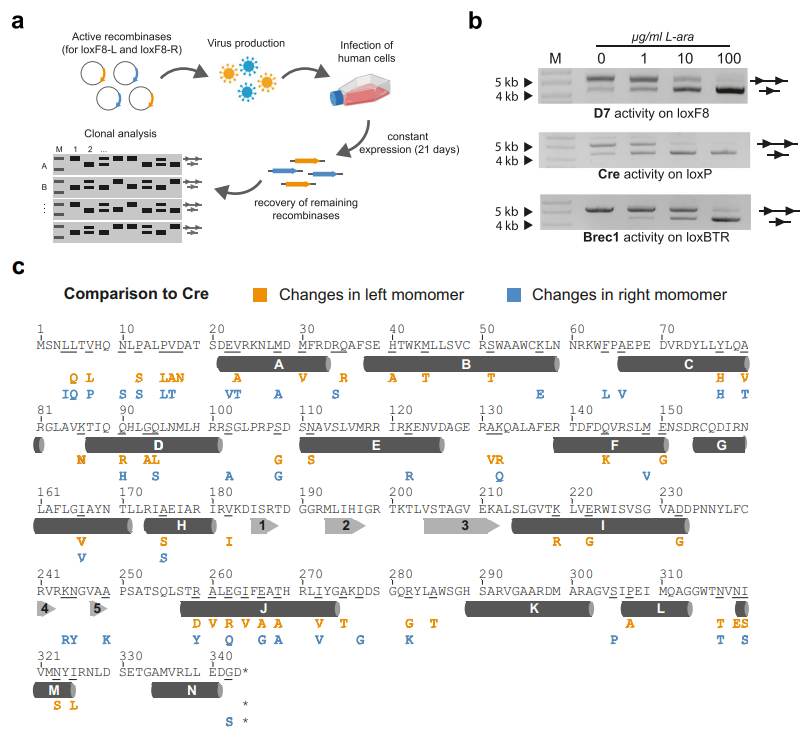
图二 loxF8位点特异性的异源二聚体重组酶活性筛选[3]
随后,研究者测试D7异源二聚体在人源细胞中的重组活性,构建了HEK293TloxF8报告细胞系,若在loxF8位点发生重组则会表达mCherry红色荧光蛋白(图三a)。当单独转染D7-L或D7-R单体时,HEK293TloxF8均不会产生mCherry阳性细胞;而当共转两种单体时,可观察到许多mCherry阳性细胞,阳性率为76%(图三b和c)。这表明形成异源二聚体是实现loxF8位点特异性重组所必需的。HEK293TloxF8报告细胞系中存在正常的F8基因组序列,研究者设计了两对PCR引物来确定int1h-1和int1h-2之间的序列方向(图三d)。当细胞共转D7两种单体后,经PCR可检测到阳性翻转条带,与阳性对照血友病A患者的基因组DNA结果一致(图三e)。证实了D7异源二聚体重组酶可以翻转人类基因组int1h-1和int1h-2之间的140 kb序列。
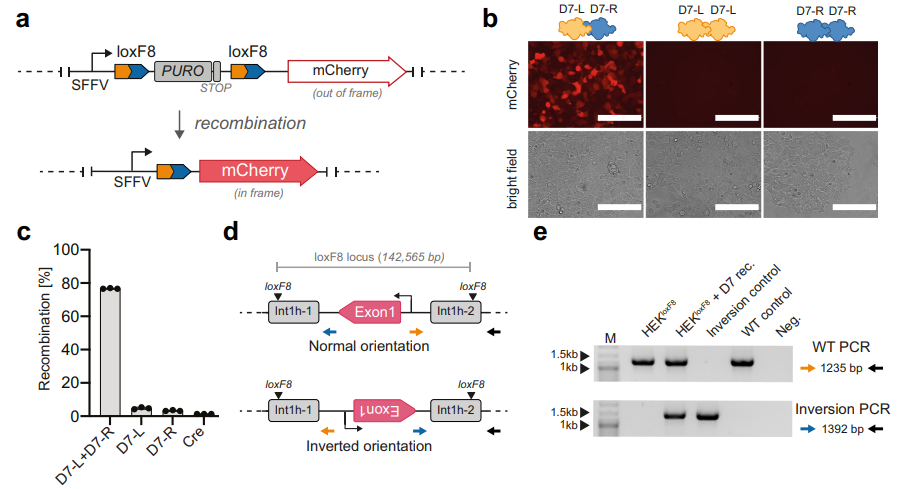
图三 D7异源二聚体在人源细胞中的活性[3]
之后,研究者进一步鉴定D7异源二聚体在基因组中的脱靶效应。研究者通过生物信息学分析获得13个预测脱靶位点,并克隆到报告载体中进行测试。其中11个预测脱靶位点没有与D7发生重组反应,表明D7异源二聚体的高特异性。但是有一个非对称性HG2位点和一个对称性HG2L位点会发生脱靶反应,尽管重组效率低于loxF8位点(图四a)。为了排除对称性位点的脱靶效应,研究者将D7的两种单体蛋白进行融合(图四b),再次利用SLiDE定向进化技术来快速筛选连接两个蛋白的最优linker序列,从而获得重组效果最佳的RecF8(图四c)。改进后的RecF8可特异性重组loxF8位点,与对称性HG2L位点不发生脱靶反应,与非对称性HG2位点表现出更低的脱靶效应(图四d)。RecF8在HEK293TloxF8报告细胞中进行测试,重组酶活性与D7相似,可翻转约30%的基因组序列(图四e)。由于loxF8位点介导的序列翻转具有可逆性,因此理论上翻转平衡后的最高效率为50%。以上结果表明RecF8/loxF8系统具有高重组效率和高特异性。
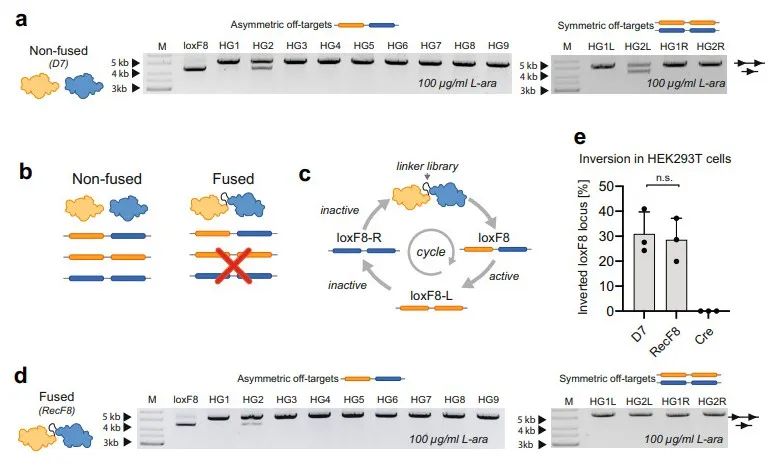
图四 RecF8/loxF8系统的高特异性和高重组效率[3]
最后,研究者利用RecF8/loxF8系统进行血友病A的体外基因治疗。由于FⅧ主要由肝细胞产生,研究者将病人血细胞诱导获得iPS细胞,并在体外分化成内皮细胞(EC)进行测试。瞬转RecF8 mRNA到EC治疗72小时后,特异性PCR鉴定显示经RecF8治疗的EC基因组DNA序列发生部分翻转(图五a),可将约12%的140 kb致病倒位反转回正常(图五b),恢复约6%的FⅧ mRNA表达(图五c)。表达的FⅧ mRNA经Sanger测序显示为正常的转录本序列(图五d)。有研究表明恢复2-5%的FⅧ活性即可缓解重型血友病A的症状[4]。以上结果表明,人工设计的RecF8重组酶可在体外特异性修复血友病A的基因组倒位,恢复6%的FⅧ mRNA表达,尽管效率不高但病人仍可受益。之前已有报道利用TALENs[5]或者CRISPR/Cas9[6]系统进行治疗,最高可修复6.7%的同种类型F8基因组倒位。这两种方法的原理是利用TALENs或者CRISPR/Cas9系统在int1h同源序列区产生DSB,依靠细胞自身DDR修复产生少量倒位修复的基因型,因此修复效率低于RecF8/loxF8系统。并且RecF8/loxF8系统的修复准确率为100%,而CRISPR/Cas9系统会产生不同大小的Indels,保真度仅为13.6%(图五e),体现了RecF8/loxF8系统的优越性。
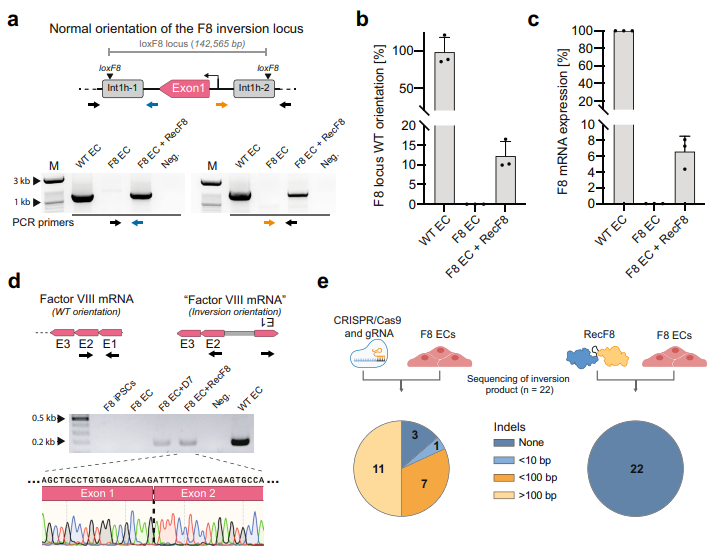
图五 RecF8/loxF8系统功能性修复病人来源EC细胞[3]
综上所述,研究者利用血友病A的本身致病序列定向开发出RecF8/loxF8系统,利用人工设计RecF8的位点特异性重组酶特性来修复loxF8位点的大片段基因组倒位,体外瞬转治疗即可成功将12%的基因组倒位恢复正常,为血友病A的相关基因治疗提供了新的方向。人工设计RecF8的分子定向进化技术为改造Cre重组酶从而识别其他不对称位点提供了更多可能,也为大片段基因组倒位引起的其他人类疾病的基因治疗提供了新的参考。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献:
1. Lannoy N, Hermans C: Principles of genetic variations and molecular diseases: applications in hemophilia A. Critical reviews in oncology/hematology 2016:1-8.
2. Oldenburg J, Pezeshkpoor B, Pavlova A: Historical Review on Genetic Analysis in Hemophilia A. Seminars in Thrombosis & Hemostasis 2014, 40(08):895-902.
3. Correction of a Factor VIII genomic inversion with designer-recombinases. Nature Communications 2022, 13(1):422.
4. Graw, Jochen, Brackmann, Hans-Hermann, Oldenburg, Johannes, Schneppenheim, Reinhard, Spannagl, Michael: Haemophilia A: from mutation analysis to new therapies. Nat Rev Genet 2005, 6(6):488-501.
5. Park CY, Kim J, Kweon J, Son JS, Kim DW: Targeted inversion and reversion of the blood coagulation factor 8 gene in human iPS cells using TALENs. Proceedings of the National Academy of Sciences 2014, 111(25):9253-9258.
6. Park CY, Kim D, Son J, Sung J, Lee J, Bae S, Kim JH, Kim DW, Kim JS: Functional Correction of Large Factor VIII Gene Chromosomal Inversions in Hemophilia A Patient-Derived iPSCs Using CRISPR-Cas9. Cell Stem Cell 2015, 17(2):213-220.



