技术分享:安全性升级版单碱基编辑器TaC9-ABE/CBE
Tips:在“基因治疗小鼠常染色体隐性耳聋模型”技术分享中我们介绍了利用AAV递送CBE碱基编辑器进行小鼠常染色体隐性耳聋模型的基因治疗研究。本期将分享安全性升级版单碱基编辑器TaC9-ABE与TaC9-CBE。
单碱基编辑器包括胞嘧啶碱基编辑器(CBE)、腺嘌呤碱基编辑器(ABE)、鸟嘌呤编辑器(GBE)和先导编辑器(Prime Editor)。这些单碱基编辑器不会产生DNA双链断裂(DSB),在基因治疗单基因点突变遗传病方面展现出巨大的应用潜力。其中ABE可高效实现从腺嘌呤(A)到鸟嘌呤(G)的单碱基转变,目前效率最高且应用最广的是ABE7.10版本TadA-TadA*-nCas9[1]。ABE7.10是将野生型tRNA腺嘌呤脱氨酶TadA和经过定向进化的突变体TadA*形成的异二聚体与nCas9(SpCas9 D10A突变体)相融合。其工作原理是在sgRNA的引导下,ABE7.10结合到靶向基因组DNA位点上,由nCas9解开双链DNA(dsDNA)并在目标位点产生单链缺口,再由脱氨酶异二聚体将非靶向单链DNA(ssDNA)上一定范围内的A脱氨变成肌苷(I),然后I再转变成G,从而实现A到G的单碱基转变[1]。由于ABE7.10系统仍然利用sgRNA来引导靶位点的识别,而设计的sgRNA可能会与非靶位点序列形成错配产生脱靶效应,这将导致该系统应用于基因治疗时可能引发安全性问题。
2022年3月,Cell Discovery上发表了一种改良版腺嘌呤碱基编辑器TaC9-ABE,可有效避免sgRNA带来的脱靶效应,进一步升级了单碱基编辑的安全性[2]。研究者将脱氨酶异二聚体利用转录激活因子样效应器(transcription activator-like effector, TALE)导航到靶位点,构建TadA-TadA*-TALE(TadAwt*-TALE)。由于TadAwt*-TALE无法解开dsDNA,在结合位点上没有碱基编辑活性,因而TaC9-ABE系统还需要单独表达nCas9系统(图一a)。在On-target靶位点上,sgRNA招募nCas9产生单链缺口,TadAwt*-TALE识别经nCas9切割后的ssDNA进行A到G的单碱基转变。在非靶位点的gRNA-OFF target上,仅有nCas9产生单链缺口,缺少了脱氨酶,无法进行碱基替换;而在非靶位点的TALE-OFF target上,仅有脱氨酶同样无法对dsDNA进行碱基编辑(图一b)。因此,TaC9-ABE系统可有效避免脱靶效应。
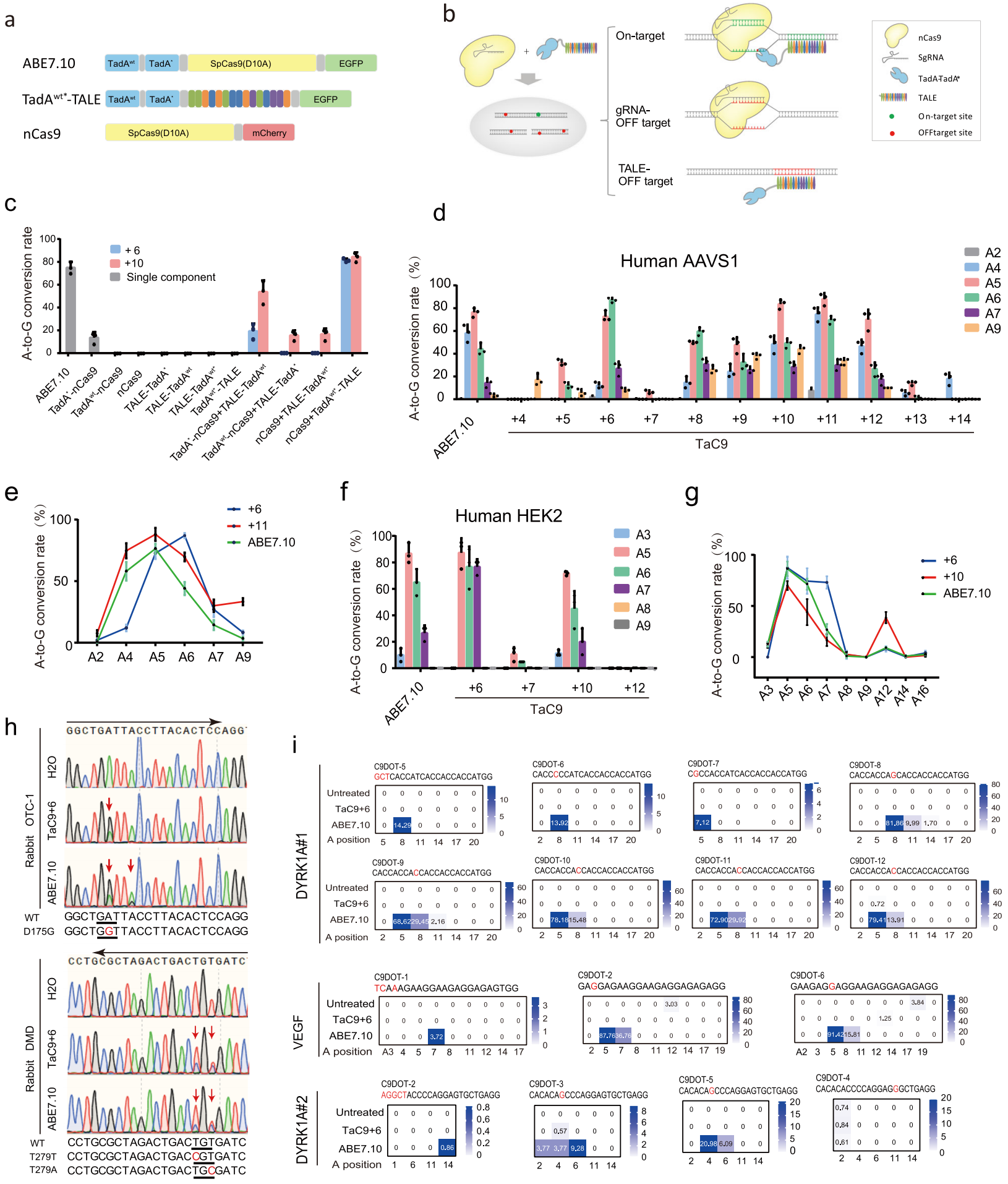
图一 无脱靶效应的高效单碱基编辑器TaC9-ABE[2]
研究者设计实验对TaC9-ABE进行测试,并与ABE7.10系统进行比较。结果表明,TaC9-ABE与ABE7.10系统的A到G碱基编辑效率相当;其中将sgRNA和TALE的靶位点设计相隔10 bp的方案更优,编辑效率高于相隔6 bp组;而单个组份的阴性对照没有检测到编辑效率。另外,元件的其它排列设计方案的编辑效率均低于TaC9-ABE,从而确定了该系统的最优元件排布组合(图一c)。接着,研究者摸索sgRNA和TALE的靶位点设计规律。在AAVS1位点的测试结果表明,sgRNA和TALE的靶位点设计相隔6 bp到12 bp可实现有效编辑;其中相隔11 bp组的有效编辑窗口为A4到A9,优于ABE7.10系统;而相隔6 bp组的有效编辑窗口为A5到A7(图一d和e)。在另一个HEK2位点上也显示相似的结果(图一f和g)。
研究者进一步在兔胚胎中测试TaC9-ABE系统的在体编辑能力。在OTC-1位点,TaC9-ABE(6 bp)将编辑位点限定在A6,而ABE7.10同时将A6和A9转换为G。在DMD位点,TaC9-ABE(6 bp)和ABE7.10一样,将编辑位点限定在A5和A7(图一h)。上述结果证明了TaC9-ABE的高效在体碱基编辑能力,可用于产生特定点突变动物模型。最后,研究者测试了TaC9-ABE系统的脱靶效应,对40个gRNA依赖的脱靶位点(C9DOTs)以及25个TALE依赖的脱靶位点(TaDOTs)进行深度测序均未检测到脱靶编辑现象,而ABE7.10系统检测到约50%的非靶向位点存在脱靶编辑现象(图一i)。上述结果证明了TaC9-ABE系统的安全优越性,在保留高效碱基编辑能力的同时,还能避免sgRNA造成的脱靶效应。
研究者采用相同的策略也对CBE系统的第三代版本BE3进行安全性升级,构建了新型碱基编辑器TaC9-CBE,文章在2022年4月在线发表在Molecular Therapy [3]。研究者将BE3系统中的胞嘧啶脱氨酶rAPOBEC1(rA1)利用TALE导航到靶位点(rA1-TALE),结合nCas9-2×UGI构成TaC9-CBE系统,可高效实现从C到T的单碱基转变(图二)。后续研究者进一步将rA1换成其突变体YE1,采用YE1-TALE与nCas9-2×UGI组合来构成TaC9-CBEYE1系统,sgRNA和TALE的靶位点设计相隔6 bp到15 bp可实现高效编辑。

图二 单碱基编辑器TaC9-CBE的工作原理示意图[3]
综上所述,研究者采用Cas9和TALE的双导航系统来共同定位和激活TaC9-ABE与TaC9-CBE碱基编辑器,可有效降低两个导航系统带来的脱靶效应,提高基因治疗的安全性。但值得注意的是,原ABE和CBE系统本身元件较大,都需要拆分到2个AAV包装体系中,在临床应用中会降低编辑效率。而安全性升级版的TaC9-ABE和TaC9-CBE系统由于增加了TALE元件,因此它们临床应用的实际编辑效率有待研究证明。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Gaudelli NM, Komor AC, Rees HA, Packer MS, Badran AH, Bryson DI, Liu DR: Programmable base editing of A.T to G.C in genomic DNA without DNA cleavage. Nature 2017, 551(7681):464-471.
2. Liu Y, Zhou J, Lan T, Zhou X, Yang Y, Li C, Zhang Q, Chen M, Wei S, Zheng S et al: Elimination of Cas9-dependent off-targeting of adenine base editor by using TALE to separately guide deaminase to target sites. Cell discovery 2022, 8(1):28.
3. Zhou J, Liu Y, Wei Y, Zheng S, Gou S, Chen T, Yang Y, Lan T, Chen M, Liao Y: Eliminating predictable DNA off-target effects of cytosine base editor by using dual guiders including sgRNA and TALE. Molecular Therapy 2022.



