技术分享:新型一体化条件性敲除系统
当我们研究某个基因时,通常最先采用条件性敲除(cKO)策略来阐明其功能,利用同源重组的方法将loxP或FRT序列引入目标基因组中。然而,传统cKO细胞的制备往往需要几个月的时间。简单来说,在首轮二倍体细胞打靶完成后,若为单拷贝打靶成功,还需要在基因组上删除选择性标记后,以相同方式再次靶向另一个等位基因进行打靶。为了缩短这些复杂耗时的过程,有研究者通过TALEN技术将loxP序列同时整合至两个等位基因中[1],或使用CRISPR/Cas9系统介导Cre调控的可逆基因诱捕方法[2, 3]一步法生成cKO胚胎干细胞(ESCs)。但这些方法仍然需要大规模药筛来分离阳性cKO克隆,且无法对靶基因进行标记和监测。
2021年1月,Nucleic Acids Research杂志上报道了一种用于基因功能研究的新型一体化条件敲除系统,可以高效地构建cKO细胞并同时进行目的基因修饰,包括标签蛋白标记和报告基因敲入,从而仅需一株cKO细胞即可实现目的基因的多种一体化功能研究[4]。
研究者选择Ddx1基因作为研究对象,sgRNA设计在2号外显子上,利用CRISPR/Cas9系统定点插入FRT-EGFP-FRT-P2A-Flag-Exon1&2 CDS元件(图一A左图)。生理条件下,利用Ddx1内源启动子驱动EGFP的表达,P2A隔开EGFP和Ddx1蛋白序列,在Ddx1蛋白的N端引入Flag tag,并补上sgRNA插入位点前的Exon1和部分Exon2 CDS序列,从而恢复Ddx1的全长蛋白序列。KO条件下,导入FLP重组酶,去除EGFP序列的同时造成后续序列的移码突变,快速实现Ddx1 KO(图一A右图)。
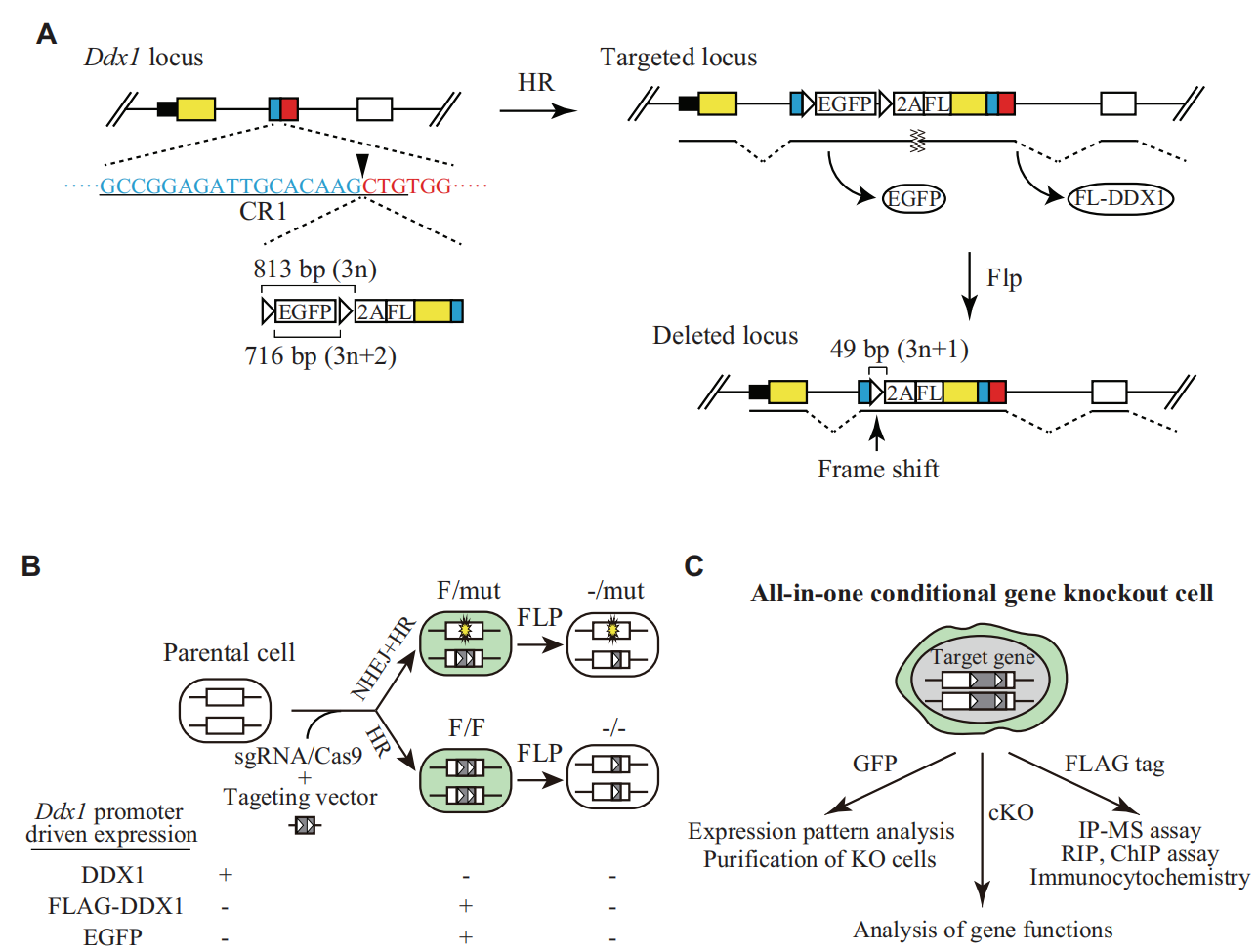
图一 一体化条件性敲除系统的工作原理[4]
cKO细胞打靶过程中,可利用EGFP的表达来快速筛选单克隆,再利用PCR测序来确定阳性cKO克隆(图一B和表一)。阳性cKO细胞系可用于一体化功能的研究:一、可利用EGFP来指示目的基因的表达情况;二、引入FLP重组酶实现KO,用于目的基因功能研究;三、利用Flag tag来进行IP-MS、RIP、ChIP、IHC等生化实验和组学分析,进一步研究目的基因生理功能(图一C)。
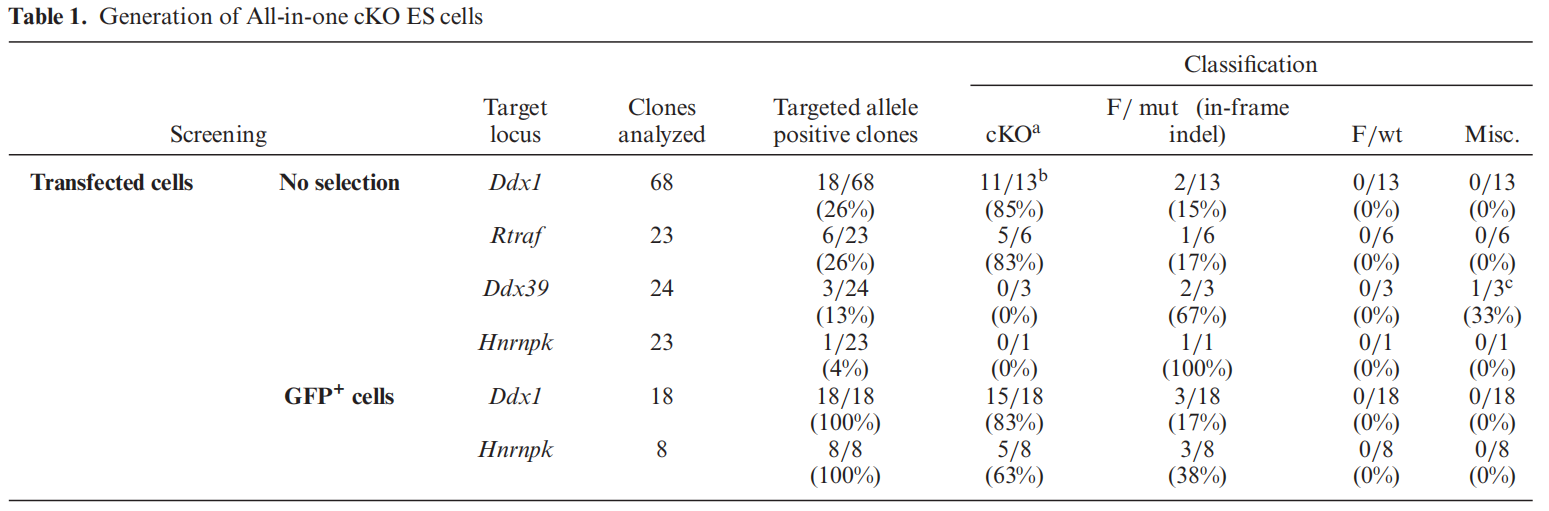
研究者在ESCs中靶向多个目的基因构建一体化cKO细胞系,打靶效率的统计结果见表一。若细胞打靶后随机挑选单克隆进行PCR鉴定,基因编辑的阳性率仅为4%~26%。而改换成挑选EGFP阳性单克隆,可使基因编辑的阳性率达到100%,从而将双等位基因阳性的cKO打靶效率提升到63%和83%(表一)。
表一 一体化cKO细胞的阳性打靶效率统计[4]
利用该系统,研究者发现Ddx1 KO的ESCs细胞增殖被严重阻滞(图二A),TUNEL阳性凋亡细胞的比例显著增加(图二B)。诱导Ddx1 KO 2-3天,可检测到p53蛋白的显著上调(图二C),以及p53下游通路的Cdkn1a、Perp、Fas、Pmaip1、Plk2、Mdm2的mRNA表达水平显著升高(图二D)。以上表明Ddx1的缺失可迅速激活p53信号通路。后续研究者对其机制进行了深入研究。
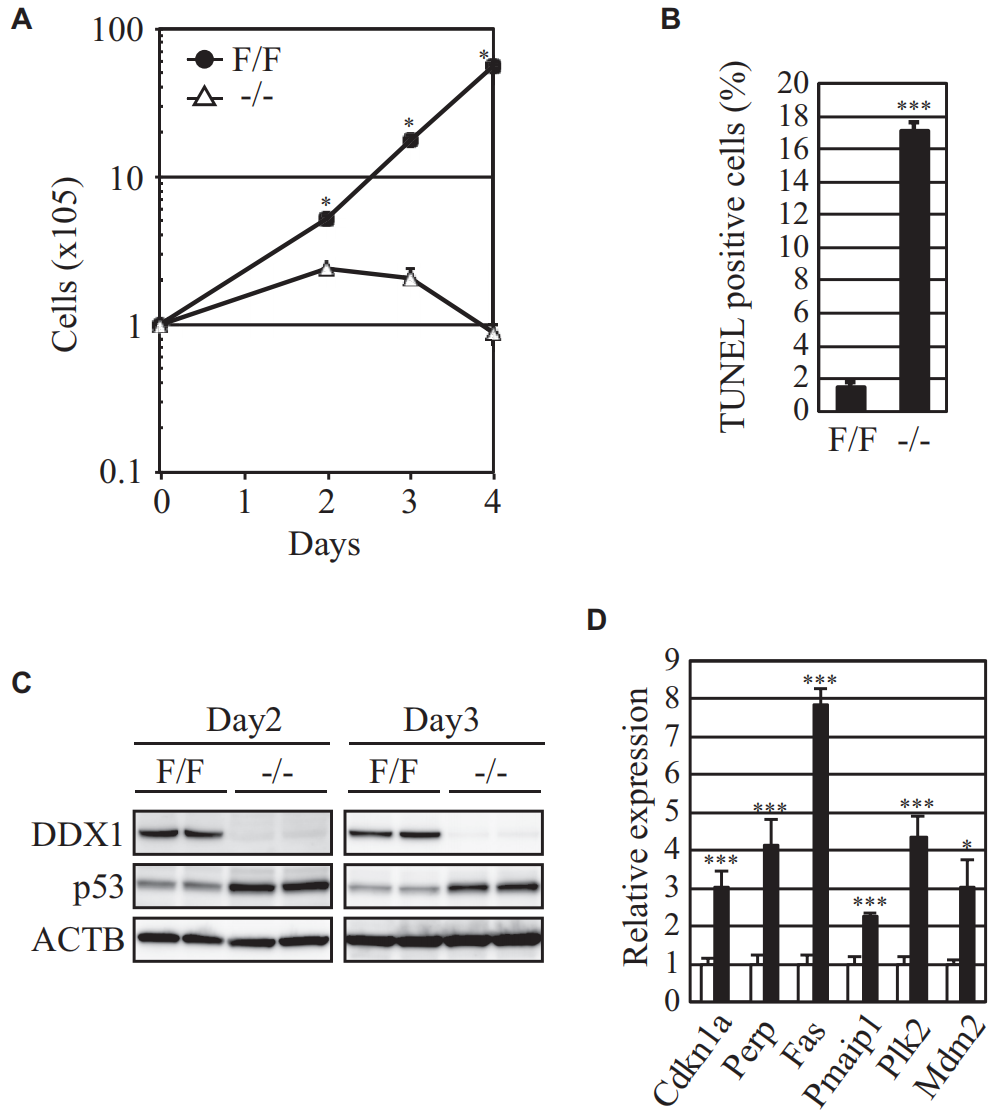
图二 Ddx1−/−ESCs的增殖阻滞[4]
综上所述,这种一体化条件性敲除系统不仅可以一步到位地构建cKO细胞,还可以对目的基因进行标签标记和荧光标记。该系统可简化cKO细胞建系过程,缩短建系时间,提高打靶效率,并集合多种功能的研究手段于一体,为快速和精确分析目的基因的表达与功能提供了一个重要的工具。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
邮编:200031
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Flemr M, Buhler M: Single-Step Generation of Conditional Knockout Mouse Embryonic Stem Cells. Cell Rep 2015, 12(4):709-716.
2. Chen L, Ye Y, Dai H, Zhang H, Zhang X, Wu Q, Zhu Z, Spalinskas R, Ren W, Zhang W: User-Friendly Genetic Conditional Knockout Strategies by CRISPR/Cas9. Stem Cells Int 2018, 2018:9576959.
3. Andersson-Rolf A, Mustata RC, Merenda A, Kim J, Perera S, Grego T, Andrews K, Tremble K, Silva JC, Fink J et al: One-step generation of conditional and reversible gene knockouts. Nat Methods 2017, 14(3):287-289.
4. Suzuki T, Katada E, Mizuoka Y, Takagi S, Kazuki Y, Oshimura M, Shindo M, Hara T: A novel all-in-one conditional knockout system uncovered an essential role of DDX1 in ribosomal RNA processing. Nucleic Acids Res 2021, 49(7):e40.



