技术分享:体外重建DMD疾病的神经肌肉回路
杜氏肌肉营养不良症(DMD)是一种致死性的X连锁隐性遗传病,由抗肌萎缩蛋白(dystrophin,DMD)基因的各种突变所致,常见于男性儿童的遗传性神经肌肉紊乱,一般表现为骨骼肌萎缩和无力,最终因呼吸循环衰竭而死亡[1]。生理状态下,运动神经元轴突末梢与骨骼肌纤维形成突触连接,即神经肌肉接头(NMJs)。神经肌肉回路由运动神经元(MNs)释放神经递质至NMJs,引起骨骼肌收缩。抗肌萎缩蛋白糖蛋白复合物(DGC)富集在肌纤维和NMJs的细胞膜上,负责连接细胞骨架和细胞外基质来维持骨骼肌细胞的完整性,并参与细胞信号传导[2, 3]。研究表明,DMD病人与dystrophin基因缺陷小鼠的NMJs结构发生改变,出现异常电生理信号[4-7]。但是NMJs结构的异常对于DMD的病理学影响尚不清楚。
2021年9月,Science Advances杂志发表了一种体外重建神经肌肉回路的微型装置,结合DMD病人多能干细胞(ePSC)的分化系统,进一步研究NMJs在DMD疾病中的作用,并提供了一种体外筛药系统[8]。
研究者首先建立了DMD病人来源的多能干细胞(ePSC),并利用CRISPR-Cas9技术修复DMD杂合突变c.10141C>T(p.R3381X),进而在体外分化为肌细胞(图一A)。建立的DMD ePSC可高表达5种多能性marker(图一B),并可分化成三种胚层细胞(图一C)。将DMD ePSC利用CRISPR-Cas9技术修复成CORR-ePSC,测序结果表明已正确修复(图一E-G)。而且DMD ePSC和CORR-ePSC细胞的核型均表现正常(图一D和H)。
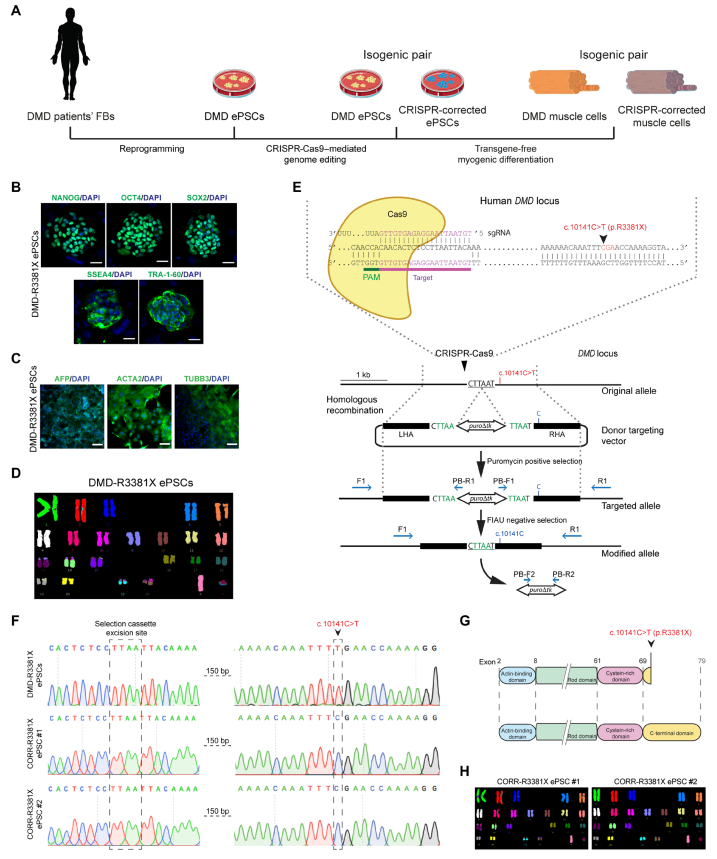
图一 建立DMD ePSC与突变修复CORR-ePSC细胞系[8]
接着,研究者将DMD ePSC和CORR-ePSC在体外定向分化成肌细胞。先将DMD ePSC和CORR-ePSC分化为成肌祖细胞(MPCs)(图二A),再进一步分化为肌管(图二B和C)。可以观察到CORR-ePSC与DMD ePSC相比,体外分化效率更高(图二C),还可检测到基因修复后DMD全长蛋白的重新表达(图二D)。

图二 DMD ePSC和CORR-ePSC定向分化为肌管[8]
随后,研究者搭建微型装置在体外重建神经肌肉回路。将DMD ePSC和CORR-ePSC分化得到的MPCs作为肌肉来源,小鼠胚胎干细胞(ESCs)分化得到的运动神经元(MNs)和星形胶质细胞(ACs)作为神经来源,利用分区装置共培养上述细胞来重建神经肌肉回路(图三C)。先将小鼠ESCs在体外单独分化为MNs和ACs(图三A),第-2天,将表达光传感器的ChR2-MNs和ACs的细胞球体植入微型装置的上下两个腔室中。第-1天,将DMD ePSC或CORR-ePSC分化得到的MPCs植入微型装置的中间腔室,然后用纤维蛋白/基质水凝胶密封(图三B和C)。在第0-3天分化过程中,DMD MPCs组和CORR-MPCs组都出现神经元轴突生长,MPCs分化成肌纤维,互相作用形成突触连接(图三D和E)。从第4-5天开始,每天照射1小时蓝光(470nm),诱导ChR2-MNs神经元激活,从而刺激肌纤维收缩,实现神经肌肉回路的体外重建(图三B)。结果表明,DMD MPCs组和CORR-MPCs组相比,肌纤维的收缩频率和强度显著降低(图三F和G);神经突触前marker突触囊泡糖蛋白2A(SV2)和肌纤维marker TUBB3并没有显著差别(图三H和I);可是神经突触后marker乙酰胆碱受体(AChR)显著减少(图三H和I)。由于NMJs的数量是由SV2和AChR的共定位来确定的,因此DMD病人的NMJs数量显著减少可能是导致肌纤维收缩受阻的原因之一。
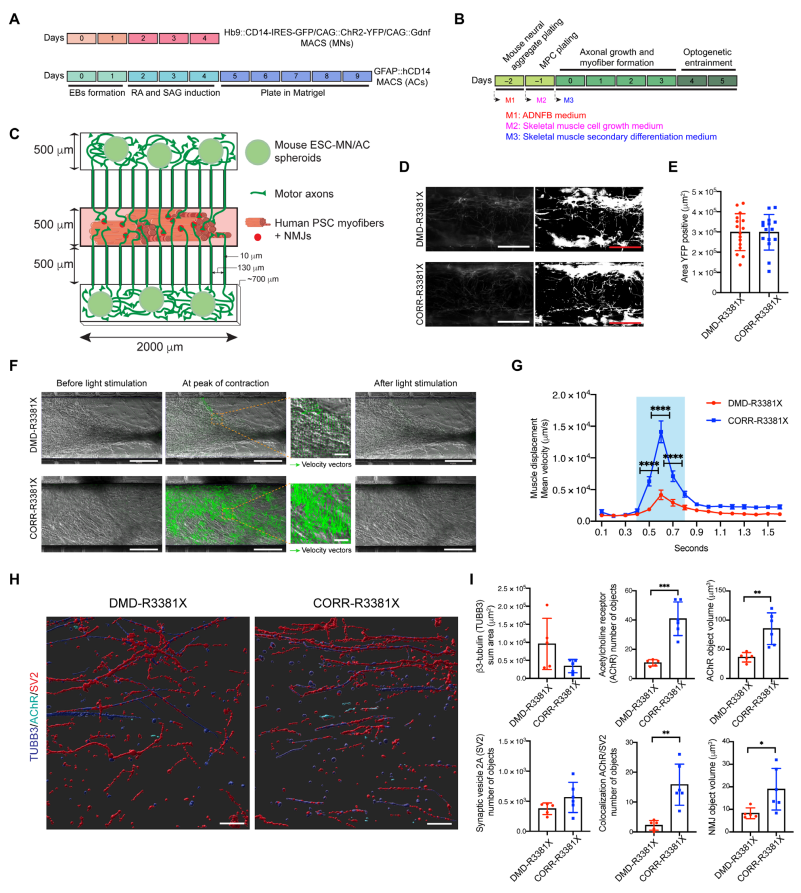
图三 微型装置体外重建神经肌肉回路[8]
最后,研究者利用这个微型装置系统来进行体外筛药,发现TGFβ信号通路抑制剂(SB-431542)可显著提高DMD MPCs组的肌纤维收缩频率和强度(图四)。
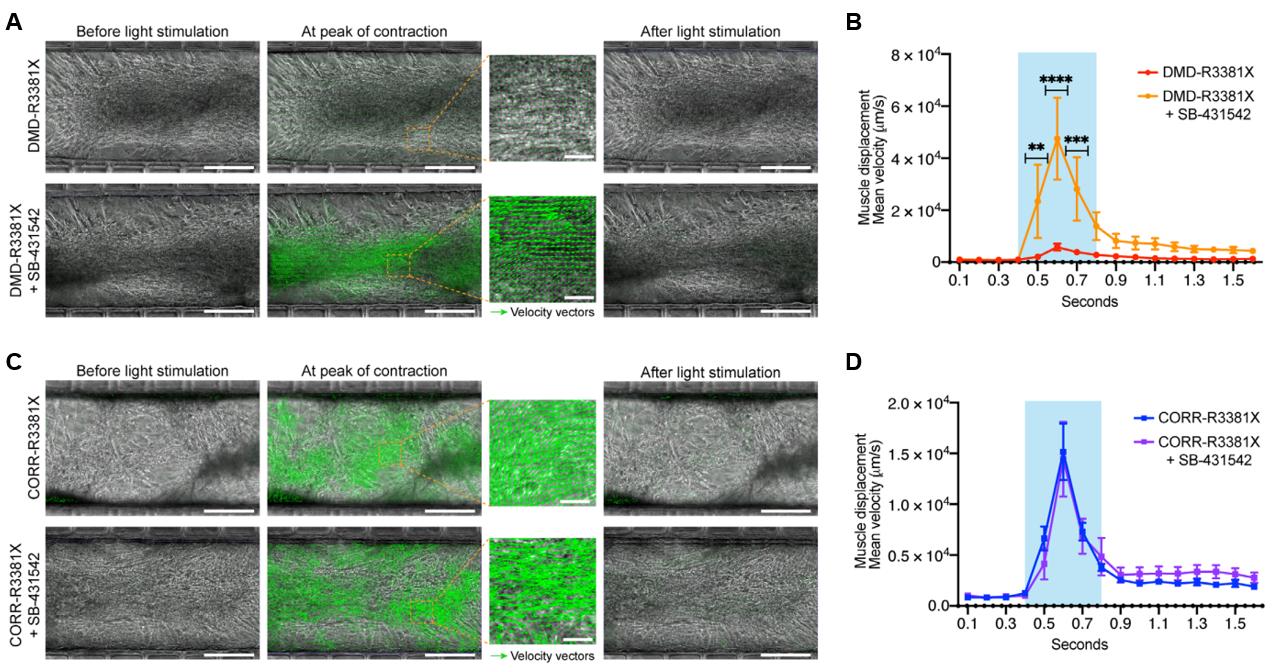
图四 SB-431542有效改善DMD的肌肉收缩缺陷[8]
综上所述,研究者建立了一种神经肌肉回路的体外重建微型装置,揭示了NMJs结构对DMD疾病的影响,并为靶向NMJs来治疗DMD疾病提供了新思路和体外筛药系统。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献:
1. Mendell JR, Shilling C, Leslie ND, Flanigan KM, al-Dahhak R, Gastier-Foster J, Kneile K, Dunn DM, Duval B, Aoyagi A et al: Evidence-Based Path to Newborn Screening for Duchenne Muscular Dystrophy. Ann Neurol 2012, 71(3):304-313.
2. Rando TA: The dystrophin-glycoprotein complex, cellular signaling, and the regulation of cell survival in the muscular dystrophies. Muscle Nerve 2001, 24(12):1575-1594.
3. Pilgram GSK, Potikanond S, Baines RA, Fradkin LG, Noordermeer JN: The Roles of the Dystrophin-Associated Glycoprotein Complex at the Synapse. Mol Neurobiol 2010, 41(1):1-21.
4. Jerusalem F, Engel AG, Gomez MR: Duchenne dystrophy. II. Morphometric study of motor end-plate fine structure. Brain 1974, 97(1):123-130.
5. van der Pijl EM, van Putten M, Niks EH, Verschuuren JJGM, Aartsma-Rus A, Plomp JJ: Characterization of neuromuscular synapse function abnormalities in multiple Duchenne muscular dystrophy mouse models. Eur J Neurosci 2016, 43(12):1623-1635.
6. Lovering RM, Iyer SR, Edwards B, Davies KE: Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neurosci Lett 2020, 737:135304.
7. Ng SY, Ljubicic V: Recent insights into neuromuscular junction biology in Duchenne muscular dystrophy: Impacts, challenges, and opportunities. Ebiomedicine 2020, 61:103032.
8. Paredes-Redondo A, Harley P, Maniati E, Ryan D, Louzada S, Meng JH, Kowala A, Fu BY, Yang FT, Liu PT et al: Optogenetic modeling of human neuromuscular circuits in Duchenne muscular dystrophy with CRISPR and pharmacological corrections. Sci Adv 2021, 7(37):eabi8787.

