技术分享:利用合成致死来控制单一性别子代出生以及性别特异表型
合成致死这一现象于1922年由哥伦比亚大学遗传学家Calvin Bridges在模式生物黑腹果蝇中发现,当两个特定基因同时突变失活时会造成果蝇死亡,而这两个基因单一纯合突变的亲本都不致死[1]。1946年,合成致死的概念被Theodore Dobzhansky提出[2],而这一概念后来被广泛用于癌症治疗和各种研究中。
2021年12月,Nature Communications上发表了一项利用合成致死概念来控制单一性别子代出生的技术,该技术可在特定性别的科学研究中提高动物福利,并可拓展应用到畜牧业上[3]。研究者设计了双组分的CRISPR-Cas9系统,其中一个组分设计在性染色体上,另一个组分选择了Top1基因作为致死靶点。Top1基因编码的拓扑异构酶I是进化保守的DNA复制和修复重要因子,小鼠Top1基因的缺失会造成4-16细胞时期的胚胎致死[4]。
研究者首先测试了Top1基因的致死效果,将突变效率最高的Top1 sgRNA2序列敲入常染色体安全位点Hipp1(H11),构建携带U6-Top1 sgRNA2-pCbh-mCherry的H11Top1转基因小鼠(图一a)。打靶成功的H11Top1小鼠全身呈红色荧光(图一b)。H11Top1杂合雄鼠与持续性过表达Cas9的Rosa26Cas9(简称R26Cas9)纯合雌鼠进行交配,子代中同时携带H11Top1/R26Cas9基因型的胚胎即致死,而+/R26Cas9基因型则可正常存活(图一c)。在子代E3.5胚胎中,可以检测到H11Top1/R26Cas9基因型占比为50%,但子代出生后仅有+/R26Cas9基因型存活(图一d)。并且在子代H11Top1/R26Cas9基因型的E3.5胚胎中,确实检测到高比例的Top1基因突变(图一e)。该结果成功证明了Top1基因的高效致死性。
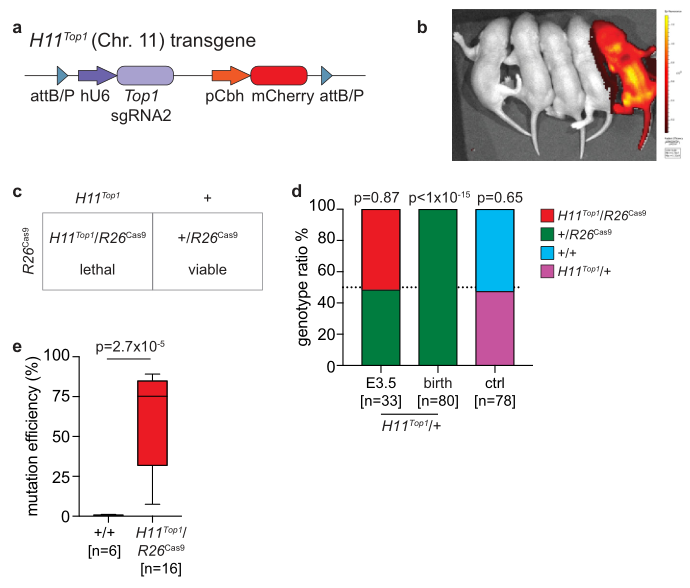
图一 H11Top1小鼠的构建与合成致死效果检测[3]
接着研究者将Cas9元件敲入性染色体来实现性别特异的合成致死。X染色体的敲入位点选择在Hprt基因,该基因缺失对小鼠的造血系统和生育能力基本无影响[5]。Y染色体的敲入位点选择在Uty基因,该基因不是生育必需[6],且在雄鼠成体组织中均有表达[3]。研究者在小鼠胚胎干细胞(mESCs)中,将Hprt基因的2号外显子中敲入pCAG-Cas9-T2A-eGFP元件,获得X染色体过表达Cas9的XCas9mESCs(图二a)。由于野生型小鼠Uty基因的18号外显子不表达,为了不破坏Uty基因的功能,研究者在17号外显子后面直接敲入19-30号外显子的cDNA序列,从而敲入cDNA19-30-IRES-Cas9-T2A-eGFP元件,获得Y染色体过表达Cas9的YCas9mESCs(图二b)。将mESCs进行囊胚注射获得嵌合小鼠,通过与野生型小鼠交配分别获得生殖系遗传的XCas9小鼠和YCas9小鼠。后续实验均选择雄鼠来进行,即XCas9Y与XYCas9,这样交配获得的子代可以保证仅有雌鼠携带XCas9,以及仅有雄鼠携带YCas9。经蛋白表达水平检测,在XCas9Y与XYCas9雄鼠的成体组织中均能检测到Cas9蛋白的表达(图二c和二d)。
将XCas9Y雄鼠与纯合H11Top1雌鼠交配,获得的子代中仅雄鼠存活,基因型为H11Top1/Y,而H11Top1/XCas9基因型的雌鼠全部胚胎致死(图二e,左图)。而将XYCas9雄鼠与纯合H11Top1雌鼠交配,获得的子代中仅雌鼠存活,基因型为H11Top1/X,而H11Top1/YCas9基因型的雄鼠全部胚胎致死(图二e,右图)。子代的性别分析也证实了该系统可高效控制单一性别子代的出生(图二f)。

图二 性染色体特异的XCas9和YCas9小鼠的构建与控制单一性别子代出生率检测[3]
研究者进一步将该系统运用于性别特异的表型分析,选择了重要的DNA修复基因Atm来进行测试。将XCas9Y与XYCas9雄鼠分别与野生型雌鼠交配获得受精卵,利用电转将Atm sgRNA导入受精卵中后进行胚胎移植。XCas9Y雄鼠获得的F0子代仅有雌性子代携带Atm突变,并且在8周龄检测出现卵巢萎缩(图三a),以及无卵母细胞产生的表型(图三b)。该方法XYCas9雄鼠获得的F0子代仅有雄性子代携带Atm突变,并且在8周龄检测出现睾丸生精小管中无精子(图三c),以及睾丸变轻的表型(图三d)。免疫荧光染色分析显示粗线期精母细胞的染色体断裂以及持续性的DNA损伤(图三e)。
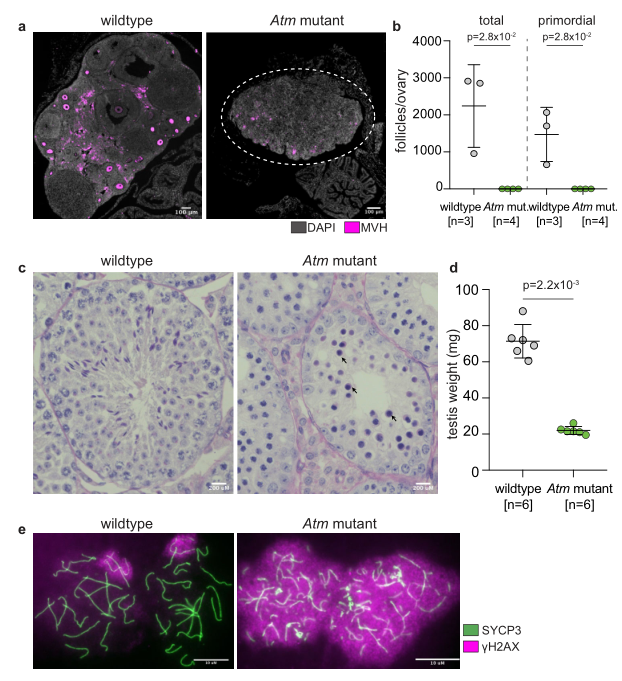
图三 性别特异的Atm突变表型分析[3]
综上所述,研究者利用CRISPR-Cas9来设计双组分合成致死系统,并且利用性染色体特异表达的Cas9来控制单一性别子代出生,以及进行性别特异的表型分析。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。“人造精子细胞”单倍体打靶效率更高,且无需漫长的嵌合体小鼠繁殖交配等待。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
邮编:200031
责任编辑:多一百
新媒体运营:suway
参考文献
1. Bridges CB: The origin of variations in sexual and sex-limited characters. Am Nat 1922, 56:51-63.
2. Dobzhansky T: Genetics of Natural Populations .13. Recombination and Variability in Populations of Drosophila-Pseudoobscura. Genetics 1946, 31(3):269-290.
3. Douglas C, Maciulyte V, Zohren J, Snell DM, Mahadevaiah SK, Ojarikre OA, Ellis PJI, Turner JMA: CRISPR-Cas9 effectors facilitate generation of single-sex litters and sex-specific phenotypes. Nat Commun 2021, 12(1)6926.
4. Morham SG, Kluckman KD, Voulomanos N, Smithies O: Targeted disruption of the mouse topoisomerase I gene by camptothecin selection. Mol Cell Biol 1996, 16(12):6804-6809.
5. Ansell JD, Samuel K, Whittingham DG, Patek CE, Hardy K, Handyside AH, Jones KW, Muggleton-Harris AL, Taylor AH, Hooper ML: Hypoxanthine phosphoribosyl transferase deficiency, haematopoiesis and fertility in the mouse. Development 1991, 112(2):489-498.
6. Shpargel KB, Sengoku T, Yokoyama S, Magnuson T: UTX and UTY demonstrate histone demethylase-independent function in mouse embryonic development. PLoS genetics 2012, 8(9):e1002964.

