技术分享:人源化FXII基因敲入小鼠模型的构建——可用于抗血栓药物的测试
血液凝固对于止血至关重要。在生理病理条件下,过度凝血会引发缺血性疾病的症状,如心肌梗死、肺栓塞和缺血性中风等,甚至危及生命。目前可用的抗凝剂和抗血栓剂虽然有助于预防缺血性心脑血管疾病,但是通常伴随着增加出血的风险。
抑制凝血因子XII(FXII)的表达可有效抑制血栓形成而不产生出血风险,使得它成为一个有前景的抗血栓靶点。在聚阴离子的介导下(例如体内的多磷酸盐、核酸,或体外的二氧化硅、鞣花酸),FXII被激活为FXIIa,进一步启动内在凝血级联反应,从而形成纤维蛋白促进凝血。FXII驱动的接触系统激活与各种疾病有关,包括遗传性血管性水肿(HAE)、阿尔茨海默病以及血栓性和炎症性疾病[1]。这种接触激活过程是活化部分凝血活酶时间(activated partial thromboplastin time,APTT)的基础,临床上APTT被广泛用于测定血浆的凝固。临床上FXII的遗传缺陷与异常出血无关[2]。与人类相似,FXII敲除小鼠不会发生自发性出血,出血时间也不会延长,但是可防止病理性血栓形成和血栓性炎性脑梗塞[3, 4]。FXII作为一个有前景的新靶点,目前仍然缺乏人源化FXII动物模型来进行新研发药物的体内有效性和安全性评价。
2021年8月,德国伍尔茨堡大学医院实验生物医学研究所的Bernhard Nieswandt研究组构建了一种人源化FXII基因敲入小鼠模型(hF12KI),将鼠源F12基因的整个序列替换为人源F12基因序列,并利用该模型进行了FXIIa人源抗体的小鼠体内评价实验,为FXII(a)小分子抑制剂的研发提供了有效的体内评价系统[5]。
研究者首先对hF12KI小鼠模型进行检测,利用蛋白质印迹分析可在hF12KI小鼠血浆中检测到人源hFXII蛋白质的表达(~68kDa)(图一A);ELISA检测hF12KI小鼠中不存在鼠源mFXII(图一B),仅特异性表达hFXII(图一C);LC-MS检测也同样证明了hF12KI小鼠仅表达hFXII(图一D和E),但是小鼠血浆中的hFXII含量与人血浆相比减少了许多,仅为20%的含量(图一D),这可能与人源F12基因调节元件在小鼠体内识别效率低有关。尽管如此,hF12KI小鼠与WT小鼠相比,APTT仍然保持相似(图一F),这与之前报道的仅有10%的FXII足以维持正常APTT的结论一致[6]。但是由于hFXII含量的减少导致了hF12KI小鼠的凝血活性显著降低(图一G),而凝血酶原时间PT指标没有显著变化(图一H)。研究者进一步评估了FXIIa人源单克隆抗体(mAB)3F7的浓度对hF12KI小鼠凝血作用的影响。hF12KI小鼠与WT小鼠相似,APTT表现出剂量依赖性时间延长(图一I),并且100 µg/ml 的3F7足以将FXIIa蛋白酶活性降低至5%以下(图一J)。而多达0.5 mg/ml的3F7给药也不影响hF12KI小鼠与WT小鼠的凝血酶原时间PT指标(图一K),再次证明了3F7抑制FXIIa介导凝血作用的特异性[7]。值得注意的是,hF12KI小鼠中的低hFXII表达可能使其对FXII抑制剂的抗血栓作用更为敏感。
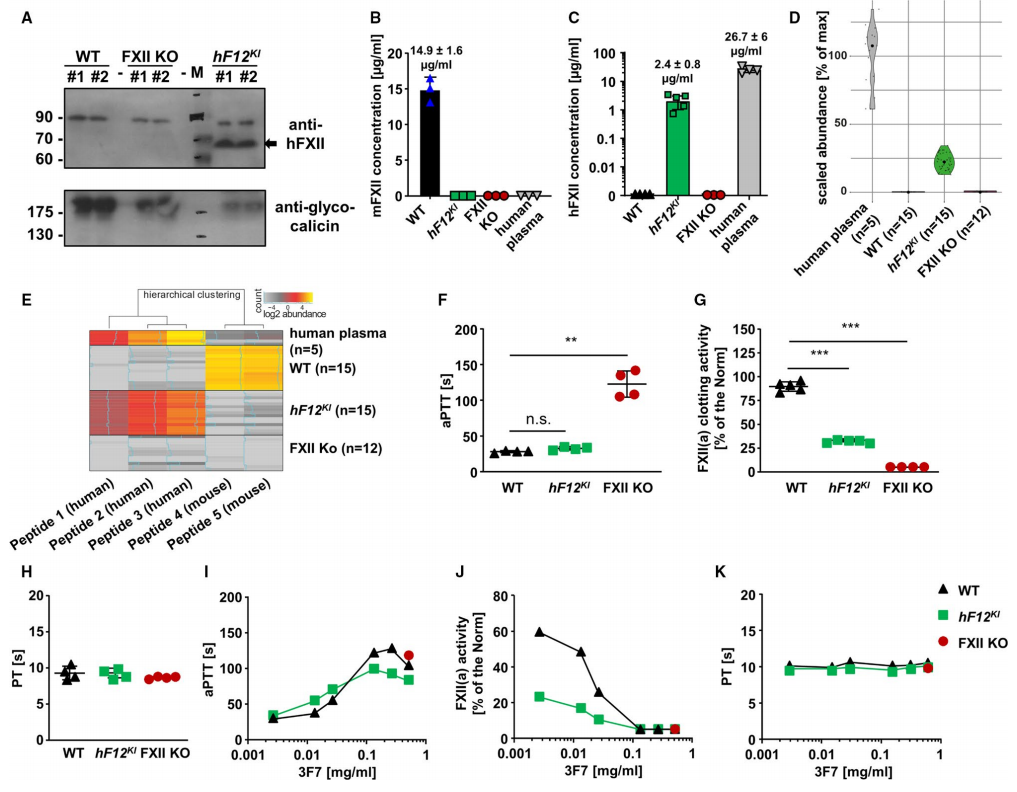
图一 hF12KI小鼠模型鉴定与单克隆抗体3F7的体内评价实验[5]
为了进一步测试hF12KI小鼠的体内功能,研究者进行了FeCl3诱导的肠系膜小动脉血栓形成实验,hF12KI小鼠与WT小鼠相似,在15-17分钟时均可形成血管闭塞;而hF12KI小鼠给药1-10mg/kg的3F7后与FXII敲除小鼠(FXII KO)结果相似(图二A和B)。在腹部动脉损伤实验中也获得了相似结果(图二C)。此外,对hF12KI小鼠尾部出血时间的监测表现正常,表明3F7介导的hF12KI小鼠抗血栓作用与止血功能受损无关(图二D)。综上所述,hF12KI小鼠表达的hF12蛋白质的体内功能正常,该小鼠模型可广泛用于基于FXII靶点开发的小分子抑制剂等药物的体内安全性和有效性评价。
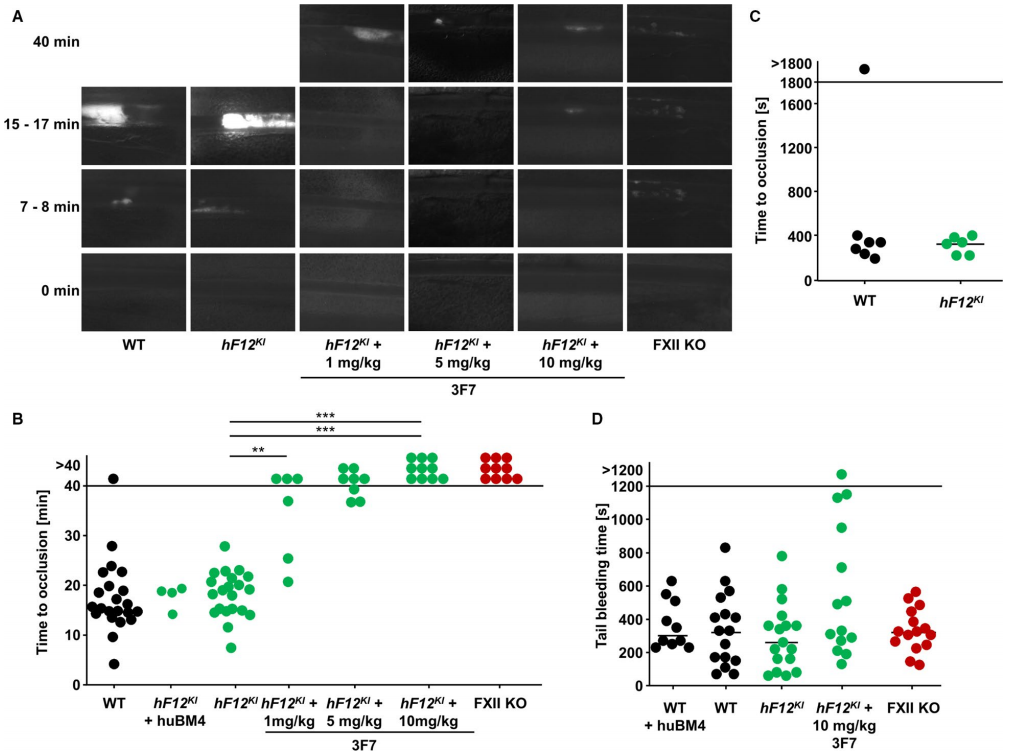
图二 3F7在hF12KI小鼠中抑制FXII引起的血栓形成[5]

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。
人源化基因改造小鼠可以根据不同基因的特性,定制专属的构建方案。本技术受打靶片段长度的限制小,通过细胞打靶构建在“人造精子细胞”中,经细胞水平质控后,一步法快速获得人源化基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:张一鸣
新媒体运营:suway
参考文献
1. Nickel KF, Long AT, Fuchs TA, Butler LM, Renne T. Factor XII as a Therapeutic Target in Thromboembolic and Inflammatory Diseases. Arterioscl Throm Vas. 2017, 37(1):13-20.
2. Girolami A, Ruzzon E, Lombardi AM, Cabrio L, Randi ML. Thrombosis-free surgical procedures in severe (Homozygote) factor XII deficiency: Report of four additional cases and literature review. Clin Appl Thromb-Hem. 2004, 10(4):351-355.
3. Renne T, Pozgajova M, Gruner S, et al. Defective thrombus formation in mice lacking coagulation factor XII.J Exp Med. 2005, 202(2):271-281.
4. Kleinschnitz C, Stoll G, Bendszus M, et al. Targeting coagulation factor XII provides protection from pathological thrombosis in cerebral ischemia without interfering with hemostasis. J Exp Med. 2006, 203(3):513-518.
5. Beck S, Stegner D, Loroch S,et al. Generation of a humanized FXII knock in mouseotection from pathological thrombosis in ce‐thrombotic agents. J Thromb Haemost. 2021, 00:1-6.
6. Wallisch M, Lorentz CU, Lakshmanan HHS, et al. Antibody inhibition of contact factor XII reduces platelet deposition in a model of extracorporeal membrane oxygenator perfusion in nonhuman primates. Res Pract Thromb Haemost. 2020, 4(2):205-216.
7. Larsson M, Rayzman V, Nolte MW, et al. A Factor XIIa Inhibitory Antibody Provides Thromboprotection in Extracorporeal Circulation Without Increasing Bleeding Risk. Sci Transl Med. 2014, 6:222.

