技术分享:开发阿昔洛韦调控基因表达的毒性外显子
使用小分子药物精确调控基因表达是一种具有治疗潜力的研究工具,目前最广泛使用的是强力霉素激活基因表达的Tet-On系统[1]。但操纵Tet-On系统需要表达强力霉素敏感转录激活因子,为此需要构建工程化细胞系[2]。为突破这一限制,mRNA自身能够结合小分子药物是个理想的系统,如Xon和pA调节器系统。Xon使用小分子branaplam结合剪接位点,促使外源基因中包含翻译必需起始密码子的外显子被保留[3]。pA调节器系统则是在转录本的5’非翻译区整合了多个四环素结合适配体,该mRNA通常仅产生不稳定的截短转录本,但结合四环素后,就能启动合成完整长度的mRNA[4]。小分子药物诱导基因表达的最佳方法必须满足三个关键标准:1)激活小分子的无毒;2)该系统能够调节任何基因,包括转基因和内源性基因;以及3)具有“无痕”能力,这意味着最终表达的蛋白质产物没有外源序列的残留。然而,Xon和pA调节器系统使用的小分子药物可能产生毒副作用,亟需开发一种不受药物毒性、基因序列或内源性调控元件限制的无痕调控基因表达系统。
2025年11月,Nature Methods上报道了一种由阿昔洛韦调控的毒性外显子盒Cyclone,可用于调控哺乳动物转基因和内源性基因的表达。Cyclone是一种简便的“内含子-毒性外显子-内含子”元件,可以插入几乎任何基因。当毒性外显子被剪接到转录本中时,它会引入一个过早的终止密码子,导致蛋白质被截短和失活;反之,若毒性外显子被剪接跳跃,则能合成完整的天然功能性蛋白。Cyclone具有低背景和高效调控基因表达的能力,阿昔洛韦诱导激活倍数高达295倍。该研究为基因表达调控提供了一种很有潜力的研究工具,Cyclone展现出可诱导、可逆且无痕的基因表达调控优越性[5]。
为实现无痕的小分子药物诱导基因调控,研究者借鉴了毒性外显子的作用机制(图一a)。这类外显子通常包含提前终止密码子,其剪接受剪接因子结合的调控[6]。当毒性外显子被剪接到转录本中时,它会引入一个过早的终止密码子,导致蛋白质被截短和失活;反之,若毒性外显子被跳跃,则因完全移除该序列而合成完整的功能性蛋白(图一a)。研究者目标构建一个由小分子药物精确调控剪接跳跃的毒性外显子(图一b)。目前已知的剪接调控小分子如branaplam,通过同时结合5’剪接位点与U1 snRNP来促进外显子保留而非跳跃。然而,这类小分子会对全转录组的剪接过程产生广泛性影响。因此,研究者选择能结合RNA适配体而非剪接位点的小分子。RNA适配体通常含有一个螺旋茎环,当小分子结合时会诱导构象变化从而稳定螺旋结构。一个典型的含功能性茎环结构的外显子是运动神经元生存基因SMN1与SMN2的第7号外显子[7]。末端茎环2(TSL2,图一c-d)位于7号外显子末端,其茎区基部包含相邻内含子中5’端剪接位点。由于TSL2部分遮蔽了U1结合序列,约6%的SMN1转录本会发生7号外显子跳跃。
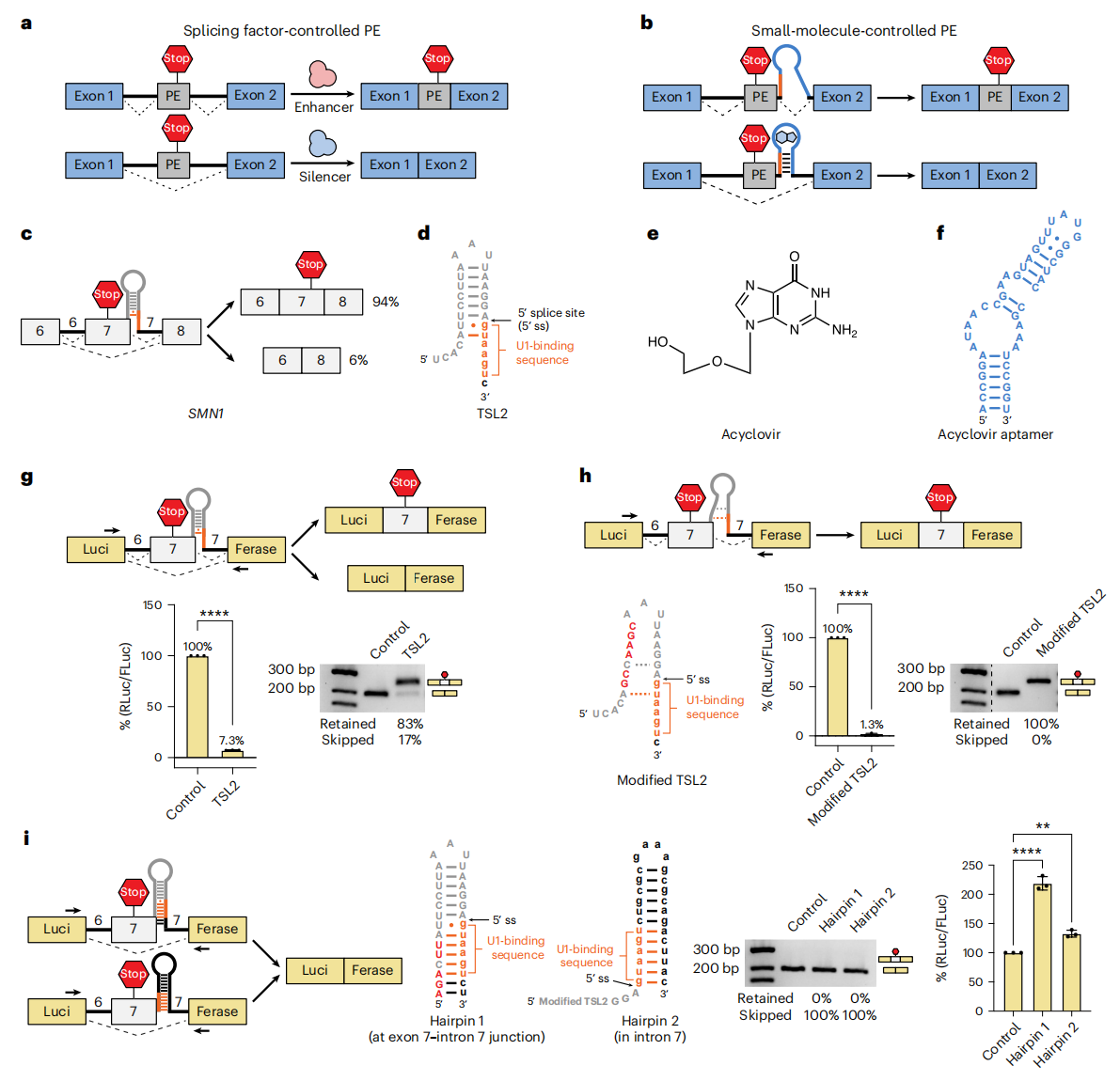
图一 将SMN1基因7号外显子改造为毒性外显子[5]
由于6号内含子长度达5,764个核苷酸,在不影响剪接效率情况下,研究者将6号内含子截短,构建了包含SMN1基因6号内含子-7号外显子-7号内含子(intron 6trunc–exon 7–intron 7)的基础组件(图一g)。该7号外显子含有SMN1的天然终止密码子,当被插入目标基因时,将作为提前终止密码子发挥作用。研究者将组件插入海肾荧光素酶序列的UG521-522与G523位点之间,该位置不仅维持了阅读框结构,还确保7号外显子中的终止密码子能正常发挥作用。结果显示,插入该组件后,荧光素酶表达水平下降约92%(图一g),表明毒性外显子7已被成功剪接入转录本。逆转录PCR结果显示,大部分(约83%)荧光素酶转录本中含有额外约50个核苷酸的序列,与外显子7长度相符(图一g)。表明intron 6trunc–exon 7–intron 7可作为标准化组件,在不同基因的转录本中实现毒性外显子的精准剪接。
为实现小分子调控剪接,研究者选择一种结合阿昔洛韦的适配体(图一e-f),替代TSL2茎环结构的上部区域(图一b)。在无药物状态下,适配体处于相对解折叠状态,由于U1结合序列可自由接触,毒性外显子7将被保留至转录本中,从而阻断目标蛋白的表达。而当加入阿昔洛韦后,适配体及其基部茎区会发生折叠,进而促进下方螺旋结构的稳定形成,遮蔽U1结合序列,促使外显子被跳过,最终实现天然转录本的生成与功能蛋白的表达。研究者验证通过调节TSL2的折叠状态能否实现0%至100%的剪接调控范围。删除了TSL2中的部分碱基对(图一h),使U1结合序列完全暴露。实验结果显示,该操作导致完全无法跳跃外显子7,荧光素酶活性几乎完全丧失(图一h)。相反,当通过添加核苷酸实现与U1结合序列的完全碱基配对时,外显子7近乎完全被跳跃,荧光素酶活性得到完全恢复(图一i),表明通过调控TSL2与U1结合序列的杂交状态,有望实现广范围的剪接精准控制。研究者构建了多种有效遮蔽U1结合序列并诱导外显子7高效跳跃的茎环结构。首个候选结构是TSL2突变体"Hairpin 1",其螺旋茎区与U1结合序列完全杂交(图一i)。还设计了一种纯内含子型茎环"Hairpin 2",两者都能维持高效的荧光素酶表达,表明外显子7跳跃效率未受影响(图一i)。
为使Hairpin 1和2具备阿昔洛韦调控功能,研究者去除每个发夹结构中U1结合序列上方的非必需碱基对,截短了阿昔洛韦适配体中结合位点下方的延伸茎段,将两者融合构建出阿昔洛韦调控剪接盒Ac-Hairpin 1和Ac-Hairpin 2(图二a)。分别将其插入海肾荧光素酶基因组中,检测阿昔洛韦诱导的荧光素酶表达水平。结果显示,Ac-Hairpin 1未表现出阿昔洛韦诱导的发光增强效应,而Ac-Hairpin 2在500 µM阿昔洛韦处理后发光强度显著提升29倍(图二b)。在阿昔洛韦适配体和Hairpin 2之间添加一个、两个或三个额外的碱基对来增加U1结合序列的隔离(图二c)。含有额外U•A碱基对的转导子1在基因激活方面表现出最大的改善,显著提升34倍,同时保持了低背景表达(图二d)。还检测了不同转导子,以Ac-Hairpin 2转导子7(Ac-H2Tr7)为例,阿昔洛韦使基因表达量提升295倍(图二c-e)。
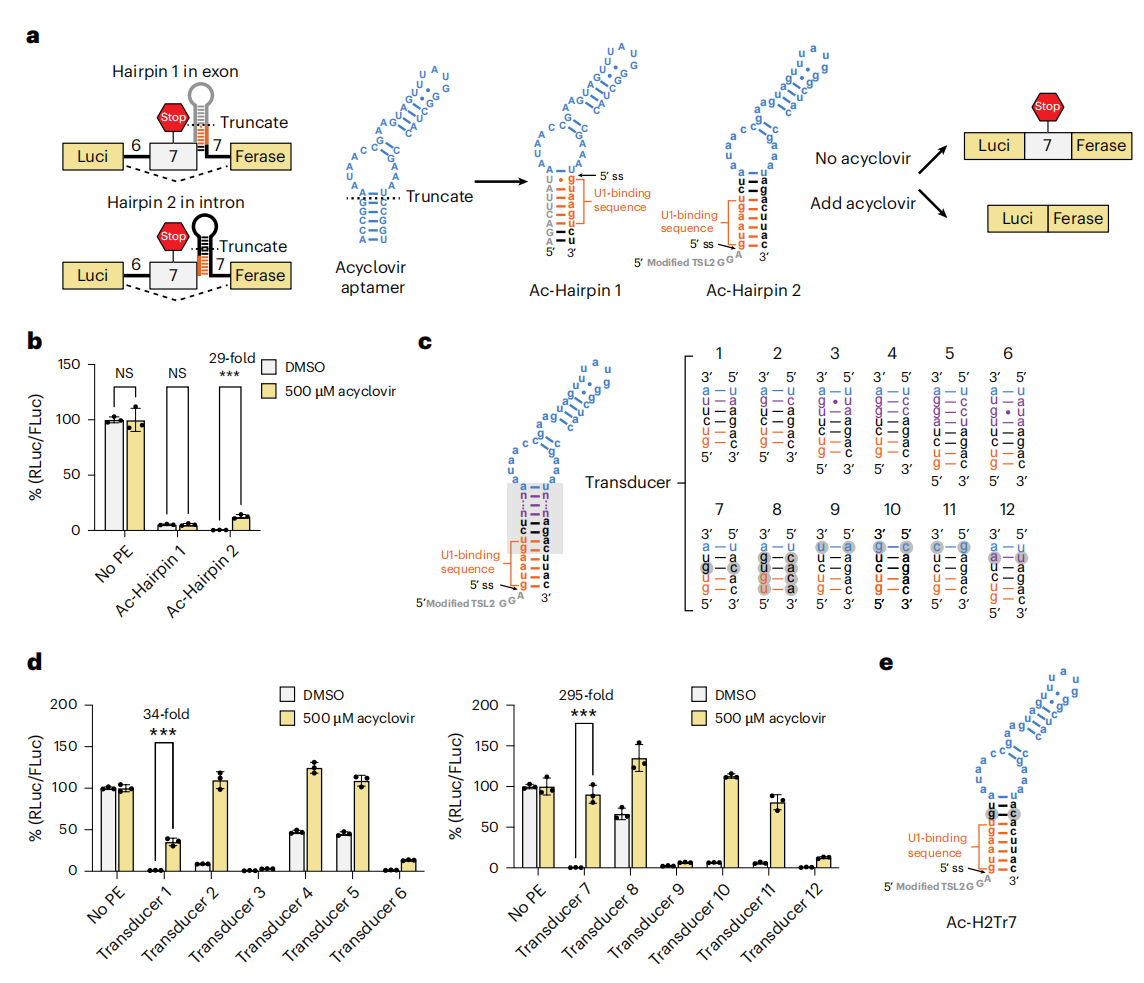
图二 通过阿昔洛韦适配体调控SMN1基因7号外显子的跳跃[5]
接下来,研究者在三种不同来源的细胞系中表达了含有Ac-H2Tr7的海肾荧光素酶。在Huh-7和HT-1080细胞中,观察到背景表达水平升高,表明即使没有阿昔洛韦,Ac-H2Tr7也会小比例跳跃(图三a)。为解决这一问题,研究者尝试使用更高效的内含子连接序列来修饰侧翼内含子,以增强剪接效率。最终,获得包含β-珠蛋白/IgG嵌合内含子的前100个核苷酸和6号内含子的末端138个核苷酸并保留SMN1的7号内含子的构建体,命名为Ac-H2Tr7In4(图三b)。在六种细胞系中测试,发现所有细胞类型中都表现出低背景以及阿昔洛韦诱导的荧光素酶高表达(图三c),将Ac-H2Tr7In4命名为Cyclone。
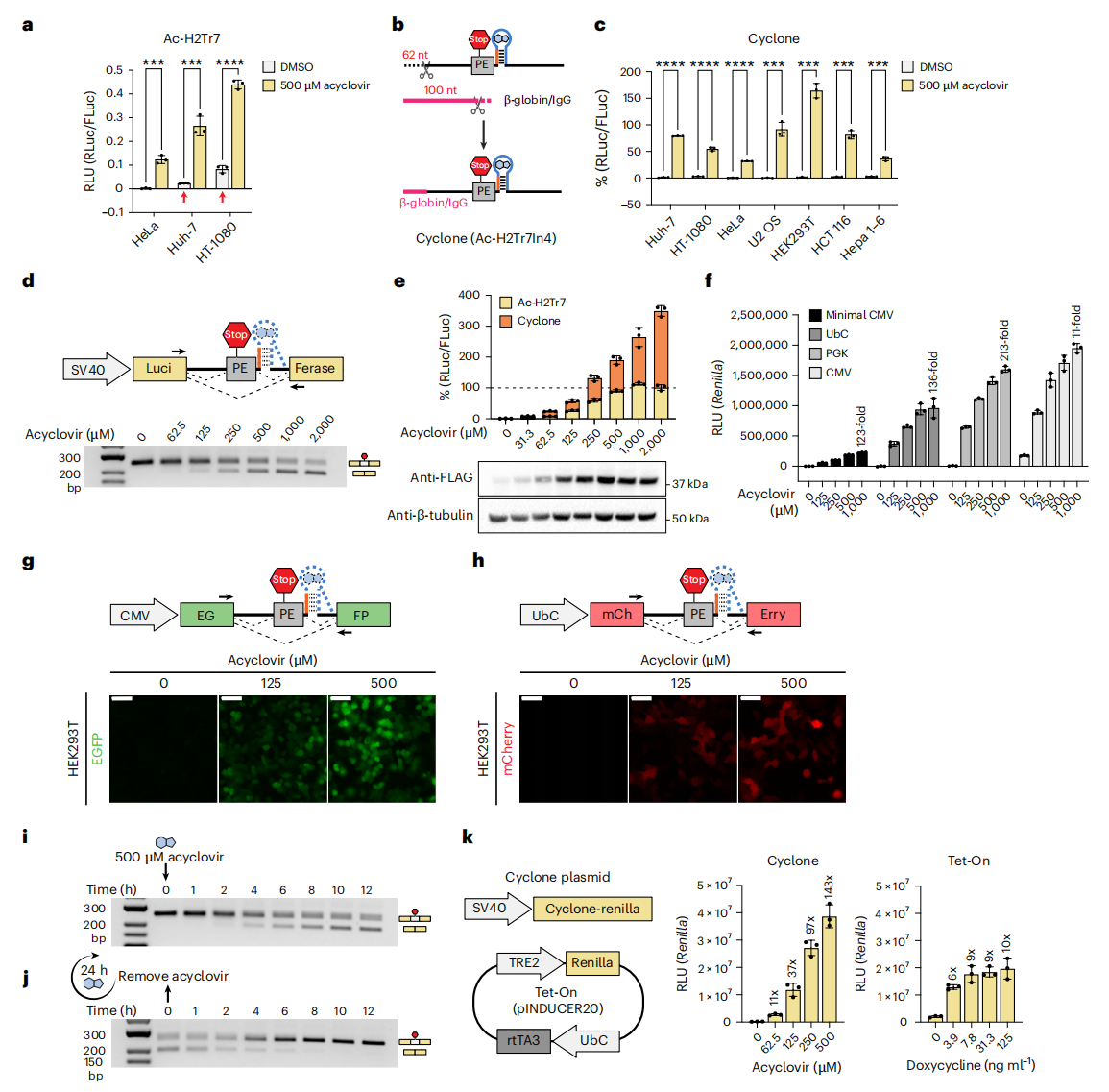
图三 表征Cyclone基因调控的通用性、剂量依赖性及可逆性[5]
下一步,研究者验证Cyclone能否以阿昔洛韦剂量依赖性调控基因表达。在HEK293T细胞中表达含Cyclone的海肾荧光素酶,并用不同浓度的阿昔洛韦(0 µM至2 mM)处理48小时。未添加阿昔洛韦时,RT-PCR检测到250 nt单一产物,随着阿昔洛韦浓度升高,出现196 nt产物(图三d)。蛋白质表达量随阿昔洛韦浓度的增加而上升,在250 µM时达到与不含毒性外显子的对照组相当的水平(图三e)。使用不同强度的启动子时,同样观察到阿昔洛韦依赖性的荧光素酶表达调控(图三f)。Cyclone调控的EGFP和mCherry构建体也显示出类似的剂量依赖性蛋白表达(图三g-h)。为探究阿昔洛韦诱导的外显子跳跃时间进程,用500 µM阿昔洛韦处理HEK293T细胞。处理约4小时后即可检测到外显子跳跃现象,6小时跳跃程度达到峰值(图三i)。评估该效应的可逆性,预先用500 µM阿昔洛韦处理细胞24小时,再更换为不含阿昔洛韦的新鲜培养基。移除6小时后,几乎所有转录本均恢复为包含毒外显子的状态(图三j),Cyclone系统的背景表达量和诱导水平显著优于高度优化的Tet-On系统(图三k)。以上数据表明,Cyclone系统通过简便的组件设计即可实现高效的基因调控。
接下来,研究者测试了Cyclone是否适用于诱导不同转基因的无痕表达。在小鼠血小板生成素Thpo的两个位点之间插入Cyclone(图四a)。通过HEK293T细胞表达单个Cyclone-Thpo构建体后,采用酶联免疫吸附测定法(ELISA)检测培养基中的血小板生成素水平。结果显示,两个插入位点的血小板生成素表达均呈现阿昔洛韦剂量依赖性,且具有极低的背景信号和相似的最高激活水平(图四b)。将Cyclone插入Cre重组酶的编码序列,并将其转染至loxP-GFP Cre报告基因N2a细胞系(图四c)。未使用阿昔洛韦时,Western blot检测未发现Cre表达,且 GFP 表达量极低;随着阿昔洛韦剂量增加,Cre表达量显著提升,约40%的细胞呈现绿色荧光(图四d-f)。还构建了嘌呤霉素N-乙酰转移酶(PAC)-P2A-EGFP融合蛋白(图四g),将Cyclone插入pac基因,并在含阿昔洛韦的培养基中诱导融合蛋白表达,经嘌呤霉素筛选的HEK293T细胞显示出阿昔洛韦剂量依赖性的PAC表达(图四h)和EGFP表达(图四i)。以上数据表明,Cyclone能够实现多种转基因的阿昔洛韦依赖性无痕表达调控。
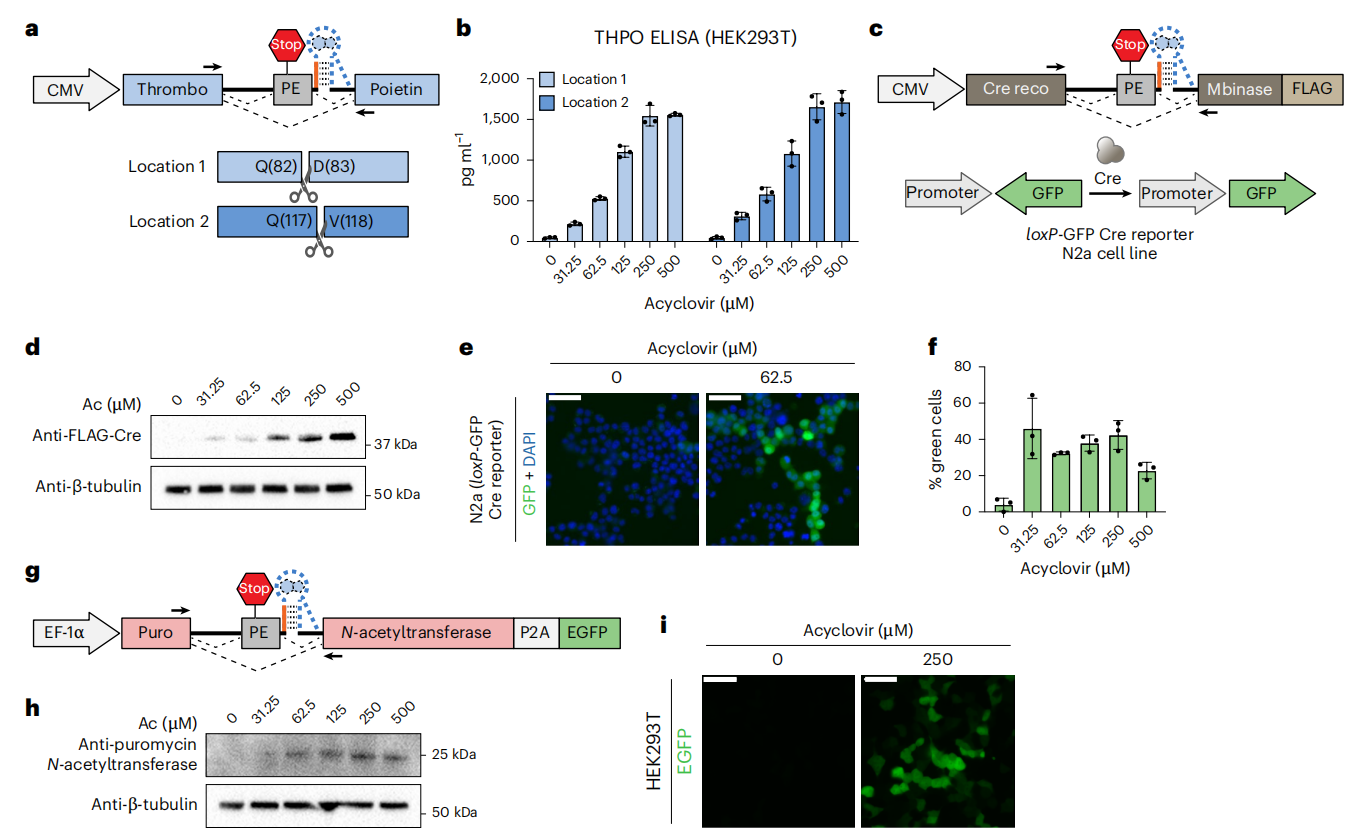
图四 Cyclone实现多种转基因的无痕表达调控[5]
最后,研究者采用Pac-Cyclone盒(图五a)来快速筛选基因组整合的克隆。Pac-Cyclone盒通过CRISPR介导的同源定向修复(HDR)敲入技术,插入在内源基因起始密码子之后。选择两个内源基因WTAP(图五b)和PCIF1(图五c)在HCT116细胞中进行测试。细胞转染后,在250 µM阿昔洛韦培养基中培养以维持内源基因表达,随后添加嘌呤霉素筛选稳定整合细胞(图五d)。通过WTAP抗体的Western blot可清晰检测到内源性WTAP蛋白,以及FLAG-WTAP的对应条带(图五e)。FLAG-WTAP的表达量可通过阿昔洛韦剂量进行调控,PCIF1蛋白也呈现类似表达模式(图五e-f)。随后进行单克隆筛选获得纯合敲入的HCT116细胞,Western blot仅观察到单一的FLAG-WTAP条带(图五g)。将细胞在不同浓度的阿昔洛韦中培养5天,发现WTAP表达呈剂量依赖性,且在0 µM阿昔洛韦时检测不到WTAP表达。值得注意的是,当阿昔洛韦浓度高于62.5 µM时,WTAP水平会超过野生型细胞的表达量。通过使用与靶向WTAP基因组位点相邻的引物进行RT-PCR,证实了阿昔洛韦诱导的毒外显子跳跃现象(图五g)。以上数据表明,Pac-Cyclone能够实现阿昔洛韦依赖性的内源基因表达调控,既可达到低于生理水平的表达,也可实现高于生理水平的表达,即通过调节阿昔洛韦剂量,可同时实现內源性基因KO、生理表达或过表达。
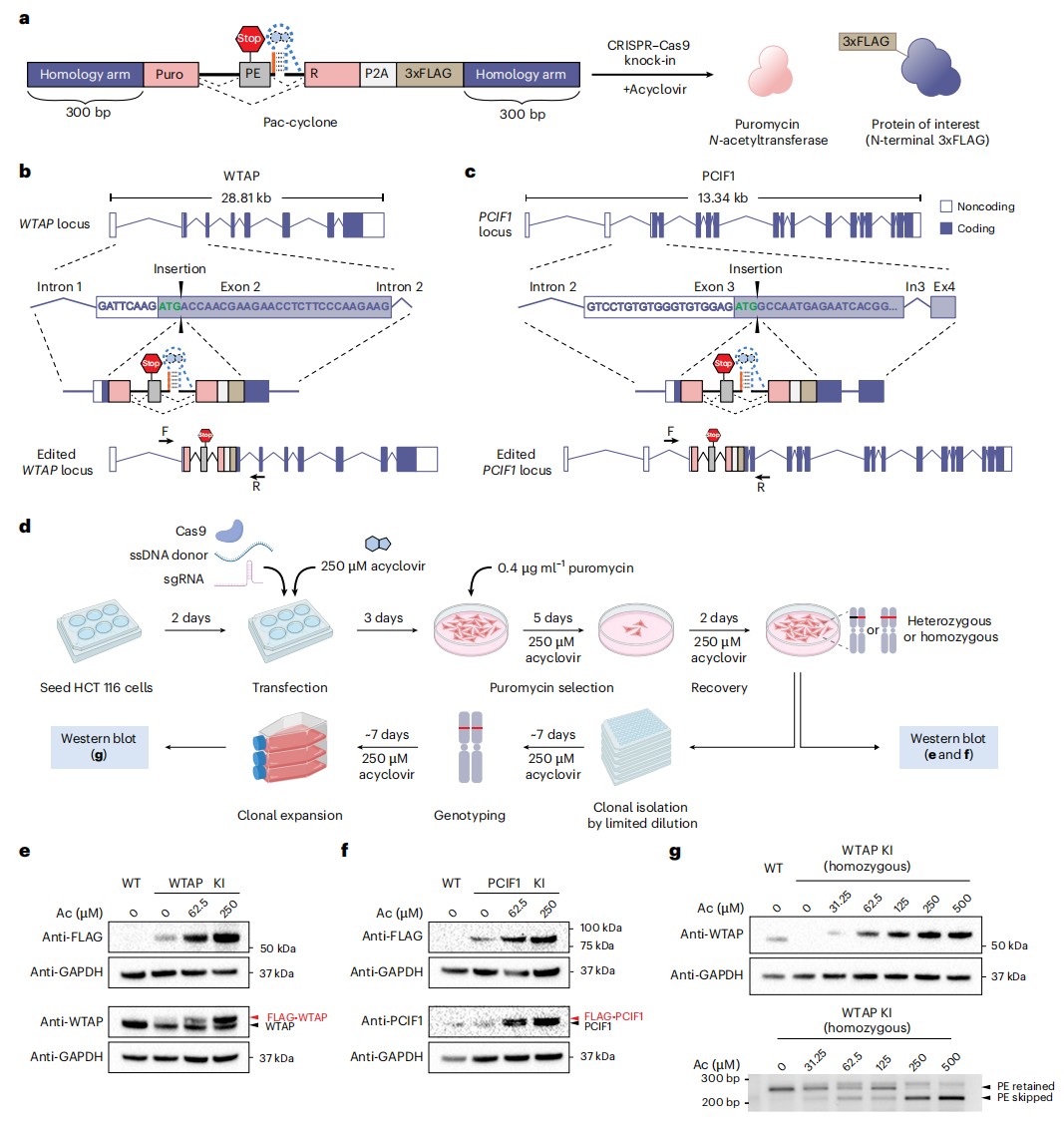
图五 Pac-Cyclone对内源性基因的调控[5]
综上所述,该研究开发了一个使用阿昔洛韦调控的毒性外显子盒Cyclone进行转基因和内源性基因的可调且可逆表达系统。Cyclone盒包含了来自SMN1基因的第7号外显子与工程化内含子,将其插入基因中可产生非活性基因。Cyclone技术可实现基因表达的无痕调控,不会对转录本或蛋白质进行永久性修饰。此外,Cyclone技术无需替换上游调控元件,从而保留了内源性基因的组织特异性表达模式和剂量依赖性表达特征。该研究为小分子药物精确调控基因表达提供了一种很有价值的研究工具,在合成生物学领域展现出广阔的应用前景。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Das AT, Tenenbaum L, Berkhout B: Tet-On Systems For Doxycycline-inducible Gene Expression. Current gene therapy 2016, 16(3):156-167.
2. Heinz N, Hennig K, Loew R: Graded or threshold response of the tet-controlled gene expression: all depends on the concentration of the transactivator. BMC biotechnology 2013, 13:5.
3. Monteys AM, Hundley AA, Ranum PT, Tecedor L, Muehlmatt A, Lim E, Lukashev D, Sivasankaran R, Davidson BL: Regulated control of gene therapies by drug-induced splicing. Nature 2021, 596(7871):291-295.
4. Luo L, Jea JD, Wang Y, Chao PW, Yen L: Control of mammalian gene expression by modulation of polyA signal cleavage at 5' UTR. Nat Biotechnol 2024, 42(9):1454-1466.
5. Hou Q, Oleynikov M, Mei X, Dong L, Hagen T, Jaffrey SR: A portable poison exon for small-molecule control of mammalian gene expression. Nat Methods 2025, 22(11):2337-2348.
6. Leclair NK, Brugiolo M, Urbanski L, Lawson SC, Thakar K, Yurieva M, George J, Hinson JT, Cheng A, Graveley BR et al: Poison Exon Splicing Regulates a Coordinated Network of SR Protein Expression during Differentiation and Tumorigenesis. Mol Cell 2020, 80(4):648-665.e649.
7. Singh NN, Singh RN, Androphy EJ: Modulating role of RNA structure in alternative splicing of a critical exon in the spinal muscular atrophy genes. Nucleic Acids Res 2007, 35(2):371-389.
转载请注明来源于【GTP研发中心】
声明:本文仅用于分享,不代表GTP研发中心立场,若有侵权,请及时联系我们第一时间更正!



