技术分享:主要变异与次要变异互作驱动复杂疾病的表型多样性
大规模测序揭示了基因组变异与遗传性疾病之间存在着复杂联系,使得识别患者的遗传病因更具挑战性[1]。与单一高外显率基因导致的孟德尔疾病不同,许多疾病往往表现出广泛的表型异质性,即使携带相同变异的患者之间也表现出一系列外显率变化的表型。这种差异通常源于多个遗传因素的叠加效应。其一,一些患者携带了多重遗传变异,即不同的致病变异分别导致同一患者的多种独立疾病[2]。其二,变异之间的协同作用也能产生新表型,例如由MKS1和BBS1双变异引起的癫痫[3]。其三,致病变异表型被不致病的次要变异所改写,也会造成疾病异质性[4]。这种复杂性在神经发育障碍中尤为显著,由主要变异与次要变异以不同频率和贡献度产生的联合效应,造成该疾病的广泛异质性。
近期研究发现,多基因风险的贡献度与致病拷贝数变异(CNV)有关[5, 6]。罕见的复发性CNV是研究表型可变外显性的极佳模型,因为大量重复或缺失的基因增加了与遗传修饰因子相互作用的概率[7]。例如,16p12.1缺失富集在神经发育特征儿童中,并且超过90%先证者的父母表现出不同精神疾病和认知特征[8-10]。该缺失携带者的表型呈现出高度异质性,起初报道在发育迟缓(DD)儿童中,在不同人群研究中则与多种精神疾病和认知特征相关。与携带相同缺失的父母相比,表型更严重的先证者还携带了其他的罕见变异。这些发现支持了复杂疾病病因的"multi-hit"模型:主要变异使个体对疾病易感,而最终临床表型则受基因组上其他次要变异所影响。然而,这些次要变异是如何改写各种主要变异的临床特征,目前尚未完全明了。
2025年10月,Cell期刊在线发表了一项研究,系统性地揭示了疾病相关变异如何影响个体的临床表型。研究者对来自不同队列的携带主要变异的个体进行表型与基因组数据的综合分析。首先在124个携带16p12.1缺失的家系中,发现不同的罕见和常见变异类别赋予了特定发育特征的风险。其次,通过对976名来自疾病队列与健康人群的16p12.1缺失携带者数据分析,发现次要变异在不同招募标准队列中对临床特征呈现相反作用。最后,对1479名携带其他主要变异的先证者和1528名没有主要变异的先证者进一步分析表明,表型关联因主要变异背景而异,并受到主要和次要变异之间协同相互作用的影响。概括来说,在不同队列、表型及主要变异筛选标准的影响下,次要变异的作用模式会改变携带疾病相关主要变异个体的最终表型结局。该研究为剖析复杂疾病的个性化基因组架构提供了一个范例,强调了在多种情况下评估全谱次要变异的重要性,以揭示主要变异个体出现异质性临床特征的病因,对未来的基因检测、遗传咨询和个性化治疗提出深刻启示[11]。
首先,研究者从携带16p12.1缺失的首要临床特征为发育迟缓(DD)患者中,招募了来自124个家系的442人(包含缺失携带者261人),组成了DD队列,其中包括了8个三代家庭(图一)。表型分析来自医疗记录、家庭访谈和线上评估量化特性,后者包括非语言智商和评估自闭症相关社交特性的社交反应量表。结果显示,约 93%的DD先证者(84/90)的缺失源自遗传,其中略偏向于母系遗传(48/84,57%),且70%(87/124)的先证者为男性。先证者表现出六种广义临床特征,包括智力障碍/发育迟缓、行为异常、精神疾病、神经系统异常、先天性异常、生长/骨骼异常(图二A)。在儿童期发育和行为特征方面,先证者表现出比血缘性兄弟姐妹更严重的表型,携带缺失的血缘性兄弟姐妹表型次之(图二A)。遗传该缺失的携带者父母,常表现出精神疾病表型(图二B)。进一步分析显示,与携带者父母相比,先证者的非语言智商显著降低1.98个标准差,社交反应量表评分则增加1.91个标准差。16p12.1缺失先证者的平均智商比来自Simons Simplex Collection(SSC)的自闭症患者低1.06个标准差,平均社交反应量表评分比SSC先证者高0.38个标准差,比16p11.2缺失或重复的先证者高0.96个标准差(图二C)。除了精神疾病特性外,16p12.1缺失先证者还表现出头围减小和体重指数升高(图二C)。相比血缘性兄弟姐妹,先证者在多个发育特性上表现出显著延迟(图二D)。以上结果表明,本DD队列的先证者均表现出一系列发育异常特征,其智商与社会反应能力缺损程度,甚至超过自闭症或16p11.2缺失的其他队列先证者
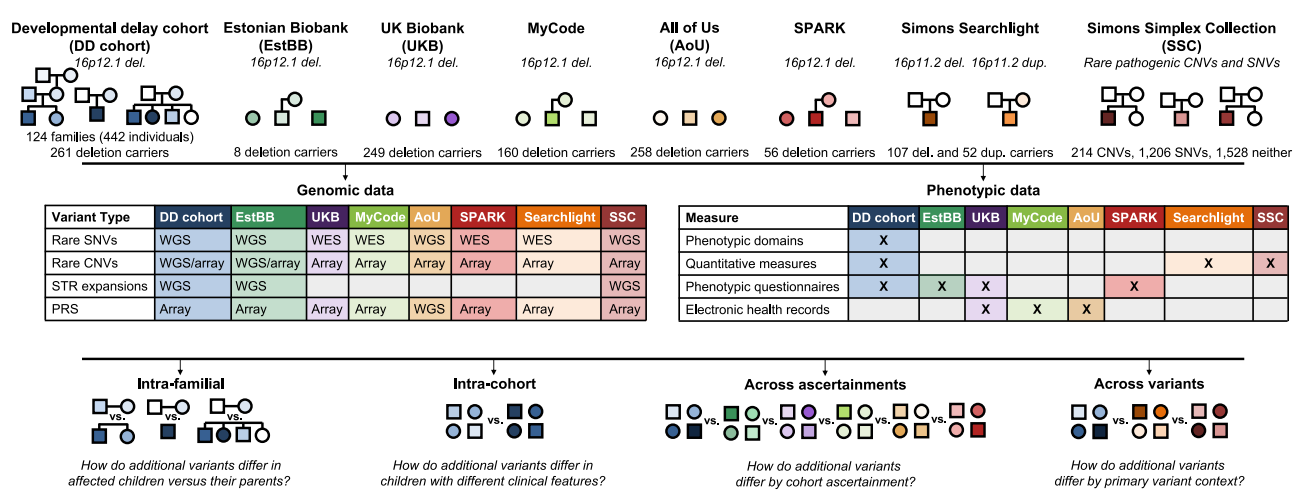
图一 对携带主要变异家系的2455个体进行次要变异表型分析[11]
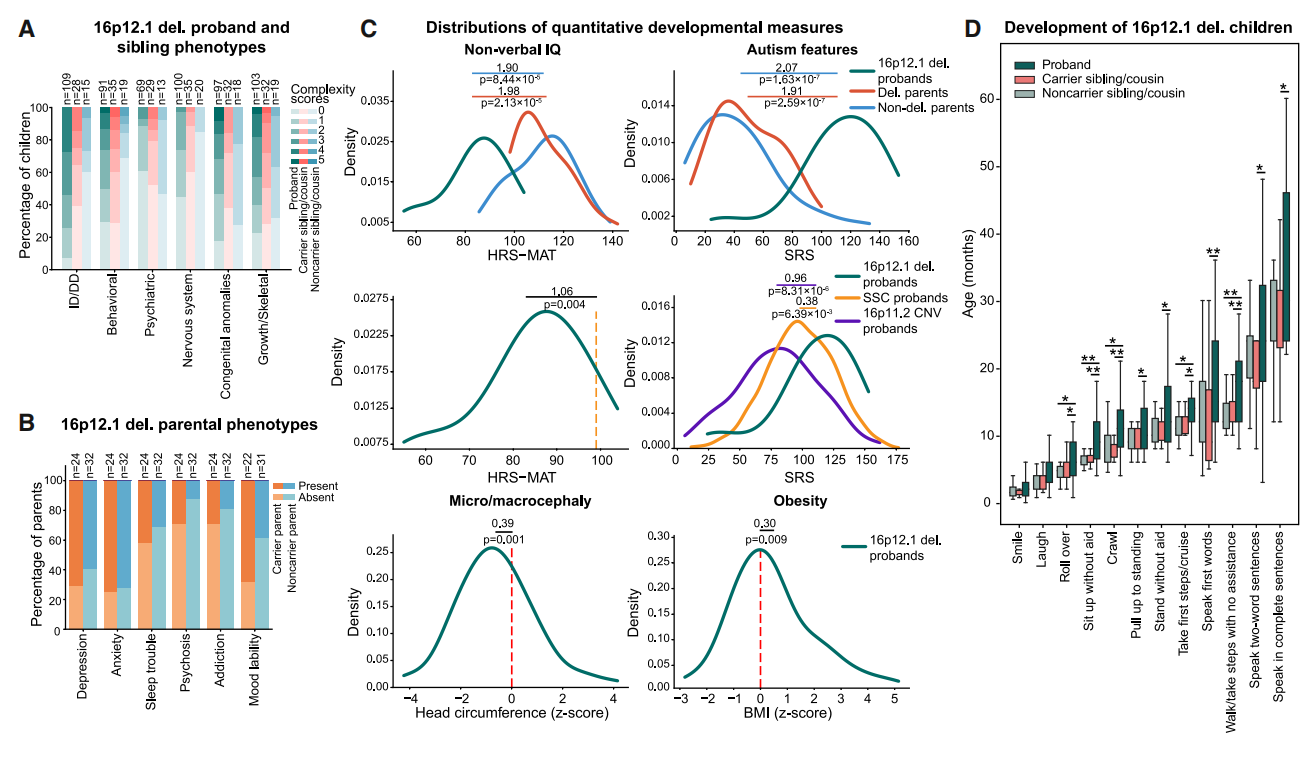
图二 16p12.1缺失家系成员的表型分析[11]
基于全基因组测序(WGS)和ClinVar等数据,研究者系统评估了17类次要变异,包括:罕见编码区单核苷酸变异(错义、剪接位点及功能缺失变异)、非编码区单核苷酸变异(5’端非翻译区、启动子及增强子区域变异)、罕见拷贝数变异(缺失与重复)以及短串联重复序列扩张,其中部分变异会破坏进化保守基因(LF)。结果显示,31%的16p12.1缺失先证者(31/99)携带至少一类次要变异,这些变异可解释部分观察表型,但未发现单个次要变异能完全解释先证者个体的全部临床表现。于是,研究者比较了先证者与其父母之间的次要变异模式。与携带者父母相比,先证者携带更多的LF错义变异和更高的精神分裂症多基因风险评分。与非携带者父母相比,先证者有更多的LF功能缺失变异(图三A)。但来自父母任一方的遗传性次要变异负荷未见显著差异。在三代家系中,变异负荷随着世代递增,这与缺失携带者表型严重程度的增加相对应。例如,在家系GL_077中,携带者外婆有轻度认知特征,携带者母亲表现出精神疾病特征,而至先证者则有神经发育异常特征(图三B)。进一步解析次要变异的功能,发现错义变异在脑组织表达基因、进化保守基因及突触后致密区基因中显著富集,而功能缺失变异基因并不在这些基因集中。单核苷酸变异主要富集在成人运动皮层的不同神经元类型基因中,包括兴奋性神经元和抑制性神经元(图三C)。此外,在来自三个16p12.1缺失家系的12名个体中,发现次要变异富集在16p12.1缺失基因的神经祖细胞共表达基因中。例如次要变异富集在VWA3A、CDR2以及MOSMO、POLR3E和UQCRC2的神经祖细胞共表达基因模块中(图三D),表明次要变异可能在神经元发育过程中与16p12.1基因发生相互作用,影响个体神经发育。以上结果表明,多种类型的次要变异导致了16p12.1缺失先证者的表型异质性。
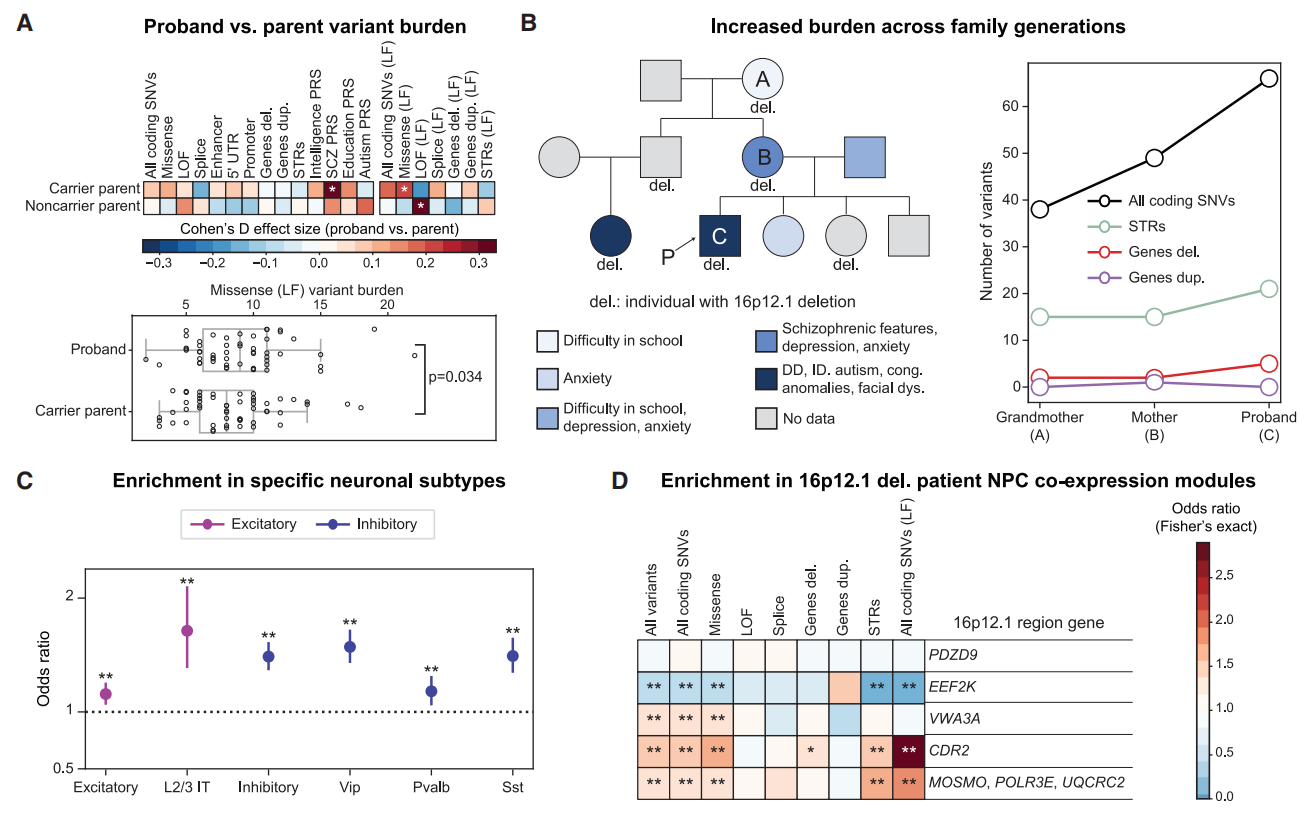
图三 16p12.1缺失家系成员的次要变异对疾病表型的贡献分析[11]
研究者进一步探究16p12.1区域上的基因与次要变异在先证者体内相互作用的生物学机制。既往功能研究表明,该缺失区域内的7个组成基因分别影响独立的细胞通路和功能,例如UQCRC2影响线粒体呼吸,而POLR3E影响tRNA转录[12]。研究者分析每个16p12.1基因之间的蛋白质相互作用网络。结果显示,每个16p12.1基因的一级连接基因之间没有重叠(0/40个基因),即使包括二级连接基因重叠也很少(5.8%,17/295个基因,图四A)。对16p12.1相互作用基因进行GO分析,与其生物学功能高度吻合(图四C)。例如POLR3E的连接基因在转录和DNA代谢功能中富集,这与POLR3E在RNA聚合酶III中的作用一致[13],UQCRC2的连接基因与代谢相关,这与UQCRC2在线粒体呼吸链中的作用一致。此外,研究者检查了16p11.2 拷贝数变异区域基因的连接性,该区域的缺失携带者通常表现出较少的表型异质性[14]。发现16p11.2基因彼此之间显示出更强的相互作用网络,多个16p11.2基因间共享4.20%(6/143)的一级连接基因,当纳入二级连接基因时,相互作用重叠比例显著升高至29.6%(212/717,图四B)。研究者推测由于16p12.1基因影响通路的多样性,增强了其叠加次要变异后的表型高度可变性。
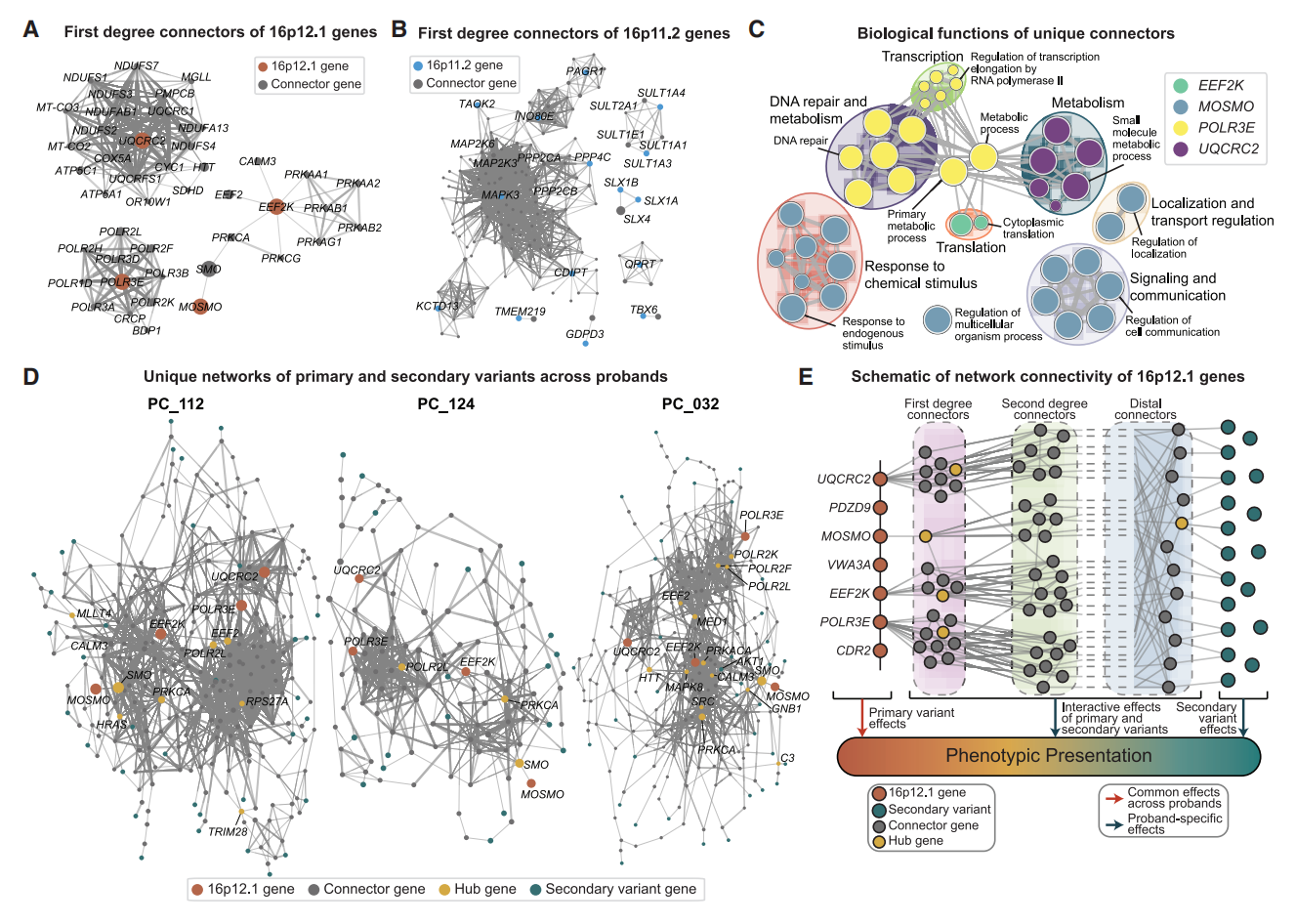
图四 主要变异和次要变异的基因相互作用网络分析[11]
进一步分析16p12.1基因与次要变异基因的相互作用网络,发现交互枢纽基因存在先证者共享的(如SMO)和个体独有的两种模式。例如,PC_112(单纯自闭症,如HRAS、MLLT4)、P1C_124(自闭症合并智力障碍/发育迟缓)和PC_032(单纯智力障碍/发育迟缓,如AKT1)三位先证者拥有不同的枢纽基因(图四D),提示了即便在表型相似的先证者之间,介导主要变异与次要变异效应的网络路径和拓扑结构可能具有个体特异性。因此,个体不同的次要变异对不同功能和通路造成破坏,可能是16p12.1缺失家系观察到的表型多样化的内在机制(图四E)。
接着,研究者使用逻辑回归模型评估罕见变异类别和多基因风险评分对先证者表型的影响,发现罕见编码变异与神经系统特征和生长/骨骼异常显著相关(图五A)。具体而言,短串联重复序列与神经系统特征相关,而单核苷酸变异与生长/骨骼特征相关,相比之下,精神分裂症多基因风险评分与行为表型呈负相关(图五A)。通过线性回归模型检验变异类别对性状的影响,发现单核苷酸变异与头围Z评分呈负相关(图五B)。这些结果表明,不同类别的次要变异对表型的修饰作用具有显著差异性。此外,表型相似先证者的次要变异在生物学功能和通路上呈现特异性富集模式。具有生长/骨骼缺陷的先证者的次要变异在神经发生基因中富集,而行为异常先证者的变异则富集于Hedgehog信号通路基因(图五C)。其中一些富集通路与16p12.1基因存在重叠,例如MOSMO的细胞分化和Hedgehog信号通路[15]。此外,具有特定表型的先证者显示出关键神经元基因中罕见变异负荷的增加。例如先天性畸形或神经系统特征先证者富集自闭症候选基因,而神经系统特征先证者还富集发育性脑疾病基因(图五D)。表明不同表型先证者中受影响通路的多样性,凸显了16p12.1缺失携带者的生物学功能紊乱的复杂性。
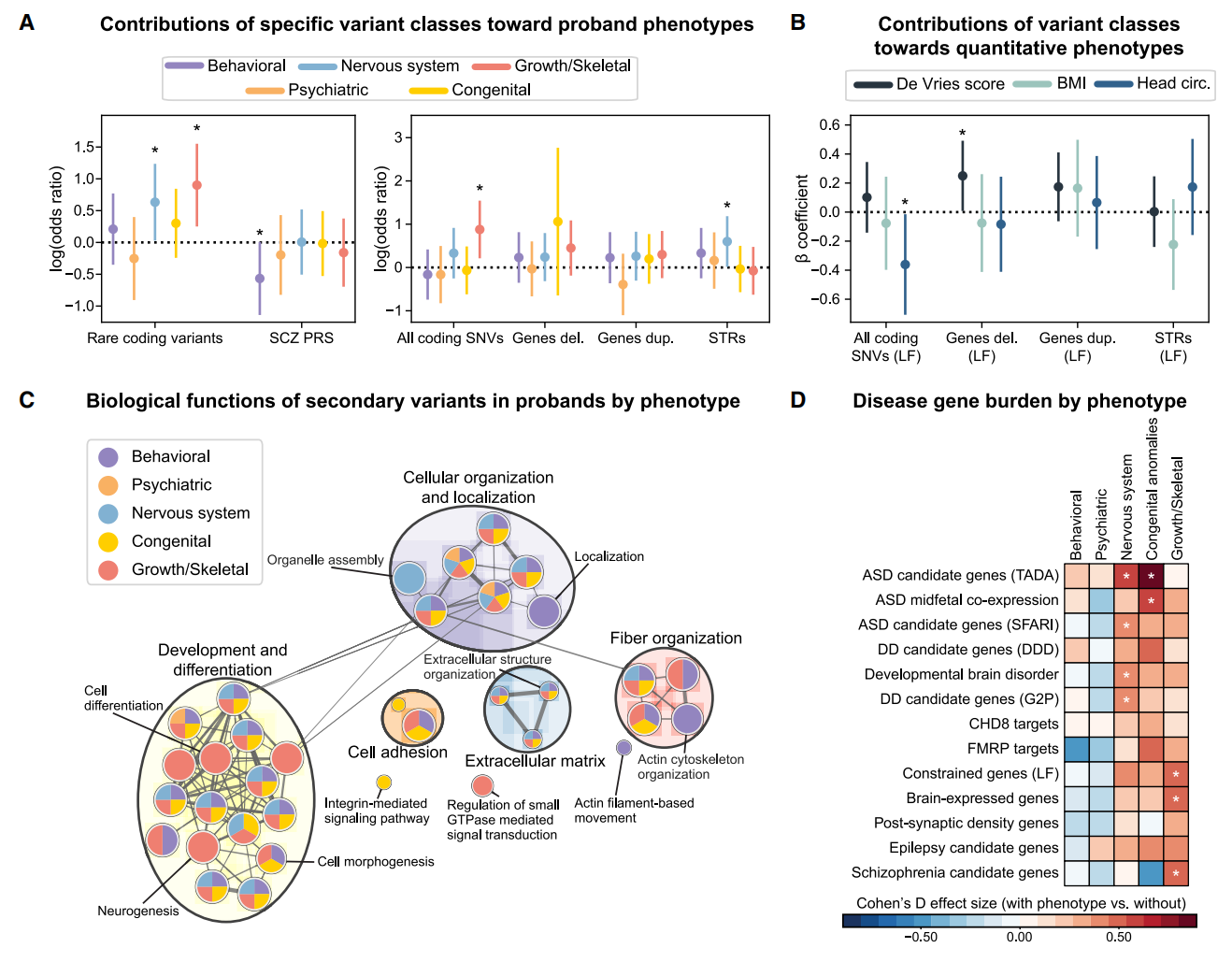
图五 16p12.1缺失先证者表型与次要变异的关联[11]
临床结果的定义会因研究队列的招募标准不同而产生差异,特别是在以患病人群为基础的队列与普通人群队列之间。为规避这种队列偏倚,研究者将分析扩展到四个不同来源、总计976名16p12.1缺失携带者的大规模队列。这些队列包括:DD队列,以自闭症特征先证者家系为招募对象的SPARK 队列,英国健康人群UKB队列,医院来源的MyCode和多元化人群AoU队列(图六A)。为了比较不同队列的表型发生率,研究者统一了电子健康记录和临床问卷回复。正如预期的那样,神经精神表型的发生率在不同队列中存在显著差异(图六A)。UKB队列中16p12.1缺失携带者表现出显著糖尿病、肥胖症、慢性肾功能衰竭和高血压,身体质量指数(BMI)显著增加(图六B)。UKB队列的缺失携带者错义变异负荷显著低于无大片段拷贝数变异的对照组(图六C),而AoU队列携带者的单核苷酸变异负荷则高于对照组。在UKB中,自闭症多基因风险评分与抑郁、焦虑及睡眠障碍显著相关,相反,罕见变异在UKB和DD队列成人中均与精神症状呈负相关(图六D), 提示多基因风险评分与罕见变异可能对16p12.1缺失成人的精神症状产生相反作用。UKB中神经系统特征与缺失型变异相关,而精神健康特征与重复型变异相关,MyCode队列中自闭症多基因风险评分同时与神经系统特征及癌症相关,AoU队列则观察到所有编码区单核苷酸变异及功能缺失变异与皮肤/皮下组织表型负相关,而错义变异与呼吸系统表型正相关(图六E)。这些差异反映出队列间招募标准的不同,可能源于医疗体系差异、表型判定方式或健康志愿者与患病个体的选择偏倚。进一步发现16p12.1缺失儿童在发育迟缓队列与SPARK队列中存在表型-变异关联的显著差异。在发育迟缓队列中,罕见变异与多基因风险评分均会增加神经发育特征风险,但在SPARK样本中却呈现风险降低趋势(图六F)。总体而言,各队列间次级变异-表型关联存在显著差异(图六D–F),这或许能解释不同招募标准队列中观察到的异质性表型轨迹。为避免这种偏倚, 研究者采用随机效应荟萃分析整合所有队列结果,以识别不受招募偏倚影响的稳健型变异-表型关联。在SPARK与发育迟缓队列的儿童数据中,鉴定出9项显著关联,包括智力多基因风险评分与注意缺陷/多动障碍的关联,以及保守基因内重复变异与智力障碍/发育迟缓的关联(图六G)。综合DD队列与UKB成人数据发现,智力多基因风险评分与焦虑相关,而自闭症多基因风险评分与睡眠障碍相关。通过整合UKB、MyCode和AoU的电子健康档案数据,进一步确认编码区单核苷酸变异对神经系统特征的稳定影响,以及精神分裂症多基因风险评分与精神/行为障碍的关联。
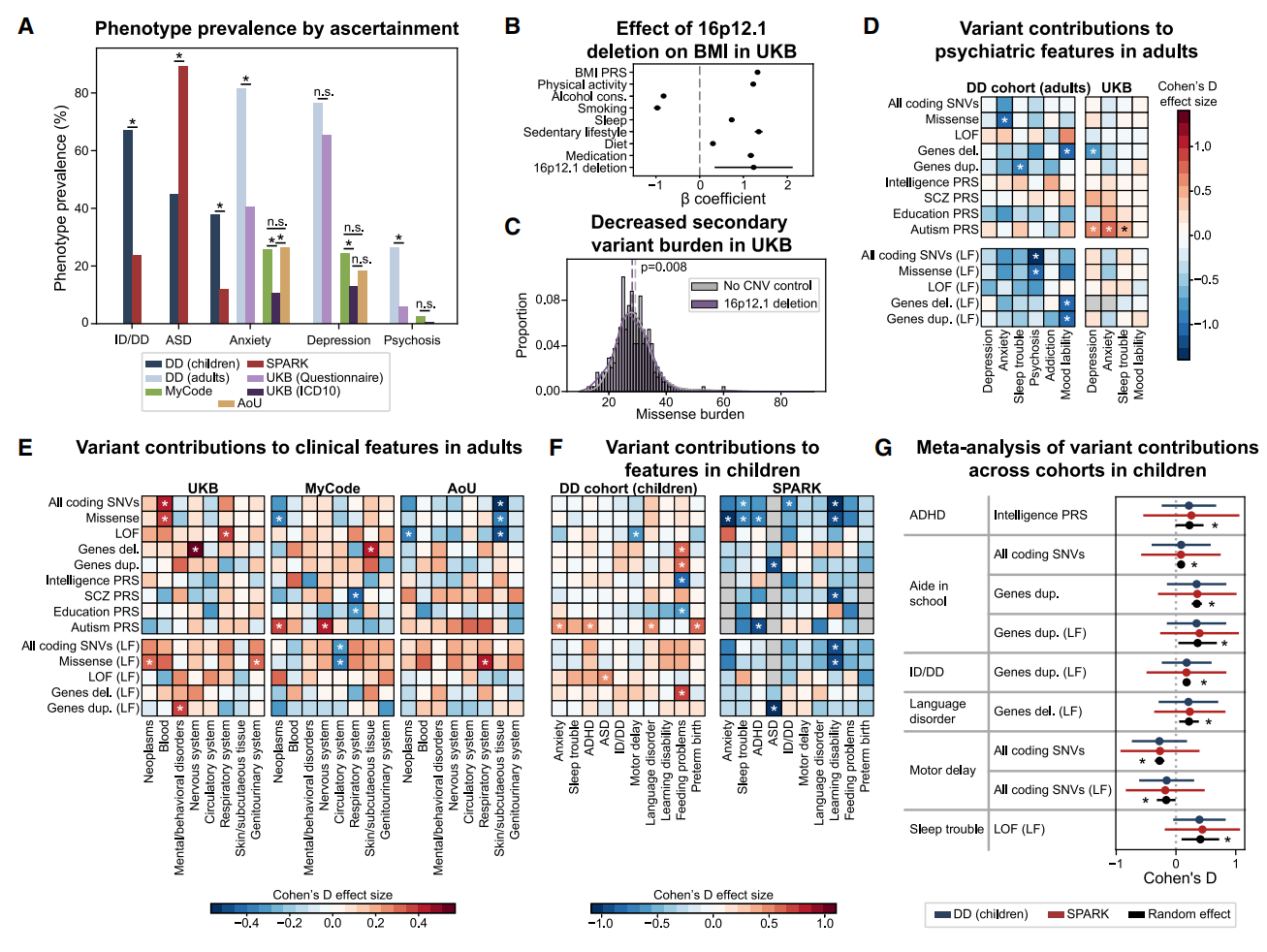
图六 受试者招募标准的差异会导致独特的基因型-表型关联模式[11]
最后,研究者将主要突变拓展至16p12.1缺失之外,评估次要变异对1,479名自闭症先证者表型的影响,这些先证者携带不同的罕见致病性拷贝数变异或神经发育相关基因的单核苷酸变异(图一)。首先评估来自Simons Searchlight队列的 126名携带16p11.2缺失或重复的患者[16],并使用线性回归模型鉴定出十项变异-表型关联(图七A)。在16p11.2缺失先证者中,精神分裂症多基因风险评分与更高的全量表智商(FSIQ) 相关,而次要缺失与智商降低相关,这与之前的发现相似。在16p11.2重复先证者中,次要缺失和重复与自闭症行为特征呈负相关,并且重复变异与社交反应量表评分呈负相关。还分析了来自SSC队列的 214名先证者,他们携带一组更具异质性的大片段拷贝数变异,包括15q13.3、3q29和16p13.11的致病性缺失和重复。在携带大片段缺失的先证者中,线性回归模型发现次要重复变异与BMI呈负相关,而在携带大片段重复的先证者中,次要缺失变异与智商降低相关(图七A)。进一步评估来自SSC队列的 1,206名先证者,他们携带经典神经发育基因单核苷酸变异,发现缺失变异与智商呈负相关,而短串联重复序列与智商增加相关(图七A)。
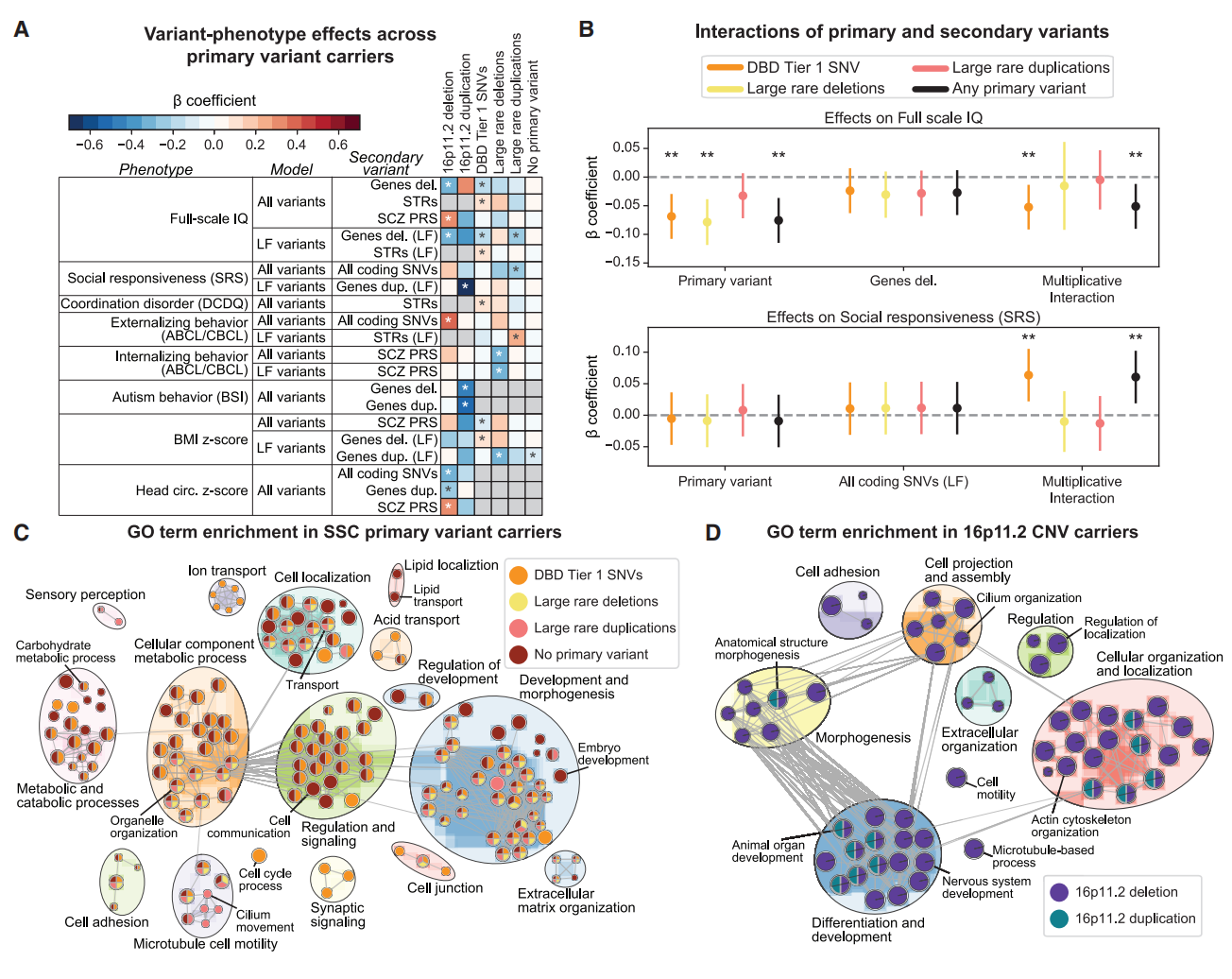
图七 在不同主要变异背景下,次要变异对表型的影响存在显著差异[11]
研究者还检查了1528名不携带主要变异的SSC先证者中的次要变异,回归分析观察到的唯一关联是重复变异与较低的BMI相关(图七A),表明次要变异主要通过与主要变异的相互作用发挥效应,而非直接导致疾病表型。为验证这一点,研究者使用乘法模型来识别主要和次要变异对临床特征的交互效应。共发现了13个交互效应的例子,包括主要单核苷酸变异与次要缺失对总智商的交互影响及对重复行为的交互影响,以及主要单核苷酸变异与次要单核苷酸变异对社会反应量表评分的交互影响(图七B)。值得注意的是,这些交互作用常具有主要变异特异性,进一步支持了"次要变异效应受主要变异背景调控"的假说。当分析次要变异功能时,主要变异背景的重要性愈发凸显(图七C和D)。主要单核苷酸变异先证者的次要变异在突触信号传导中特异性富集,而主要缺失先证者的次要变异则在纤毛运动相关通路中富集(图七C)。16p11.2缺失先证者的次要变异在细胞运动与细胞黏附通路富集,而16p11.2缺失与重复先证者共有的次要变异则在器官发育与解剖结构形态发生中富集(图七D)。蛋白质消化吸收通路特异性富集于16p11.2缺失先证者的次要变异,而催产素信号通路则在16p11.2重复先证者的次要变异中富集。若干16p11.2基因本身具有相似功能,且在16p11.2基因动物模型差异表达基因中共享多个GO富集条目,包括神经元分化与神经突投射等(图七D)。因此研究者提出:次要变异通过在主要变异破坏的通路中产生叠加或协同效应,进而影响发育表型。
综上所述,研究者对来自不同队列的携带主要变异的先证者进行了表型与基因组数据的综合分析。这些先证者通过"遗传学优先"的方法筛选得出,其临床结局呈现高度多样性。以16p12.1缺失家系的发育迟缓先证者为模型,系统解析了次要变异对表型的影响机制,发现疾病表型的差异源于主要变异与多种次要变异之间的相互作用。进一步将分析范围拓展至976名来自疾病队列与健康人群的16p12.1缺失携带者、1,479名携带其他主要变异的自闭症先证者,以及1,528名无主要变异的自闭症先证者,发现变异-表型关联既受主要变异背景和次要变异的互作调控,也受到队列选择标准的影响;即便在表型相似的个体中,次要变异干扰的生物学通路也具有独特性。这些发现为解析复杂疾病表型的遗传病因提供了更完整的理论框架和视角,提示未来的个性化医疗应全面考虑基因组范围的变异对个体表型及治疗效果的影响。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Claussnitzer M, Cho JH, Collins R, Cox NJ, Dermitzakis ET, Hurles ME, Kathiresan S, Kenny EE, Lindgren CM, MacArthur DG et al: A brief history of human disease genetics. Nature 2020, 577(7789):179-189.
2. Posey JE, Harel T, Liu P, Rosenfeld JA, James RA, Coban Akdemir ZH, Walkiewicz M, Bi W, Xiao R, Ding Y et al: Resolution of Disease Phenotypes Resulting from Multilocus Genomic Variation. N Engl J Med 2017, 376(1):21-31.
3. Leitch CC, Zaghloul NA, Davis EE, Stoetzel C, Diaz-Font A, Rix S, Alfadhel M, Lewis RA, Eyaid W, Banin E et al: Hypomorphic mutations in syndromic encephalocele genes are associated with Bardet-Biedl syndrome. Nat Genet 2008, 40(4):443-448.
4. Riordan JD, Nadeau JH: From Peas to Disease: Modifier Genes, Network Resilience, and the Genetics of Health. Am J Hum Genet 2017, 101(2):177-191.
5. Oetjens MT, Kelly MA, Sturm AC, Martin CL, Ledbetter DH: Quantifying the polygenic contribution to variable expressivity in eleven rare genetic disorders. Nat Commun 2019, 10(1):4897.
6. Hudac CM, Bove J, Barber S, Duyzend M, Wallace A, Martin CL, Ledbetter DH, Hanson E, Goin-Kochel RP, Green-Snyder L et al: Evaluating heterogeneity in ASD symptomatology, cognitive ability, and adaptive functioning among 16p11.2 CNV carriers. Autism Res 2020, 13(8):1300-1310.
7. Girirajan S, Eichler EE: Phenotypic variability and genetic susceptibility to genomic disorders. Hum Mol Genet 2010, 19(R2):R176-187.
8. Girirajan S, Rosenfeld JA, Cooper GM, Antonacci F, Siswara P, Itsara A, Vives L, Walsh T, McCarthy SE, Baker C et al: A recurrent 16p12.1 microdeletion supports a two-hit model for severe developmental delay. Nat Genet 2010, 42(3):203-209.
9. Pizzo L, Jensen M, Polyak A, Rosenfeld JA, Mannik K, Krishnan A, McCready E, Pichon O, Le Caignec C, Van Dijck A et al: Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genet Med 2019, 21(4):816-825.
10. Girirajan S, Pizzo L, Moeschler J, Rosenfeld J: 16p12.2 Recurrent Deletion. In: GeneReviews((R)). Edited by Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Amemiya A. Seattle (WA); 1993.
11. Jensen M, Smolen C, Tyryshkina A, Pizzo L, Sun J, Noss S, Banerjee D, Oetjens M, Shimelis H, Taylor CM et al: Genetic modifiers and ascertainment drive variable expressivity of complex disorders. Cell 2025.
12. Pizzo L, Lasser M, Yusuff T, Jensen M, Ingraham P, Huber E, Singh MD, Monahan C, Iyer J, Desai I et al: Functional assessment of the "two-hit" model for neurodevelopmental defects in Drosophila and X. laevis. PLoS Genet 2021, 17(4):e1009112.
13. Hu P, Wu S, Sun Y, Yuan CC, Kobayashi R, Myers MP, Hernandez N: Characterization of human RNA polymerase III identifies orthologues for Saccharomyces cerevisiae RNA polymerase III subunits. Mol Cell Biol 2002, 22(22):8044-8055.
14. Jensen M, Girirajan S: An interaction-based model for neuropsychiatric features of copy-number variants. PLoS Genet 2019, 15(1):e1007879.
15. Pusapati GV, Kong JH, Patel BB, Krishnan A, Sagner A, Kinnebrew M, Briscoe J, Aravind L, Rohatgi R: CRISPR Screens Uncover Genes that Regulate Target Cell Sensitivity to the Morphogen Sonic Hedgehog. Dev Cell 2018, 44(2):271.
16. Simons Vip C: Simons Variation in Individuals Project (Simons VIP): a genetics-first approach to studying autism spectrum and related neurodevelopmental disorders. Neuron 2012, 73(6):1063-1067.
转载请注明来源于【GTP研发中心】



