技术分享:牛羊类精子干细胞建立及其运用
牛羊等反刍动物的育种技术是保障全球肉奶产品供应、提升畜牧业效益的关键。利用基因工程改良反刍动物育种,有望提升畜牧养殖业的经济效益。然而,传统生物育种技术的过程复杂、耗时长、效率低,严重制约了新品种的培育效率,成为畜牧业升级的关键瓶颈。类精子干细胞介导的半克隆技术为突破这一动物育种瓶颈带来曙光。类精子干细胞是一种孤雄单倍体胚胎干细胞(haES细胞),仅携带了来自精子的单套染色体。将体外基因编辑后的小鼠类精子干细胞注射到卵母细胞质中,可快速培育出活体的基因编辑小鼠[1, 2]。此外,类精子干细胞的每个基因仅有单个拷贝,其隐性突变可呈现明确表型,因此在功能缺失筛选实验中展现出独特优势,可替代传统精子用于基因分析,为从细胞到个体水平的快速遗传分析提供了一种新途径[3]。然而,牛羊等反刍动物的类精子干细胞培育技术尚未攻克。
2025年10月,Nature Biotechnology期刊报道了一项研究,通过成功建立牛羊类精子干细胞,快速获得基因编辑牛羊,重塑牛羊生物育种模式,推动反刍动物产业升级。该研究使用全新FACE培养基,首次成功建立了牛羊类精子干细胞,它们均表现出形成态多能性特征,在体外和体内可分化为三个胚层。通过外源表达鱼精蛋白,可有效突破牛羊类精子干细胞注射入卵母细胞(iCHI)后重建胚胎的发育障碍。该方法称为Pro-iCHI,获得的牛羊囊胚发育率达到与体外受精(IVF)相当的水平,并成功培育出健康可育的活体牛。进一步证明体外经CRISPR基因编辑的牛羊类精子干细胞,通过Pro-iCHI 可快速获得基因编辑牛羊,为牛羊生物育种提供了一种极具前景的新方法[4]。
首先,研究者采用两种不同方法制备牛和羊的孤雄单倍体胚胎干细胞(b-haES和o-haES),1)将精子注入去核的卵母细胞(图一a);2)从受精卵中去除雌原核。在注射或去除操作后,这两种方法的胚胎质量和囊胚形成率无显著差异(图一b和c)。从孤雄单倍体囊胚中分离出内细胞团(ICM),将其铺在小鼠胚胎成纤维细胞饲养层上,分别测试了九种不同培养基,但都未能成功建立稳定的细胞系。为实现牛类精子干细胞的长期维持,研究者在基础培养基中添加不同抑制剂与细胞因子,共获得11个有效组合,涉及10条信号通路。其中,使用FACE(FGF2::activin-A::CHIR99021::IWR-1-endo)和FACX(FAC::XAV939)组合培养的细胞能形成集落。由于IWR-1-endo与XAV939均作为Wnt/β-catenin通路抑制剂[5],可互换使用,FACX与FACE实为等效培养基。进一步对activin-A进行测试,获得了在10 ng/ml浓度下传代超过80次的细胞系,并且通过流式细胞分选(FACS)能富集到单倍体细胞(图一d-f)。使用FACE培养基还成功建立了羊类精子干细胞,其多能性标记物表达水平与牛类精子干细胞相当(图一a-f)。与小鼠类精子干细胞[1]的研究结果相一致,在牛羊类精子干细胞中未能检测到Y染色体。在最初获得的牛羊类精子干细胞中,单倍体细胞比例接近20%(图一e),高于小鼠类精子干细胞,表明原始态的小鼠类精子干细胞倾向于快速的二倍体化,而牛羊类精子干细胞的单倍体维持则较为稳定。
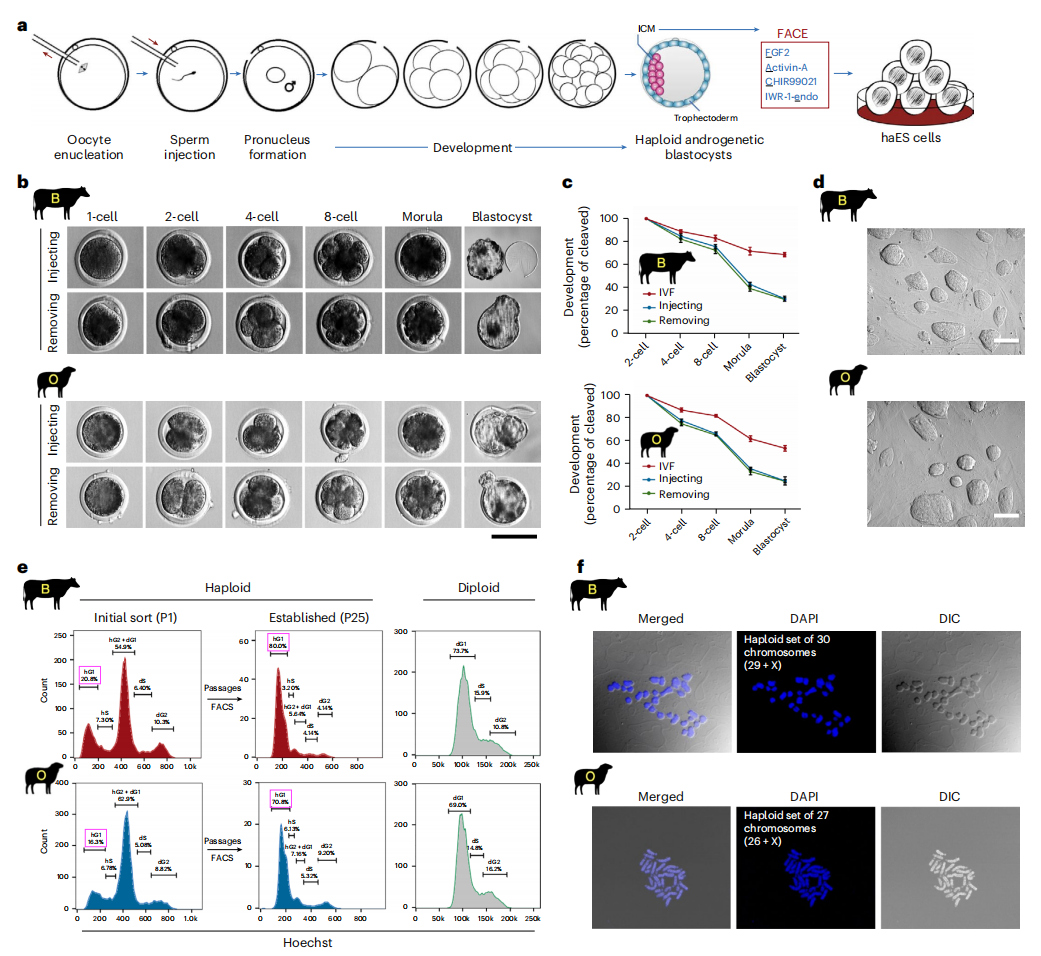
图一 建立牛羊类精子干细胞[4]
接着,研究者探究牛羊类精子干细胞的多能性。免疫荧光显示,牛羊类精子干细胞表达核心多能性标记物SOX2和OCT4,以及形成态多能性标记物OTX2(图二a)。在牛原肠胚形成期(E8-14)对体内二倍体胚胎进行单细胞RNA测序(scRNA-seq),显示牛类精子干细胞与E10天的胚胎细胞聚集在同一簇中(图二b),并包含三种多能性状态:83.8%为形成态,12.1%为始发态,4.1%为原始态(图二c和d)。CUT&Tag分析显示,在形成态基因启动子区域,牛类精子干细胞的H3K4me3修饰水平高于始发态二倍体牛干细胞(b-SC),而H3K27me3修饰水平则相对较低,始发态基因的这些表观遗传修饰则呈现相反趋势(图二e)。跨物种比较分析表明,形成态相关调控因子在牛羊及小鼠的形成态细胞中普遍存在(图二f)。以上数据表明,牛羊类精子干细胞具有形成态多能性的分子特征。
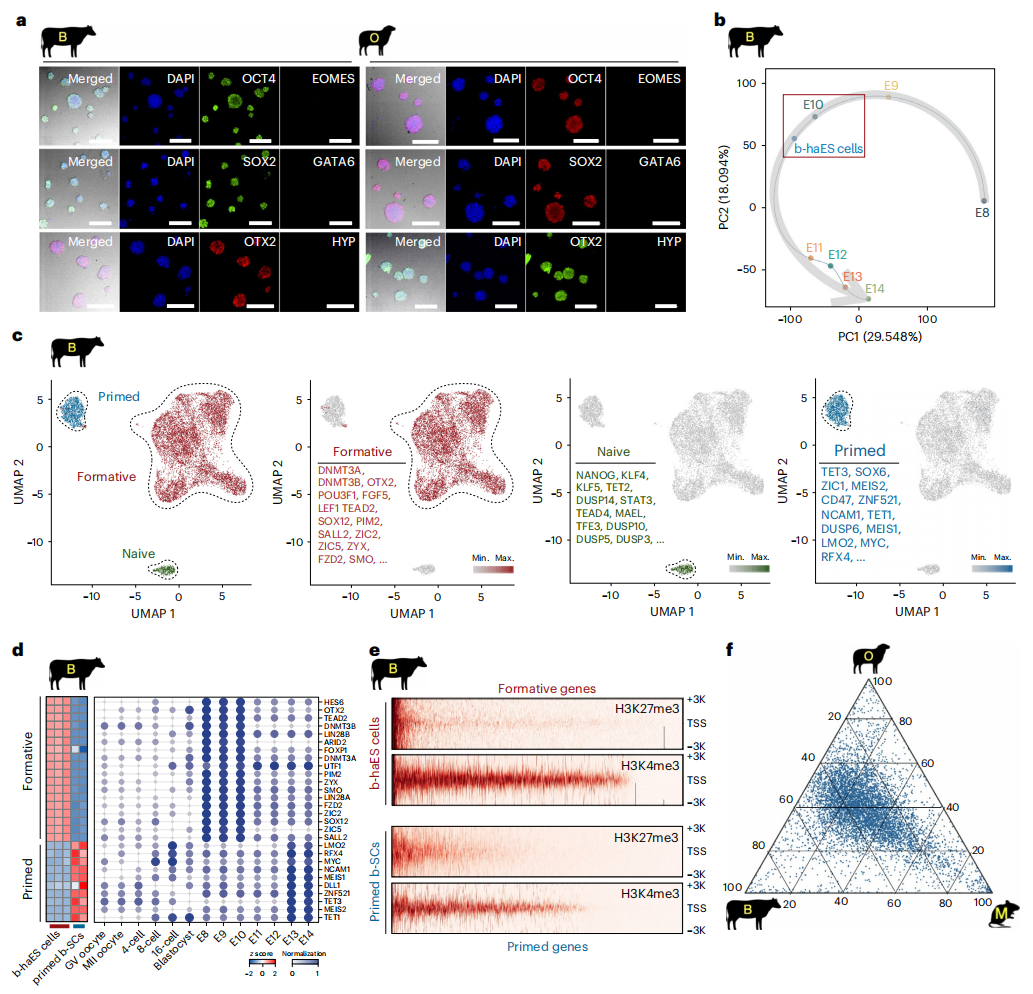
图二 分析牛羊类精子干细胞的分子特征[4]
随后,研究者评估牛羊类精子干细胞的体内外分化潜能。牛羊类精子干细胞在类胚体和畸胎瘤中均可分化为三个胚层,维持单倍体的细胞比例约为16%(图三a和b)。与畸胎瘤实验结果一致,牛羊类精子干细胞在E40(牛)和E30(羊)的种内嵌合体中均具有三胚层分化能力,但未能检测到单倍体细胞(图三c和d)。与羊类精子干细胞不同,牛类精子干细胞能在体外成功诱导为原始生殖细胞样细胞(图三e和f)。将牛类精子干细胞的种间嵌合囊胚移植入代孕小鼠,可在存活的E18.5天种间嵌合体中检测到牛类精子干细胞的贡献(图三g),但牛-小鼠种间嵌合体仅能存活至出生后2天。
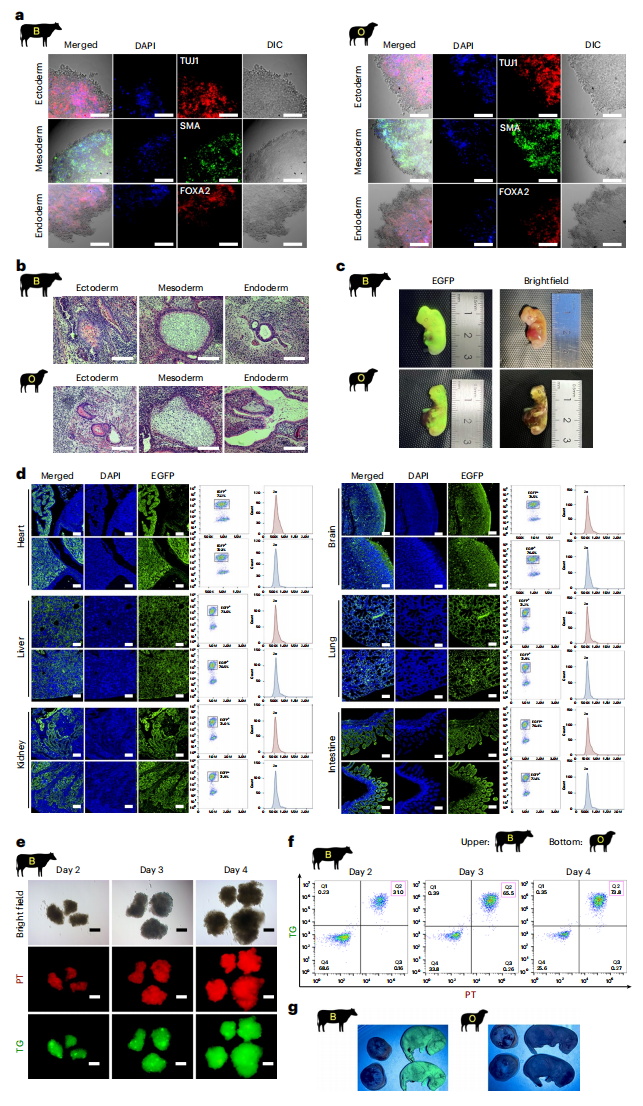
图三 分析牛羊类精子干细胞的体内外分化潜能[4]
研究者尝试用牛羊类精子干细胞重构胚胎发育。将牛羊类精子干细胞分别注入牛和羊卵母细胞,该方法称为iCHI(图四a),类似于胞浆内单精子注射技术。注入的类精子干细胞会形成伪原核并发生DNA去甲基化,这一过程与体外受精胚胎表现一致(图四b)。然而大多数iCHI胚胎未能发育至囊胚阶段(图四c和d)。通过对牛羊类精子干细胞进行焦磷酸测序和全基因组亚硫酸氢盐测序,检测到包括H19、IGF2、DIO3在内的父本印记基因的差异甲基化区域仍保持着与精子相似的正确状态,表明DNA甲基化不是导致牛羊iCHI胚胎发育失败的原因。
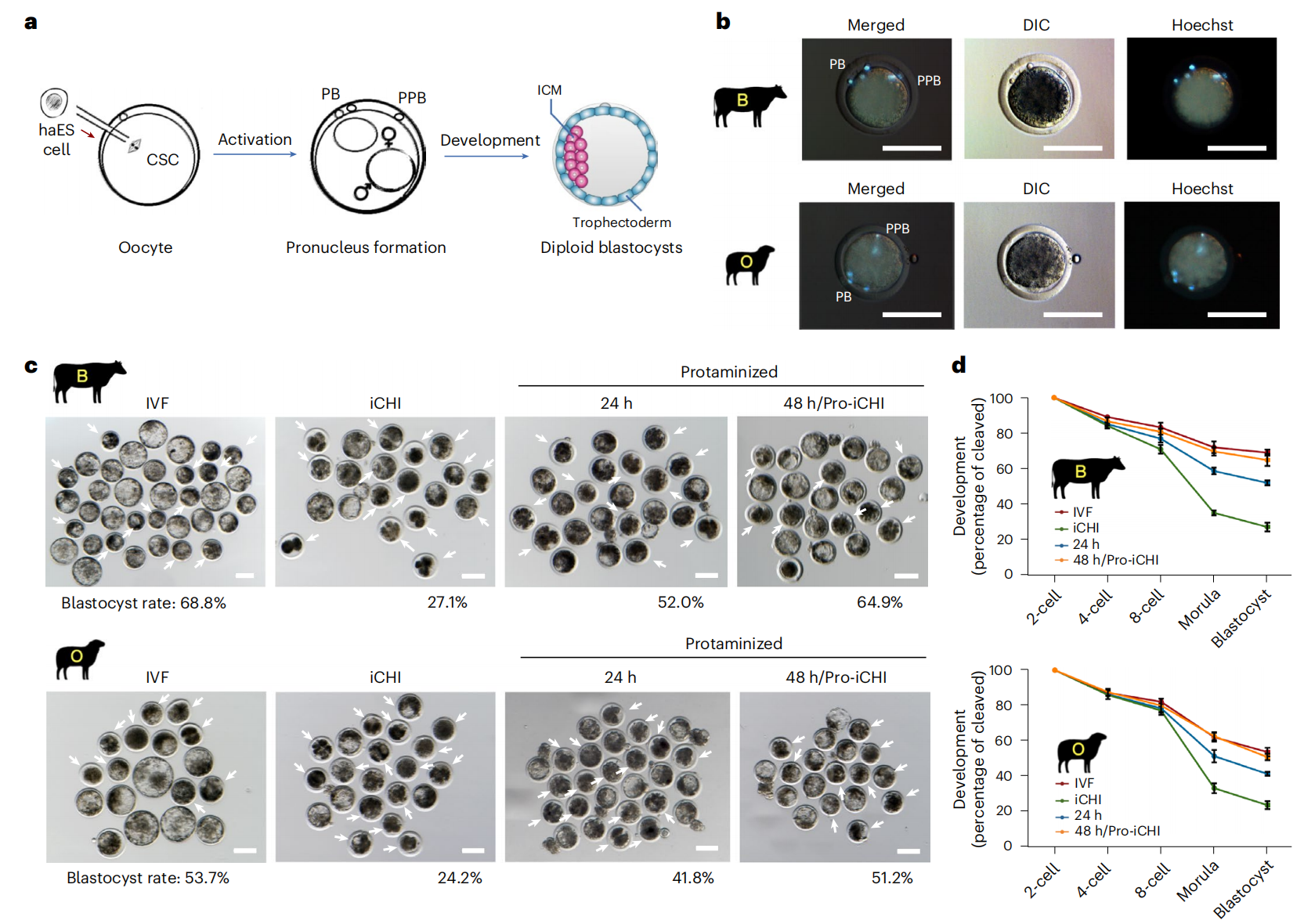
图四 评估牛羊类精子干细胞的重构胚胎[4]
接下来,研究者对组蛋白甲基化修饰进行分析。与体外受精的受精卵组蛋白修饰不对称模式不同,iCHI胚胎在一细胞阶段的所有原核中均存在H3K4me3、H3K9me3与H3K27me3修饰(图五a)。然而,向iCHI胚胎中注射相应的去甲基化酶KDM5B、KDM4D和KDM6A的mRNA也未能纠正这些异常修饰。此外,过表达KDM5B、KDM4D和KDM6A反而加速了类精子干细胞的自发二倍体化,提示需要寻找其他方法来挽救iCHI胚胎的发育潜能。由于鱼精蛋白能在精子发生过程中取代组蛋白修饰[6],研究者采用非整合型游离载体瞬时表达PRM1基因,在牛羊类精子干细胞瞬时表达鱼精蛋白,观察到细胞核逐渐凝聚成类精子结构,同时伴随H3K4me3、H3K9me3与H3K27me3修饰的去除(图五b)。使用瞬时表达鱼精蛋白48小时的类精子细胞作为供体,可修正iCHI胚胎中观察到的对称性组蛋白修饰错误(图五a)。鱼精蛋白iCHI(Pro-iCHI)胚胎的囊胚形成率与体外受精相当(图四c和d)。Pro-iCHI技术培育的牛羊胚胎分别可发育至E75(14/14)和E65(17/20)阶段。与出现巨大胎儿的体细胞核移植动物不同,Pro-iCHI技术培育的牛胎儿保持正常体重(2/14),或者发育迟缓(12/14,图五c和d),这与啮齿类动物的既往研究一致[7]。利用Pro-iCHI,研究者成功培育出一头健康牛犊(存活率14.3%, 1/7),该牛犊发育至成年且具备正常生育能力(图五e)。然而所有Pro-iCHI羊均出现生长迟缓与死胎(图五c和d)。以上数据表明,鱼精蛋白处理的牛羊类精子干细胞能够支持胚胎发育。
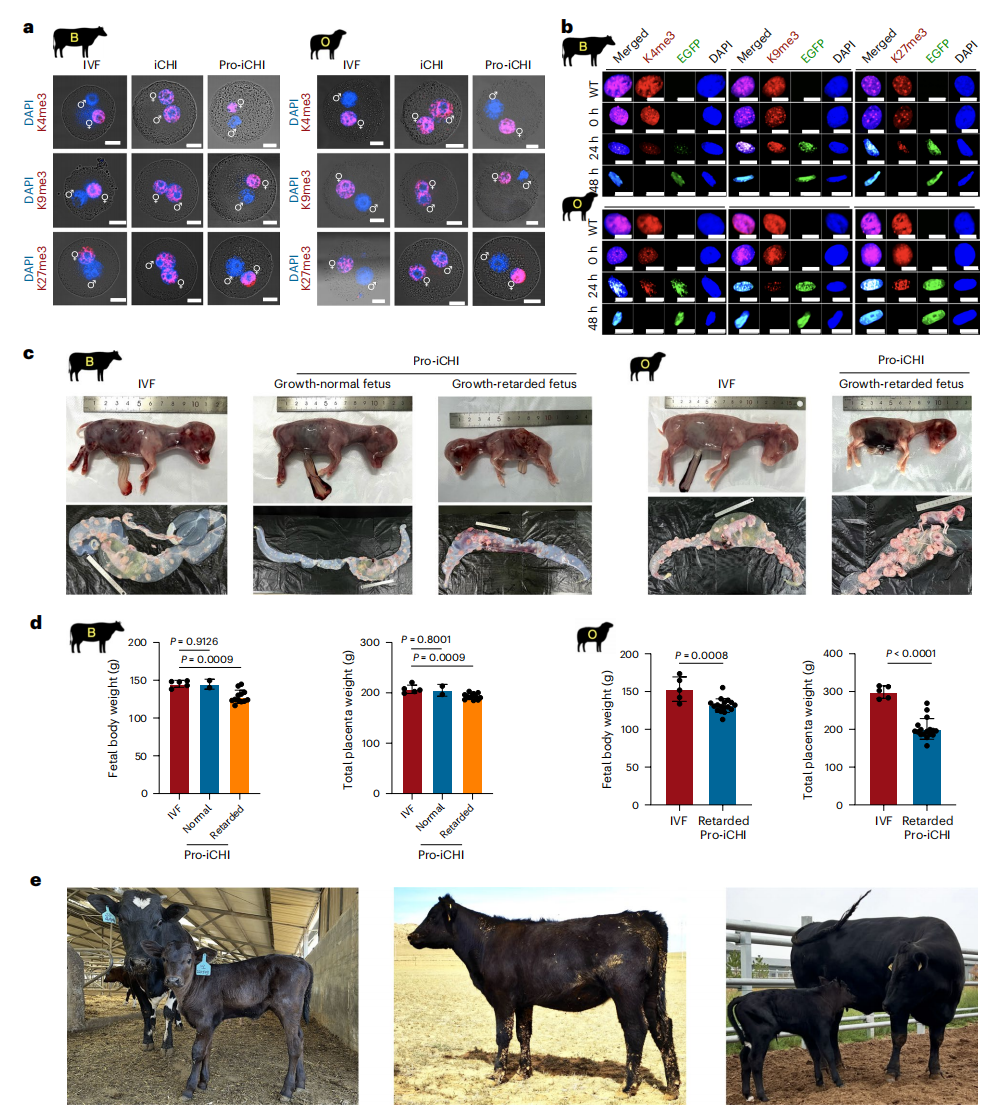
图五 鱼精蛋白可显著改善牛羊类精子细胞的胚胎发育潜能[4]
最后,研究者评估利用Pro-iCHI技术生产基因编辑牛羊的潜力。选择肌肉生长抑制素(MSTN)基因作为编辑靶点,采用CRISPR引导编辑系统(PE)进行修饰,该基因突变可导致肌肉量增加,即双肌特征[8]。鉴于外源DNA基因整合会增加生物安全风险,研究者开发了非整合型游离载体引导编辑系统(ePE)。实验证实,ePE系统能在牛羊类精子细胞的MSTN基因位点分别实现短片段缺失(11bp)和G>A碱基替换(图六a和b)。通过Pro-iCHI技术,最终获得两头MSTN基因编辑阳性的足月牛犊(13.3%,2/15)并存活至成年,还获得一只体型较小的MSTN编辑早产羊羔(0.39%,1/256)。在这些MSTN编辑牛羊中,H19印记区域仍维持正常甲基化状态。
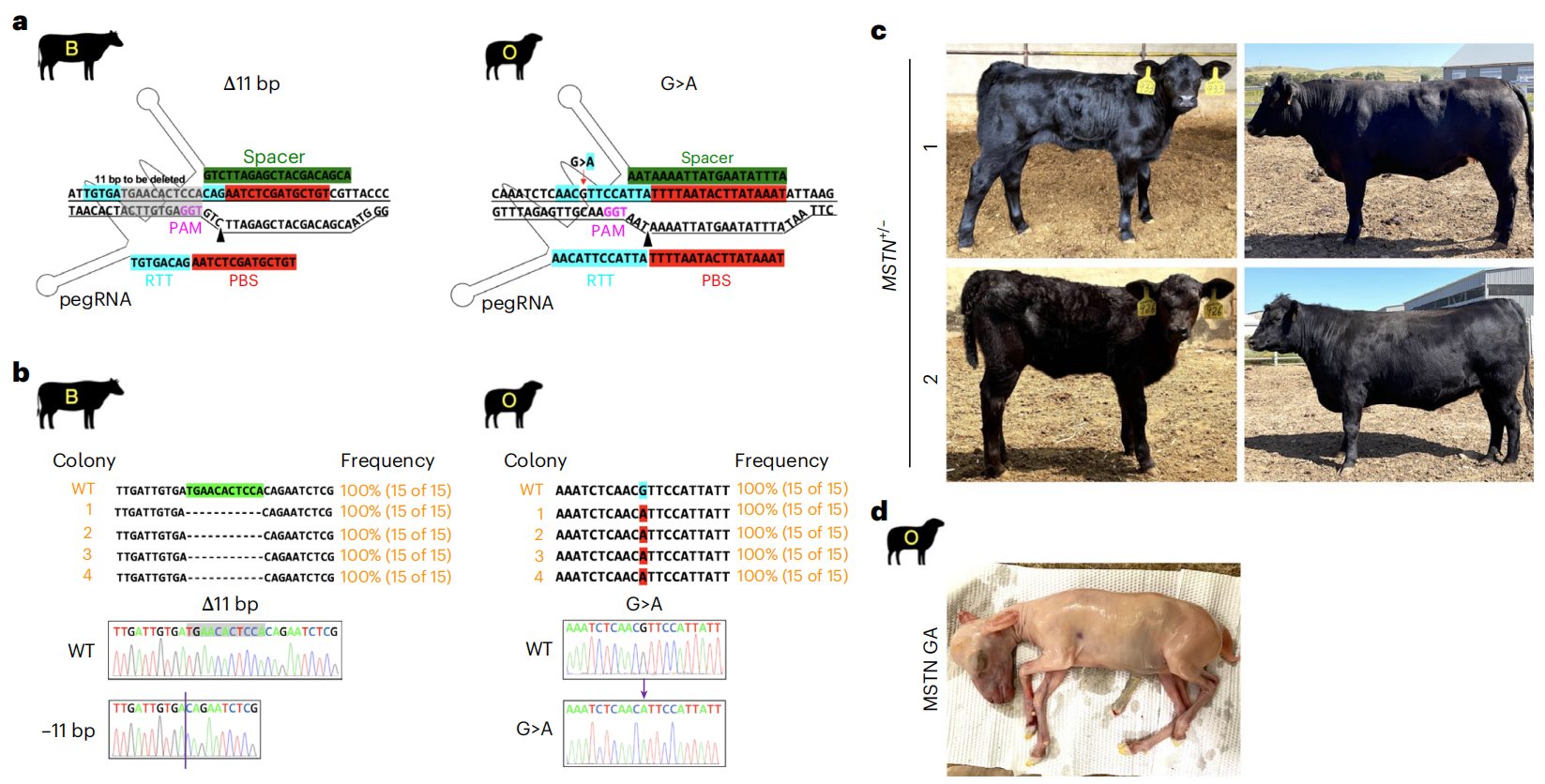
图六 利用体外编辑牛羊类精子细胞快速获得基因编辑牛羊[4]
综上所述,该研究首次成功实现了牛羊单倍体育种技术。首先,研发出全新FACE培养基,首次成功建立了牛羊类精子细胞。其次,实验证明牛羊类精子细胞具有形成态多能性的分子特征,单倍体细胞维持较为稳定,以及体内外分化成三个胚层的发育潜能。再次,研发出Pro-iCHI技术,通过瞬时表达鱼精蛋白PRM1,使得牛羊类精子细胞可替代精子,直接注射到卵母细胞后能支持重构胚胎发育,成功培育出可生育的牛。最后,利用细胞培养的牛羊类精子细胞快速进行基因编辑的优势,体外敲除MSTN基因后,经Pro-iCHI成功培育出一只基因编辑早产羔羊和两头健康的基因编辑牛。该研究革新了牛羊生物育种模式,将助力优良品种的培育改良,推动反刍动物的产业升级。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Yang H, Shi L, Wang BA, Liang D, Zhong C, Liu W, Nie Y, Liu J, Zhao J, Gao X et al: Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell 2012, 149(3):605-617.
2. Zhong C, Yin Q, Xie Z, Bai M, Dong R, Tang W, Xing YH, Zhang H, Yang S, Chen LL et al: CRISPR-Cas9-Mediated Genetic Screening in Mice with Haploid Embryonic Stem Cells Carrying a Guide RNA Library. Cell stem cell 2015, 17(2):221-232.
3. He W, Chen J, Gao S: Mammalian haploid stem cells: establishment, engineering and applications. Cell Mol Life Sci 2019, 76(12):2349-2367.
4. Yang L, Di A, Song L, Liu X, Wu D, Wang S, Hao Z, Bu L, Bai C, Su G et al: Generation of modified cows and sheep from spermatid-like haploid embryonic stem cells. Nat Biotechnol 2025.
5. Lu J, Ma Z, Hsieh JC, Fan CW, Chen B, Longgood JC, Williams NS, Amatruda JF, Lum L, Chen C: Structure-activity relationship studies of small-molecule inhibitors of Wnt response. Bioorg Med Chem Lett 2009, 19(14):3825-3827.
6. Czernik M, Iuso D, Toschi P, Khochbin S, Loi P: Remodeling somatic nuclei via exogenous expression of protamine 1 to create spermatid-like structures for somatic nuclear transfer. Nat Protoc 2016, 11(11):2170-2188.
7. Li W, Li X, Li T, Jiang MG, Wan H, Luo GZ, Feng C, Cui X, Teng F, Yuan Y et al: Genetic modification and screening in rat using haploid embryonic stem cells. Cell Stem Cell 2014, 14(3):404-414.
8. Rodgers BD, Garikipati DK: Clinical, agricultural, and evolutionary biology of myostatin: a comparative review. Endocr Rev 2008, 29(5):513-534.



