技术分享:巴氏综合征治疗新靶点ABHD18
巴氏综合征(Barth syndrome)是一种X连锁的罕见性先天心脏病,全球发病率约为1/300,000,是由X染色体上TAZ基因功能丧失(LOF)突变所导致的脂质代谢先天性紊乱[1]。心磷脂(CL)是线粒体内膜的标志性磷脂,用于稳定电子传递链蛋白复合物[2]。CL是一种四酰化二磷脂酰甘油脂,其酰基链长度和饱和度因物种和组织而异,并在某些病理条件下发生改变[3, 4]。成熟CL主要含有不饱和酰基链,由新生CL逐步合成,以三酰化单溶血心磷脂(MLCL)为中间体。TAZ编码的磷脂-溶血磷脂转酰酶是CL重塑级联反应的最终酶,其突变会导致MLCL积累和成熟CL的减少[2]。尽管TAZ失活导致细胞毒性的确切机制尚不确定,但通常认为与MLCL积累和四酰化CL的缺乏有关,导致超复合物组装和线粒体内膜组织紊乱。
线粒体功能障碍对细胞和组织生理学具有多效性影响,表现为临床多样化的疾病,如肌病,特别是心肌病和脑肌病,通常与线粒体呼吸链功能障碍相关。CL重塑是高度保守的途径,其活性对真核细胞和生物体的适应性至关重要[5]。CL的特征性二聚体结构对于支持单个蛋白质亚基组成多亚基复合物,包括线粒体呼吸链超复合物至关重要,并且在线粒体膜形态、稳定性和动力学中具有不可或缺的作用[2]。巴氏综合征的临床表现因患者而异,小鼠的遗传背景也能影响Taz敲除(KO)表型[6-10],表明TAZ与其他尚未确定的基因之间可能存在遗传相互作用,进而加剧或改善CL紊乱的影响。
2025年9月,Nature期刊发表了一项研究,揭示了巴氏综合征(Barth syndrome)单基因疾病的遗传抑制现象,鉴定出TAZ的遗传抑制因子ABHD18。TAZ是心磷脂(CL)重塑级联中的最终酶,将单溶血心磷脂(MLCL)转化为成熟CL。该研究发现ABHD18是CL生物合成途径中的脱酰基酶,可在体外将CL转化为MLCL。ABHD18失活可挽救巴氏综合征相关小鼠的线粒体缺陷、发病率和死亡率。该研究还发现了一种选择性、共价的ABHD18小分子抑制剂ABD646,可挽救来自人类患者的成纤维细胞和斑马鱼胚胎中TAZ突变表型。该研究揭示了ABHD18与TAZ的表达相关性以及遗传抑制作用,为巴氏综合征的治疗提供了新靶点和新方向。基于这一调控对线粒体健康的关键作用,提示其具有广泛的代谢疾病治疗意义[11]。
TAZ突变的单倍体人类HAP1细胞系具有显著的适应性缺陷,研究者在其基础上使用全基因组CRISPR诱变筛选和互补基因陷阱筛选,寻找TAZ的遗传相互作用因子(GI)。结果显示,两种独立筛选方法获得的候选GI基因,高度富集在线粒体相关功能,如线粒体翻译、线粒体蛋白质输入和嵴形成(图一a和b)。两种筛选方法获得的GI基因高度一致(图一c),例如负调控GI CCDC51和正调控GI ABHD18。在疾病基因的背景下,正调控GI可能是减轻有害表型的治疗靶点。一致地,ABHD18 的功能丧失(LOF)挽救了TAZ缺失HAP1细胞中的增殖缺陷(图一d)。此外,TAZ和ABHD18之间的遗传相互作用是稳健的,在ABHD18-KO细胞的全基因组CRISPR筛选结果中,TAZ也是最强的正调控GI(图一e)。使用癌症依赖性图谱DepMap的公共数据,在数百种细胞系探索基因表达与适应性依赖之间的关系,分析显示ABHD18的表达水平与TAZ强烈相关,反之亦然(图一f),表明这两个基因之间的功能关系保守性。以上数据表明,ABHD18是TAZ突变导致适应性缺陷的遗传相互作用因子。
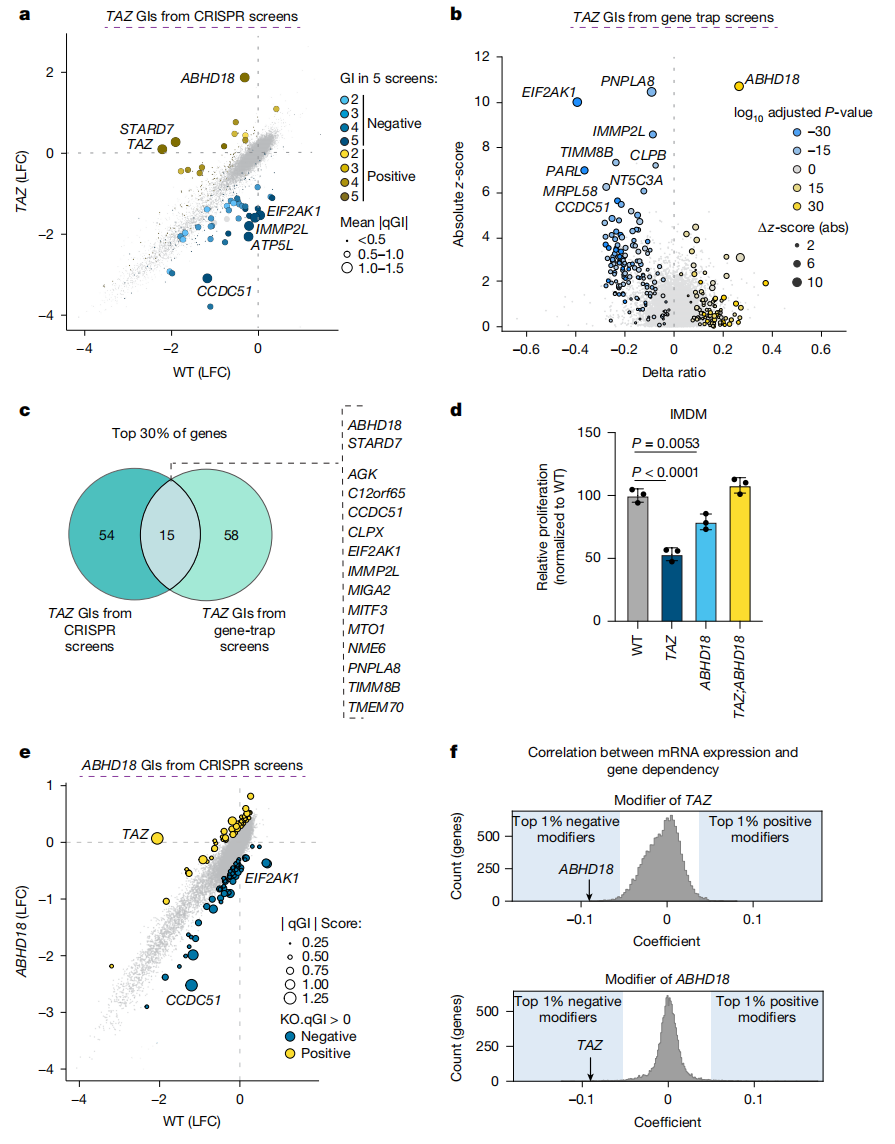
图一 遗传筛选确定ABHD18是TAZ突变适应性缺陷的抑制因子[11]
代谢性丝氨酸水解酶家族约有115个成员,包括脂肪酶、肽酶、酯酶、硫酯酶、酰胺酶和水解酶[12]。α/β水解酶结构域(ABHD)超家族是丝氨酸水解酶的一个子集,调节脂质代谢和信号转导。ABHD18是ABHD家族里未被充分研究的成员,然而,它广谱表达且与线粒体共定位[13],提示其在细胞能量稳态中可能具有基础的保守性作用。研究者使用活细胞显微镜和MitoTracker,确定了 ABHD18定位于线粒体(图二a)。通过邻近标记生物素化鉴定(BioID)检测,发现ABHD18相互作用蛋白主要包括MRC复合物CI、CIII、CIV、CV的组分、线粒体腺苷酸转位酶、TIMM和MICOS复合物的成员、基质代谢酶和参与线粒体膜融合或裂变的蛋白质(图二b),表明ABHD18是一种线粒体蛋白,可能在线粒体内膜中起作用。ABHD18在GXSXG基序内包含一个α/β水解酶折叠和一个活性位点丝氨酸S199(图二c和d),这是水解酶的特征[14]。为了确定ABHD18的催化活性是否是调节TAZ突变适应性所必需的,研究者构建一个活性位点的丝氨酸至丙氨酸突变体ABHD18S199A,表达在TAZ;ABHD18双KO细胞中,使用基于荧光激活细胞分选(FACS)的竞争性共培养生长试验确定适应性影响。结果发现,仅野生型ABHD18,而非ABHD18S199A,重建了类似TAZ LOF的效果(图二e),表明ABHD18的水解酶活性是调节TAZ突变适应性所必需的。
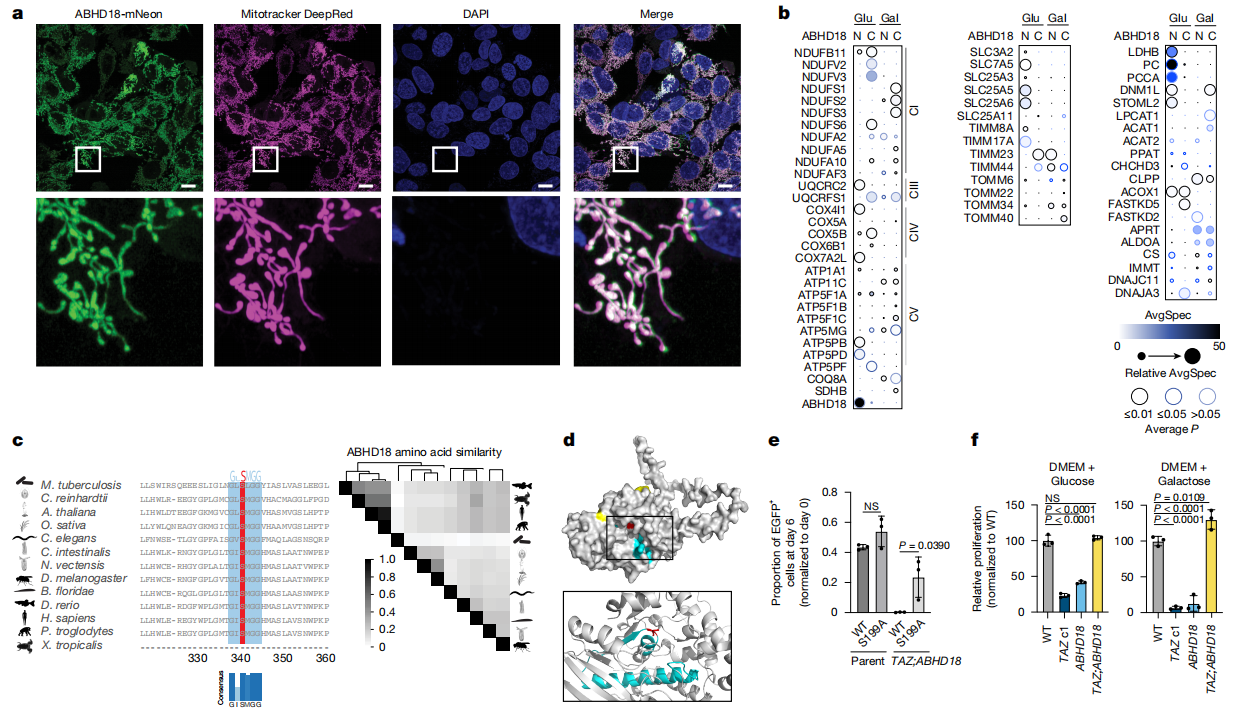
图二 ABHD18是一种线粒体丝氨酸水解酶[11]
接着,研究ABHD18的缺失对TAZ缺失细胞的适应性影响。首先,TAZ-KO HAP1细胞的透射电子显微镜(TEM)显示线粒体形态发生了变化,包括嵴不清、内部囊泡紊乱和肿胀结构。而当ABHD18缺失时,这些表型恢复到HAP1野生形态。其次,研究氧化磷酸化(OXPHOS)对TAZ-KO表型的贡献,在补充葡萄糖或半乳糖的营养缺陷型培养基条件下培养细胞,发现与野生型HAP1细胞相比,TAZ-KO和ABHD18-KO细胞显示出强烈的适应性缺陷,而TAZ;ABHD18双KO细胞的适应性与野生型HAP1细胞相当(图二f)。以上结果表明,TAZ LOF观察到的表型缺陷在很大程度上可以通过ABHD18 LOF进行恢复。
心磷脂(CL)对线粒体呼吸链复合体的形成、组织和稳定性至关重要。研究者研究ABHD18对TAZ缺失细胞中线粒体呼吸超复合体形成的影响。首先,研究者通过蓝绿非变性聚丙烯酰胺凝胶电泳(BN-PAGE)和免疫印迹,分析从单KO和双KO细胞系中分离的线粒体MRC复合体的组成。结果发现,TAZ-KO的HAP1细胞线粒体中高分子量超复合体减少,且某些低阶复合体如CIV2二聚体无法检测到。TAZ-KO细胞的线粒体具有更多的CIII2,单体CIV明显下移,CIV单体的总体水平明显没有变化(图三a和b)。使用CN-PAGE,然后进行凝胶内活性测定(IGA)来监测CIV活性。与TAZ-KO细胞不同,ABHD18-KO细胞的CIV和CIV2水平或活性正常,但CIII2水平降低,且免疫印迹或IGA均未检测到CIII2-CIV异源三聚体(图三a)。TAZ;ABHD18双KO细胞可挽救TAZ-KO或ABHD18-KO导致的超复合体表型,CIV活性在游离单体、CIV2二聚体和CIII2+CIV超复合体中均得到恢复,且高分子量超复合体CI+CIIIn+CIVn与野生型对照无差异(图三a和b)。以上结果表明,TAZ和ABHD18均影响超复合体动态,而ABHD18的缺失可修复因功能性TAZ缺失导致的超复合体组装和活性异常。其次,研究者通过添加解偶联剂分离MRC活性与细胞ATP需求,估算耗氧率(OCR)以评估线粒体能量代谢。结果发现,与单KO或野生型HAP1细胞相比,TAZ;ABHD18双KO细胞表现出更高的基础呼吸、最大呼吸能力及线粒体ATP生成(图三c),表明在TAZ缺失的背景下,ABHD18失活可以增强线粒体能量。
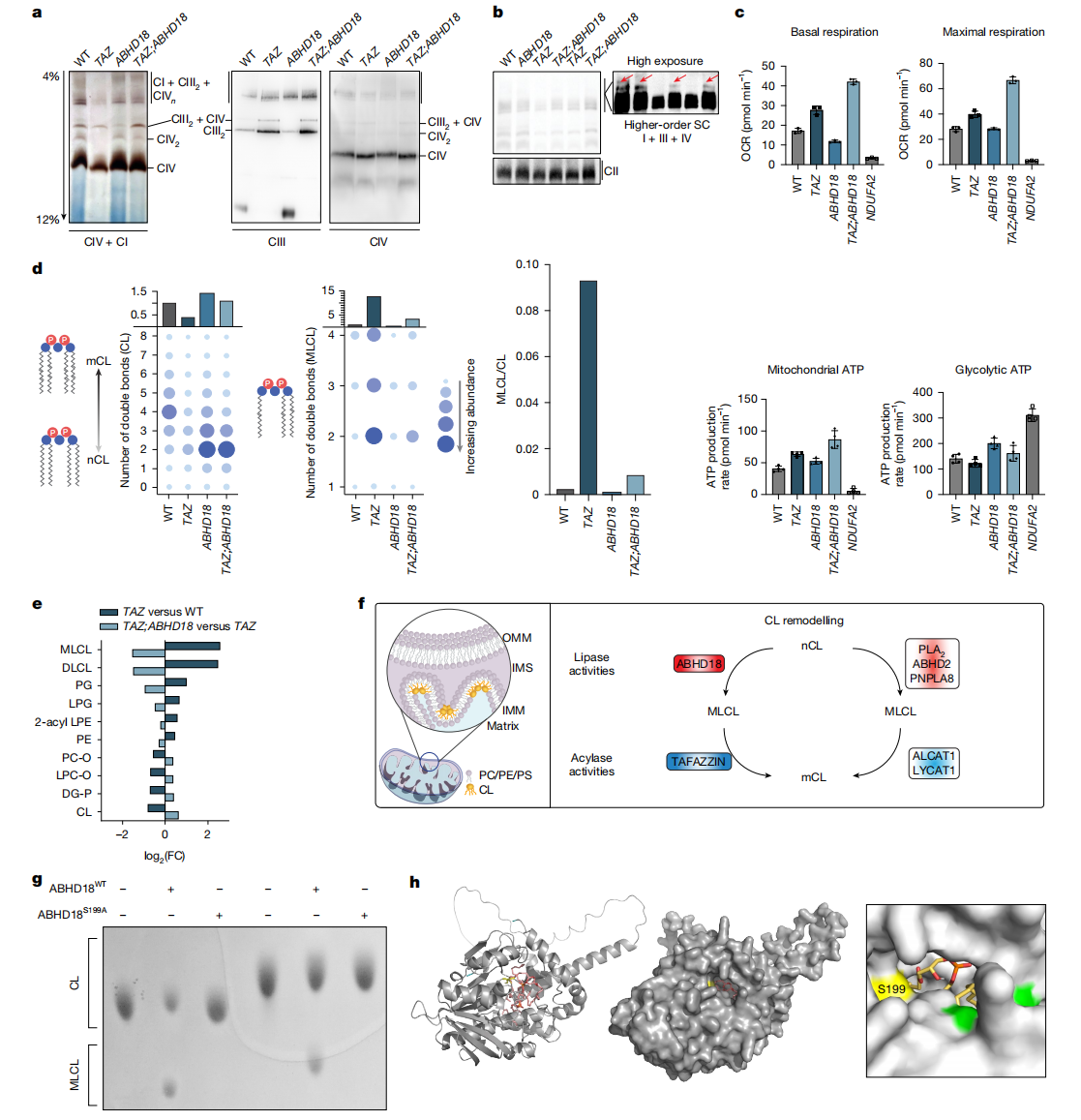
图三 ABHD18调节MRC组装并催化新生CL形成MLCL[11]
在CL重塑过程中,从新生CL(nCL)到成熟CL(mCL)涉及酶促去除CL的酰基链以生成MLCL,后者是TAZ的底物。巴氏综合征的标志性特征是MLCL/CL比值显著升高。在芽殖酵母中,Cld1已被鉴定为将新生CL转化为MLCL的脱酰基酶,但在人类细胞中,此活性尚未明确。研究者猜测ABHD18可能直接催化新生CL形成MLCL。于是,研究者进行了脂质组学分析,对HAP1野生型和突变型全细胞裂解物进行液相色谱和质谱(LC-MS),分析CL种类以及总CL和MLCL的相对丰度。结果显示,TAZ-KO细胞表现出总CL水平显著降低,同时MLCL丰度增加(图三d),以及其他几种脂质的显著失调(图三e)。在TAZ;ABHD18双KO细胞中,CL水平与ABHD18-KO细胞相当,MLCL水平明显低于TAZ-KO细胞,MLCL/CL比值接近野生型水平(图三d和e),表明ABHD18在人类细胞中的CL重塑中具有突出作用(图三f)。随后,研究者直接评估ABHD18的酶活性。从HEK293细胞中纯化了人类野生型和催化失活的ABHD18蛋白,并使用不同CL种类作为底物进行薄层色谱(TLC)。结果显示,所有测试的CL种类,无论饱和度与酰基链长度,都能被ABHD18有效转化为MLCL,但催化失活的ABHD18则不能(图三g),表明ABHD18的CL脱酰基酶作用。结构计算模型表明,CL和MLCL嵌入ABHD18的深催化口袋,靠近S199残基(图三h)。以上结果表明,ABHD18是一种丝氨酸水解酶,促使CL脱酰基生成MLCL。
根据上述实验结果,研究者推测抑制巴氏综合征患者的ABHD18表达可能是一种可行的治疗方法。研究者构建了Taz -/Y单KO和Abhd18 -/-;Taz -/Y双KO小鼠(图四a),双KO小鼠以正常孟德尔比率出生,并以正常速率增加体重(图四b和c)。Taz -/Y雄鼠生育能力显著下降,其后代表现出显著的围产期死亡、生长迟缓,与人类观察到的早产和高儿童死亡率一致[10]。然而,双KO小鼠的生育能力恢复(图四d),且在1岁龄之前没有观察到明显的异常,表明Taz -/Y的影响几乎被完全抑制。通过超声心电图评估小鼠心脏功能,发现Taz -/Y雄鼠在出生后10周出现进行性心室功能障碍,而双KO雄鼠挽救了心室功能障碍的疾病表型(图四e),表明敲除Abhd18可以缓解Taz -/Y雄鼠的心脏疾病表型。RT-qPCR结果表明,双KO雄鼠心脏应激标志物的表达水平与野生型相当(图四f)。脂质组学显示,双KO雄鼠心脏的MLCL/CL比值和总CL水平接近野生型(图四g),LPA、PA、BMP、MLCL和DLCL也显著增加(图四h)。Taz -/Y雄鼠心脏的转录变化反映了线粒体功能障碍的状态和相关补偿机制的表达,而在双KO雄鼠中得到了显著的改善(图四i)。以上结果表明,Taz缺失相关的心脏表型源于线粒体功能障碍,而这种线粒体功能障碍可以通过Abhd18的遗传抑制来得到恢复。
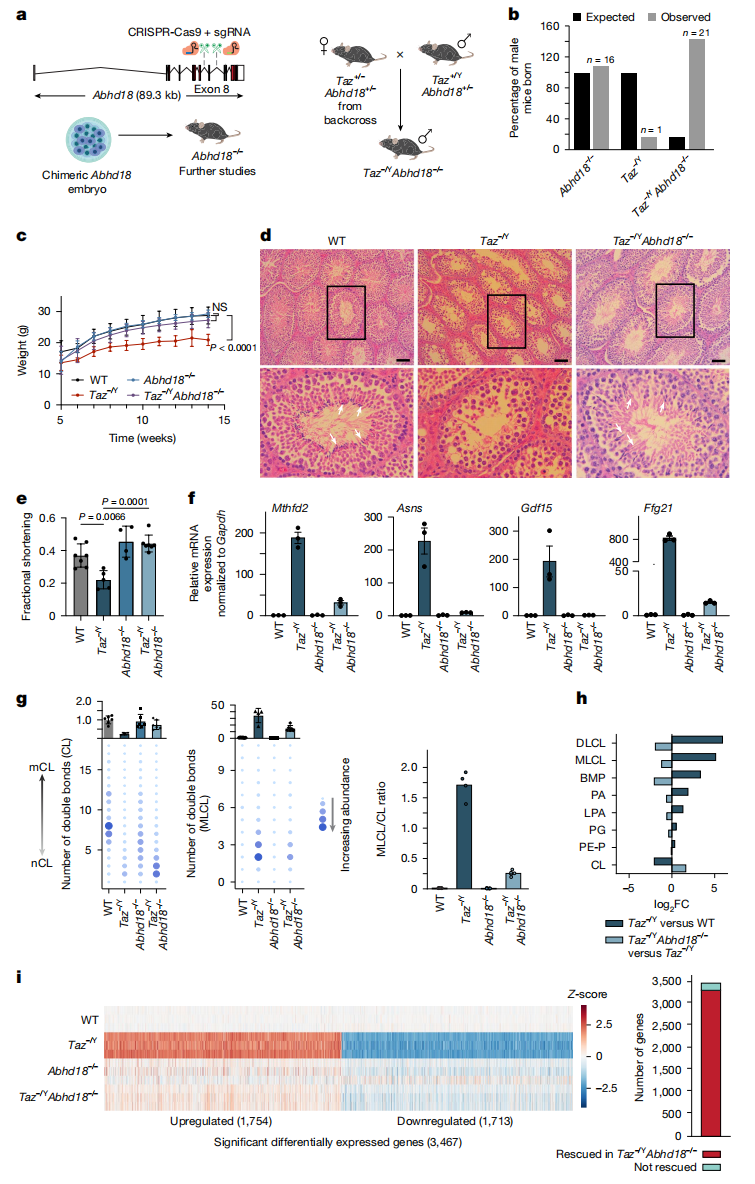
图四 Abhd18缺失能显著改善Taz -/Y雄鼠的巴氏综合征疾病表型[11]
最后,研究者基于活性的蛋白质谱(ABPP),对酶相关蛋白质家族进行协同小分子筛选,筛选到了一种名为ABD646的噁二唑酮类化合物,发现可以通过共价修饰ABHD18催化位点的丝氨酸残基S199发挥抑制作用。ABD646 能有效提高巴氏综合征患者来源的携带c.154G>T突变的成纤维细胞的适应性和线粒体功能,还能恢复Taz缺失斑马鱼胚胎的心脏形态和功能。
综上所述,该研究使用功能基因组学系统性鉴定了TAZ的遗传相互作用因子,筛选出心磷脂(CL)生物合成途径中的脱酰基酶ABHD18。巴氏综合征因TAZ失活导致的MLCL积聚,可通过抑制ABHD18阻止新生CL转化为MLCL,促使血清和组织中新生CL积累,挽救巴氏综合征相关的线粒体缺陷及小鼠的发病率和死亡率。该研究发现了TAZ缺陷表型的遗传抑制因子ABHD18,及其小分子抑制剂具有潜在疗效,这为单基因遗传病通过遗传抑制的方式进行治疗提供了一个范例,也为治疗巴氏综合征以及其他可能涉及CL功能障碍的线粒体疾病提供了一个新的治疗靶点。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Schlame M, Ren M: Barth syndrome, a human disorder of cardiolipin metabolism. FEBS Lett 2006, 580(23):5450-5455.
2. Schlame M, Xu Y: The Function of Tafazzin, a Mitochondrial Phospholipid-Lysophospholipid Acyltransferase. Journal of molecular biology 2020, 432(18):5043-5051.
3. He Q, Han X: Cardiolipin remodeling in diabetic heart. Chem Phys Lipids 2014, 179:75-81.
4. Zhu S, Chen Z, Zhu M, Shen Y, Leon LJ, Chi L, Spinozzi S, Tan C, Gu Y, Nguyen A et al: Cardiolipin Remodeling Defects Impair Mitochondrial Architecture and Function in a Murine Model of Barth Syndrome Cardiomyopathy. Circ Heart Fail 2021, 14(6):e008289.
5. Pu WT: Experimental models of Barth syndrome. J Inherit Metab Dis 2022, 45(1):72-81.
6. Hornby B, Thompson WR, Almuqbil M, Manuel R, Abbruscato A, Carr J, Vernon HJ: Natural history comparison study to assess the efficacy of elamipretide in patients with Barth syndrome. Orphanet J Rare Dis 2022, 17(1):336.
7. Kim AY, Vernon H, Manuel R, Almuqbil M, Hornby B: Quality of life in Barth syndrome. Ther Adv Rare Dis 2022, 3:26330040221093743.
8. Sabbah HN, Taylor C, Vernon HJ: Temporal evolution of the heart failure phenotype in Barth syndrome and treatment with elamipretide. Future Cardiol 2023, 19(4):211-225.
9. Taylor C, Rao ES, Pierre G, Chronopoulou E, Hornby B, Heyman A, Vernon HJ: Clinical presentation and natural history of Barth Syndrome: An overview. J Inherit Metab Dis 2022, 45(1):7-16.
10. Wang S, Yazawa E, Keating EM, Mazumdar N, Hauschild A, Ma Q, Wu H, Xu Y, Shi X, Strathdee D et al: Genetic modifiers modulate phenotypic expression of tafazzin deficiency in a mouse model of Barth syndrome. Hum Mol Genet 2023, 32(12):2055-2067.
11. Masud SN, Srivastava A, Mero P, Echezarreta VS, Anderson E, van Buren L, Wei J, Taylor DT, Farias AG, Mikolajewicz N et al: Genetic suppression features ABHD18 as a Barth syndrome therapeutic target. Nature 2025, 645(8082):1029-1038.
12. Bachovchin DA, Cravatt BF: The pharmacological landscape and therapeutic potential of serine hydrolases. Nat Rev Drug Discov 2012, 11(1):52-68.
13. Morgenstern M, Peikert CD, Lubbert P, Suppanz I, Klemm C, Alka O, Steiert C, Naumenko N, Schendzielorz A, Melchionda L et al: Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metab 2021, 33(12):2464-2483 e2418.
14. Long JZ, Cravatt BF: The metabolic serine hydrolases and their functions in mammalian physiology and disease. Chem Rev 2011, 111(10):6022-6063.



