技术分享:LYVAC/PDZD8介导溶酶体液泡化
细胞质液泡化是哺乳动物细胞中的一种常见现象,涉及细胞内膜的广泛扩张[1, 2]。多种病理条件下会出现细胞质液泡化现象,包括感染、化疗、溶酶体贮积病、白内障、自然衰老、朊病毒病和其他神经退行性疾病[3, 4]。最常见的细胞质液泡来自晚期内体和溶酶体,但由于缺乏机制研究,溶酶体液泡化在病理生理学中的确切作用尚不清楚。
2025年8月,Science期刊报道了一项研究,发现内质网(ER)锚定的脂质转运蛋白PDZ结构域8(PDZD8)介导了溶酶体液泡化,并将其命名为溶酶体液泡化因子(LYVAC)。溶酶体渗透压应激重塑了溶酶体脂质组成,触发LYVAC的募集。LYVAC的脂质转运结构域(SMP)通过保守基序识别溶酶体膜上的磷脂酰丝氨酸(PS)和胆固醇,桥接ER和溶酶体,介导了脂质从ER到溶酶体的定向运动,导致溶酶体膜扩张和液泡化。该研究将溶酶体渗透压失衡与液泡形成联系起来,对研究溶酶体稳态、溶酶体贮积病和神经退行性疾病具有广泛意义[5]。
多种因素可以驱动溶酶体液泡化,包括脂质激酶PIKfyve或其相互作用伴侣VAC14和FIG4的基因突变[6]、朊病毒疾病、慢性内质网(ER)应激或镉毒性。PIKfyve产生磷脂酰肌醇3,5-二磷酸[PI(3,5)P2],后者是一种调节溶酶体离子稳态和渗透压平衡的脂质信使[7]。PIKfyve抑制剂,如阿匹莫德和YM201636,会引发强烈的溶酶体液泡化。于是,研究者使用阿匹莫德诱导的人细胞系液泡化模型来研究其潜在机制。在293T细胞的溶酶体表面稳定表达Lyso-TurboID[8],通过在溶酶体液泡化前后特异性地对溶酶体表面蛋白质组进行生物素化、分离和表征(图一A),锁定了一种脂质转运蛋白,PDZ结构域8(PDZD8)(图一B和C),将其重新命名为溶酶体液泡化因子(LYVAC)。LYVAC是一种ER锚定蛋白,携带SMP脂质转运结构域。最初被认为是一种ER-线粒体束缚蛋白,后来被发现在ER-内溶酶体膜接触位点上[9]。由于溶酶体液泡化的膜扩张需要脂质,研究者推测LYVAC通过ER的大量脂质转移促进溶酶体液泡化。为验证这一假设,在两种不同的细胞系中敲除LYVAC(LYVAC-KO)。阿匹莫德诱导的液泡化在所有LYVAC-KO细胞中都受到强烈抑制,并通过回补LYVAC得到恢复(图一D和E)。高分辨率微分干涉对比(DIC)成像显示,阿匹莫德诱导的液泡和溶酶体相关膜蛋白1(LAMP1)之间几乎完全重叠(图一F),证实了液泡起源于溶酶体。PIKfyve的缺失在野生型和LYVAC回补细胞中引发了溶酶体液泡化,但在LYVAC-KO细胞中没有(图一G和H)。同样地,缺失FIG4诱导了完全依赖于LYVAC的巨大液泡(图一I和J)。以上数据表明,LYVAC对PIKfyve缺失诱导的溶酶体液泡化至关重要。
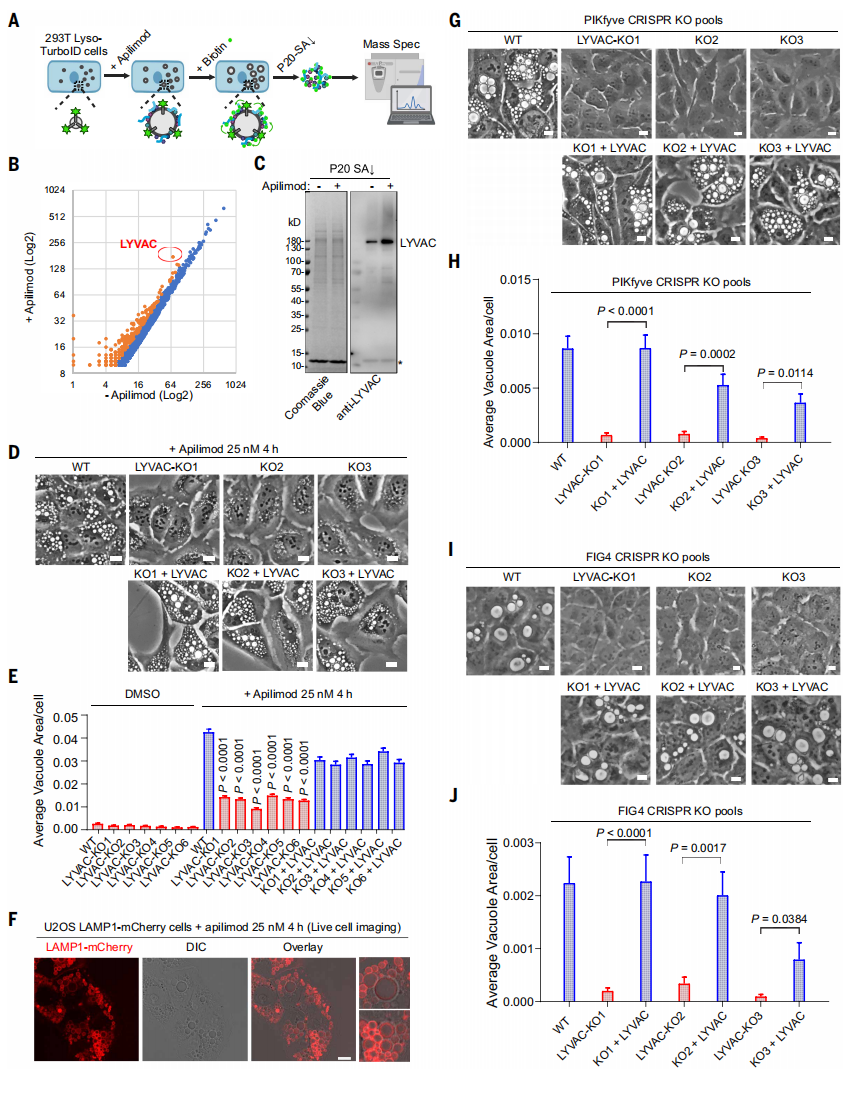
图一 无偏倚蛋白质组学揭示LYVAC是溶酶体液泡化的重要介质[5]
在其他溶酶体渗透压应激诱导剂引发的液泡化,LYVAC也是必需的。例如甲氧氯普胺,一种在酸性溶酶体中积累的弱碱化合物(图二A和B),蔗糖补充模拟的溶酶体贮积病(图二C和D),以及细胞暴露于低渗培基中(图二E和F)。免疫荧光证实不同细胞系中,内源性LYVAC以阿匹莫德依赖的方式募集到溶酶体中(图二G和H),以及对不同的溶酶体渗透压应激诱导剂如蔗糖作出反应(图二I和J)。ER锚定的LYVAC被招募到溶酶体中,表明细胞器间存在膜接触。LYVAC和ATG2是一种自噬相关的脂质转运蛋白,分别响应不同类型的溶酶体应激。尽管ATG2很快被招募到受损的溶酶体中[8],但它没有被招募到溶酶体液泡中(图二K和L)。相反,受损的溶酶体没有招募LYVAC,表明ATG2检测溶酶体膜损伤,而LYVAC响应溶酶体渗透压应激(图二M)。

图二 LYVAC被特异性地招募到渗透压应激的溶酶体中[5]
LYVAC包含六个主要结构域:锚定在ER膜上的跨膜结构域(TM)、SMP脂质转运结构域、PDZ结构域、分裂的C2结构域、C1结构域和卷曲螺旋(CC)结构域[10]。AlphaFold预测LYVAC为同二聚体,两个SMP结构域以反平行方式二聚,形成管状结构(图三A)。为了研究LYVAC如何感知溶酶体渗透压应激,研究者分别剔除了LYVAC的单个结构域(图三B)。缺失SMP(ΔSMP)或ΔC2都会显著增加基准以及阿匹莫德刺激的LYVAC募集(图三C和D)。ΔPDZ略微减少了LYVAC的募集,但剔除了TM、C1或CC结构域消除了LYVAC的募集(图三C和D),表明LYVAC的溶酶体募集需要三个松散连接的结构域——TM、C1和CC。在阿匹莫德诱导的溶酶体液泡化中,TM、C1或CC三个结构域的缺失导致LYVAC诱导液泡化严重缺陷(图三E和F)。此外,尽管溶酶体募集强劲,但LYVAC-ΔSMP不再介导溶酶体液泡化(图三E和F),表明脂质转移在液泡形成中起作用。LYVAC-ΔC2也未能介导溶酶体液泡化(图三E和F)。含有TM-C1-CC三个结构域的片段足以被渗透压应激的溶酶体所招募(图三G和H)。LYVAC-CC结构域直接结合GTP酶RAB7[9],RAB7在液泡化溶酶体上强烈富集。LYVAC-C1结构域与带负电荷的脂质相互作用,特别是磷脂酰丝氨酸(PS)。表明LYVAC通过C1和CC介导的双重相互作用被招募到渗透压应激的溶酶体中,由TM结构域将LYVAC稳定保留在ER-内溶酶体膜接触位点上(图三I)。
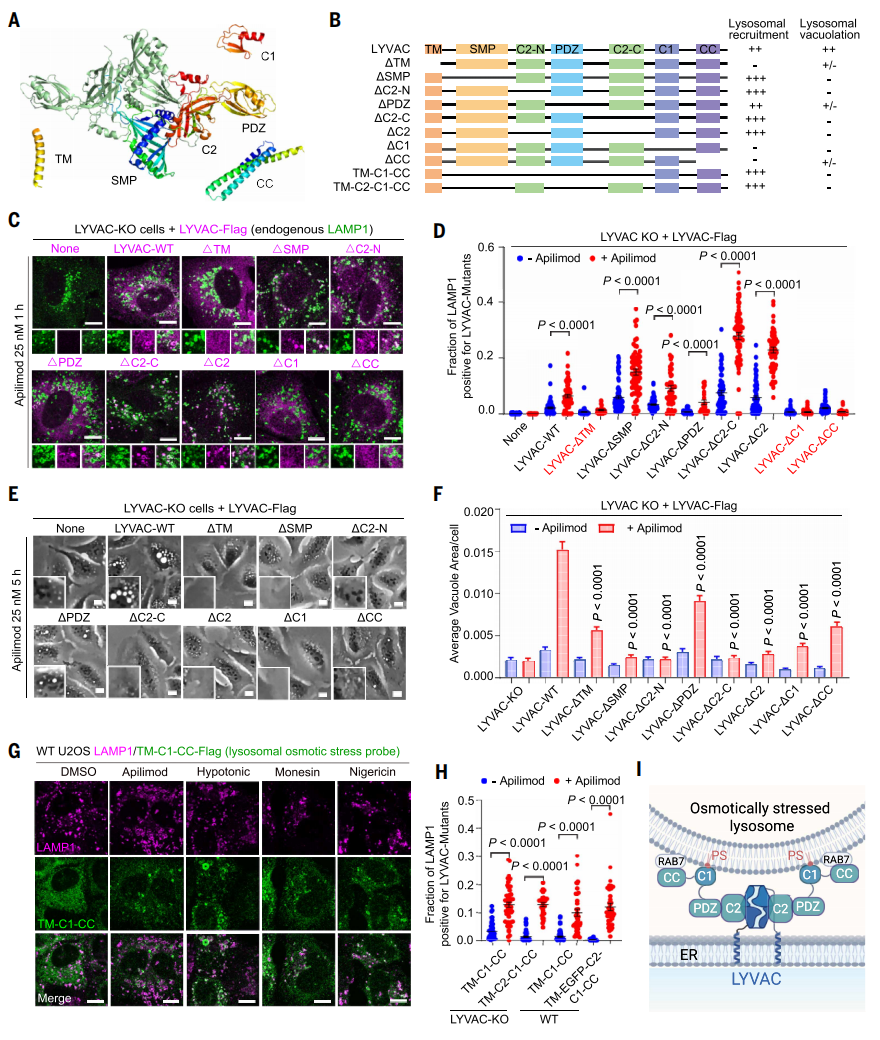
图三 多重弱相互作用介导LYVAC招募到渗透压应激溶酶体[5]
受LYVAC-C1结构域脂质结合能力的启发,研究者注意到溶酶体蛋白质组学包含了多种ORP家族的脂质转移蛋白(图四A)。免疫印迹证实,阿匹莫德诱导溶酶体富集了五种ORP,包括ORP1、OSBP、ORP9、ORP10和ORP11(图四B)。ORP1有两个剪接变体,只有较长的ORP1L被招募。如免疫荧光所示,经过阿匹莫德处理后,在液泡形成之前,溶酶体上积累了多种ORP,与LYVAC相似(图四C和D)。ORP是磷酸肌醇效应物,通常被招募到富含PI(4)P的膜上。PI4K2A是一种产生PI(4)P的酶,PI4K2A及其激酶活性能强烈促进阿匹莫德诱导的溶酶体对ORP1L的募集(图四E)。在五种招募的ORP蛋白中,ORP9、ORP10和ORP11是PI(4)P/PS转运蛋白,而OSBP和ORP1L是特异性PI(4)P-胆固醇交换蛋白(图四H)。结果显示,PS探针(GFP-Lact-C2)和胆固醇探针(GFP-GRAM-W)在阿匹莫德处理后的溶酶体定位都增加(图四F和G),而PS探针的溶酶体募集在ORP9/10/11三重敲除(ORP-TKO)细胞中选择性丧失(图四F),胆固醇探针的溶酶体募集仅在缺乏ORP1L的OSBP-KO细胞中被消除(图四G)。以上结果表明,溶酶体渗透压应激会触发PI4K2A介导的PI(4)P信号传导,从而将ORP招募到ER-溶酶体接触点,将PI(4)P交换为胆固醇和PS(图四H)。

图四 溶酶体渗透压应激激活脂质信号传导,促进LYVAC募集和液泡形成[5]
研究者进一步探究溶酶体脂质信号是否调节LYVAC。敲除PI4K2A消除了阿匹莫德或低渗培基诱导的LYVAC募集和溶酶体液泡化,回补野生型PI4K2A可以完全挽救表型(图四I-M)。在ORP-TKO细胞中,阿匹莫德诱导的LYVAC募集也显著减少,而在OSBP-KO细胞中部分受到抑制(图四I和J),表明PI(4)P驱动的溶酶体PS转移对LYVAC募集很重要,PS是溶酶体渗透压应激反应中的关键脂质。敲除OSBP也消除了溶酶体液泡化(图四K和L),且被回补野生型OSBP所挽救(图四N),表明ER到溶酶体的胆固醇输送对于溶酶体液泡化至关重要。因此,ORP介导的PS和胆固醇从ER转移到溶酶体对于LYVAC驱动的液泡化至关重要(图四O)。最后,研究者实验发现LYVAC的SMP结构域携带保守的PS和胆固醇感应基序,直接感知溶酶体膜上的PS和胆固醇,使特定的脂质定向转移到渗透压应激的溶酶体。
综上所述,该研究发现内质网(ER)锚定的PDZD8介导了溶酶体液泡化,将其重新命名为溶酶体液泡化因子(LYVAC)。不同的溶酶体渗透压应激诱导剂都能触发LYVAC募集和溶酶体液泡化,提出了一个LYVAC介导定向脂质转运模型(图五)。(i)附着:在ER-溶酶体接触处,LYVAC与富含PS/胆固醇的溶酶体膜结合,桥接ER和溶酶体。(ii)转移:渗透压应激溶酶体化学势梯度和膜张力驱动定向的、大规模的从ER到溶酶体的脂质转运。(iii)分离:进入的脂质局部稀释溶酶体上的PS和胆固醇,削弱LYVAC的溶酶体结合并触发其分离,从而防止脂质回流,实现脂质转移的动态循环。这种LYVAC介导的ER到溶酶体的定向脂质运动,可能有利于降低溶酶体膜张力,增强溶酶体渗透弹性,防止破裂。该研究揭示了溶酶体液泡化的基本机制,在病理生理学中具有广泛的意义。
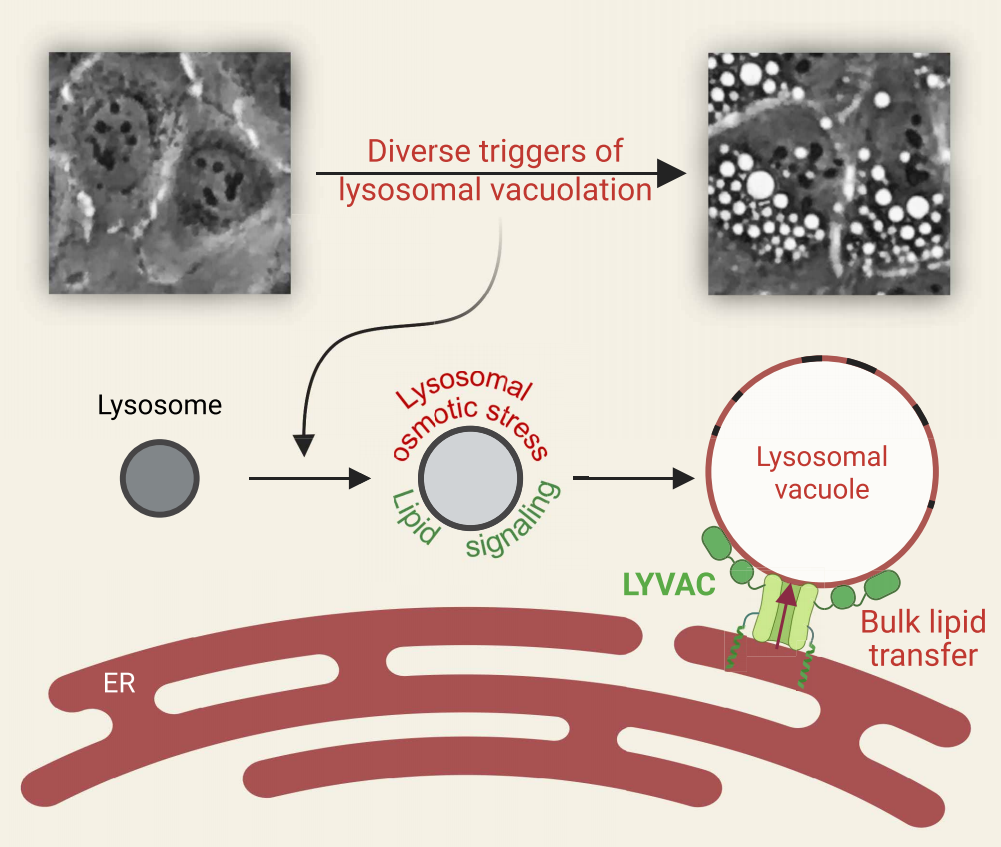
图五 LYVAC介导ER到溶酶体脂质转运导致溶酶体液泡化[5]

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Aki T, Nara A, Uemura K: Cytoplasmic vacuolization during exposure to drugs and other substances. Cell biology and toxicology 2012, 28(3):125-131.
2. Shubin AV, Demidyuk IV, Komissarov AA, Rafieva LM, Kostrov SV: Cytoplasmic vacuolization in cell death and survival. Oncotarget 2016, 7(34):55863-55889.
3. Orge L, Lima C, Machado C, Tavares P, Mendonça P, Carvalho P, Silva J, Pinto ML, Bastos E, Pereira JC et al: Neuropathology of Animal Prion Diseases. Biomolecules 2021, 11(3).
4. Mei S, Wu Y, Wang Y, Cui Y, Zhang M, Zhang T, Huang X, Yu S, Yu T, Zhao J: Disruption of PIKFYVE causes congenital cataract in human and zebrafish. Elife 2022, 11.
5. Yang H, Xun J, Li Y, Mondal A, Lv B, Watkins SC, Shi L, Tan JX: LYVAC/PDZD8 is a lysosomal vacuolator. Science 2025, 389(6762):eadz0972.
6. Rivero-Ríos P, Weisman LS: Roles of PIKfyve in multiple cellular pathways. Curr Opin Cell Biol 2022, 76:102086.
7. She J, Guo J, Chen Q, Zeng W, Jiang Y, Bai XC: Structural insights into the voltage and phospholipid activation of the mammalian TPC1 channel. Nature 2018, 556(7699):130-134.
8. Tan JX, Finkel T: A phosphoinositide signalling pathway mediates rapid lysosomal repair. Nature 2022, 609(7928):815-821.
9. Elbaz-Alon Y, Guo Y, Segev N, Harel M, Quinnell DE, Geiger T, Avinoam O, Li D, Nunnari J: PDZD8 interacts with Protrudin and Rab7 at ER-late endosome membrane contact sites associated with mitochondria. Nature communications 2020, 11(1):3645.
10. Hirabayashi Y, Kwon SK, Paek H, Pernice WM, Paul MA, Lee J, Erfani P, Raczkowski A, Petrey DS, Pon LA et al: ER-mitochondria tethering by PDZD8 regulates Ca(2+) dynamics in mammalian neurons. Science 2017, 358(6363):623-630.



