技术分享:支配肝脏的迷走神经感觉神经元参与调控脂肪变性与焦虑样行为发展
内脏器官与大脑之间的持续通讯是维持机体代谢稳态所必需的。迷走神经节中的迷走神经感觉神经元负责将内脏器官的内感受信号传递至延髓[1]。这类神经元在分子特征、解剖连接和生理功能上具有高度异质性[2],对于正确检测和整合内感受信号以调控代谢稳态及呼吸、奖赏等生命功能至关重要[3]。每种具有独特分子特征的迷走神经感觉神经元分别特异性支配特定靶器官,如喉部、胃、肠道、胰腺、心脏和肺[2]。例如支配肺部的神经元为嘌呤能受体P2RY1阳性和神经肽Y受体Y2表达神经元[4]。胰岛则由表达P物质、降钙素基因相关肽(CGRP)和5-HT3受体的迷走神经感觉神经元支配。然而,关于支配肝脏的迷走神经感觉神经元的分子特征及其在肝代谢中的作用,目前研究仍较为有限。有研究表明,大鼠左结状神经节中少量迷走神经感觉神经元投射至肝脏[5]。这些神经元的外周神经末梢主要分布于胆管和门静脉,而肝实质中未观察到传入神经末梢[6]。
大脑等器官的功能高度依赖肝脏产生的能量,其代谢功能一旦失调将严重影响机体运作。尽管大脑是人体耗能最高的器官,但肝脏代谢是否会影响脑功能仍存在诸多未知。事实上,代谢相关脂肪性肝病(MAFLD)患者出现焦虑、抑郁、双相情感障碍、精神分裂症及痴呆等精神疾病的风险更高[7],揭示肝脏脂质代谢异常可能与精神疾病密切相关。鉴于肝脏来源的内感受信号分子可通过肝迷走神经感觉神经元及体液途径传递至大脑高级中枢,研究者推测MAFLD引发的内感受信号传导紊乱,可能正是导致精神疾病的重要诱因。
2025年1月,Nature Communications期刊揭示了支配肝脏的迷走神经感觉神经元的分子特征及其在调控肝脏脂肪变性和焦虑样行为中的作用。发现一小部分多模态迷走神经感觉神经元投射至肝脏,这些感觉神经元在高脂饮食小鼠的肝脂肪变性发展中起着不可或缺的作用。当小鼠摄入高脂饮食时,肝-脑轴的缺失可阻止雌雄小鼠的饮食性肥胖和肝脂肪变性。此外,缺乏肝脏投射迷走神经感觉神经元的小鼠表现出显著减少的焦虑行为。该研究揭示了支配肝脏的迷走神经感觉神经元在与肥胖和糖尿病相关的精神疾病及代谢紊乱中具有重要作用,为改善肥胖和糖尿病患者的脂质代谢、血糖稳态及情绪障碍提供了新思路[8]。
首先,研究者确定支配肝脏的迷走神经感觉神经元的分子特征。通过向Rosa26-eGFPf小鼠肝脏注射编码Cre基因的逆行腺相关病毒(AAVrg-Cre),AAVrg-Cre病毒被外周迷走神经末梢摄取,并逆向运输至其对应的结状神经节中各自的细胞体(图一a)。GFP免疫染色显示迷走神经节中存在GFP阳性细胞(图一b)。与先前研究显示大鼠迷走神经感觉神经元主要分布于左侧结状神经节不同[9],Rosa26-eGFPf小鼠两个迷走神经节中GFP阳性神经元的数量相近(图一c)。分离上述小鼠的结状神经节进行单核RNA测序(snRNA-Seq)(图一d)。由于支配肝脏的迷走神经感觉神经元数量有限,研究者只成功标记了6个迷走神经感觉神经元,分组后与其它迷走神经感觉神经元进行比较。这些神经元表达多种神经元标志基因,如Syn1、Scn10a、Kcnc2、Avil等,以及多种离子通道亚型如Trpv1、Trpm3、Trpa1、Piezo2等(图一f)。此外,能量代谢和行为相关转录因子(TF)基因表达显著更高,包括Ncoa7、Thra和Tbx3等(图一i)。有趣的是,与其它迷走神经感觉神经元相比,这些神经元还高表达Hcn2、Kcns1、Scn9a、Scn10a和Scn11a等电压门控通道基因(图一g)。支配肝脏的迷走神经感觉神经元主要为谷氨酸能类型,表达Slc17a6基因(图一h)。以上数据表明,支配肝脏的迷走神经感觉神经元具有与伤害性感觉神经元特征相符的多模态分子遗传特性。
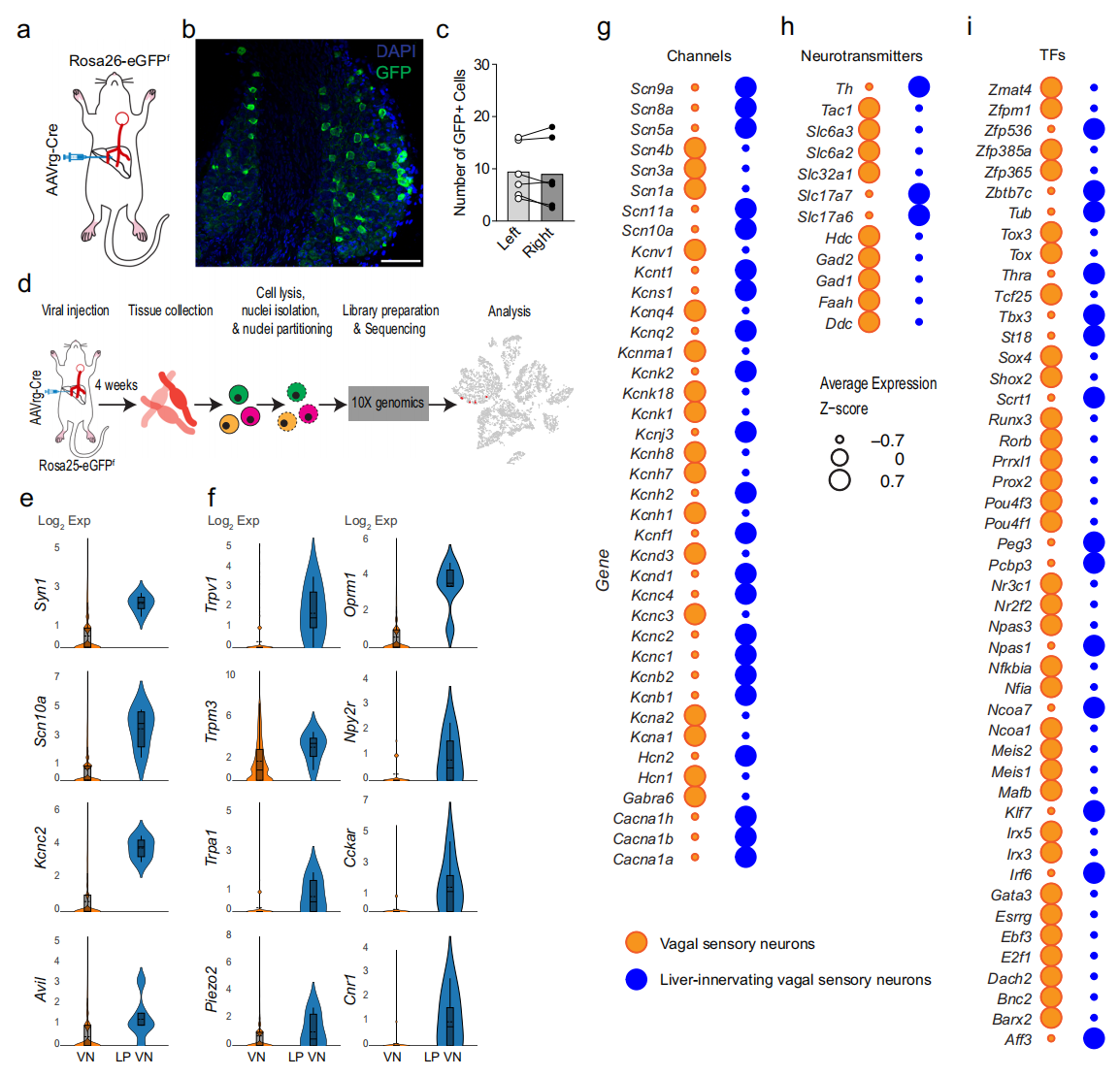
图一 支配肝脏的迷走神经感觉神经元的分子鉴定[8]
基于snRNA-Seq结果,研究者使用AvilCreERT2小鼠来鉴定支配肝脏的迷走神经感觉神经元。将GFP更稳定的逆向病毒AAVrg-FLEX-jGCamp7s注射至AvilCreERT2小鼠肝脏中叶和左叶,实现对支配肝脏的迷走神经感觉神经元的选择性标记。左右结状神经节均显示少量GFP阳性细胞,约10%的Avil阳性迷走神经感觉神经元呈GFP阳性(图二a-c)。进一步使用编码Cre依赖性胎盘碱性磷酸酶(PLAP)的逆行病毒AAVrg-FLEX-PLAP,验证这些Avil阳性迷走神经感觉神经元是否向肝脏发送轴突投射(图二d)。将该AAV注射至AvilCreERT2小鼠肝脏后,在肝实质中尤其是门静脉周围和中叶区域观察到PLAP阳性神经纤维的存在(图二e),表明Avil阳性迷走神经感觉神经元向肝脏发送轴突投射。
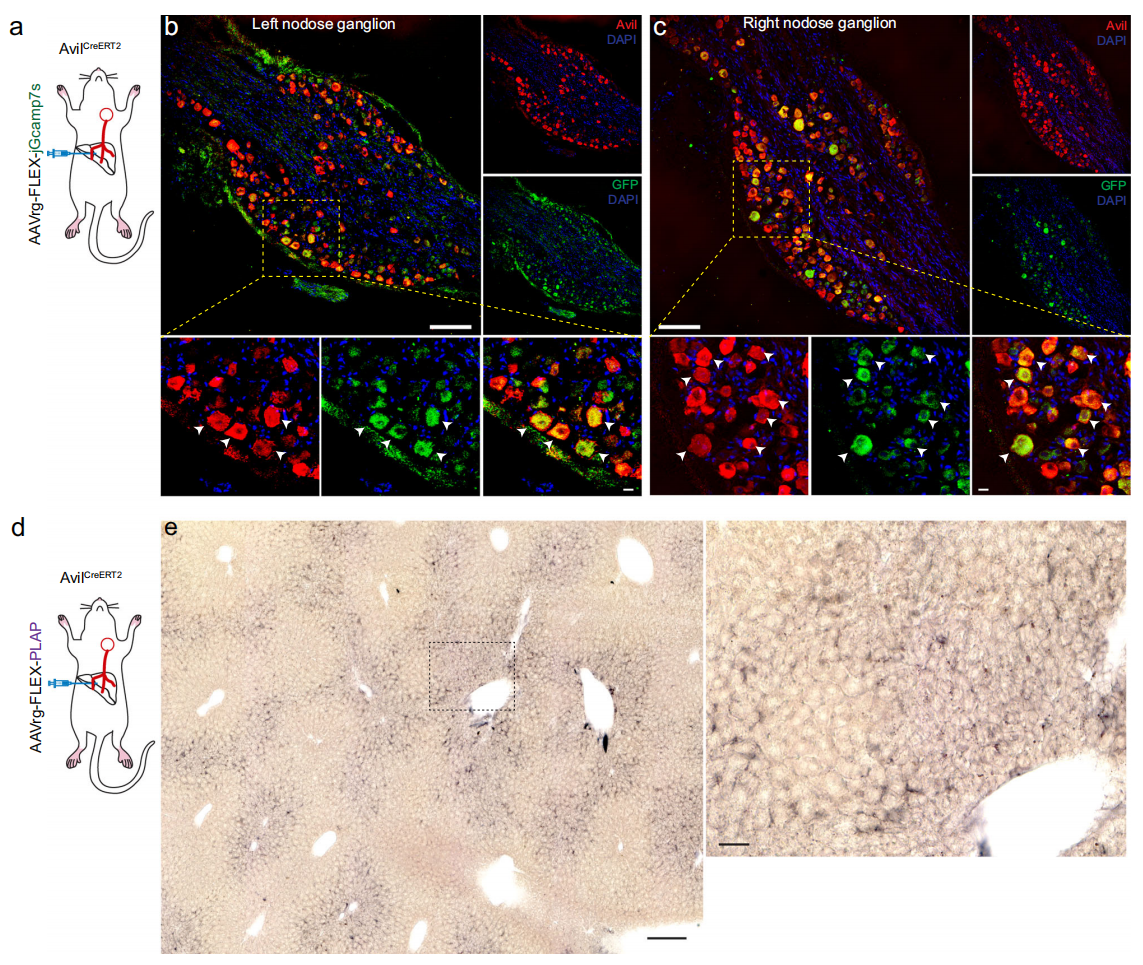
图二 肝脏迷走神经感觉神经元的免疫组织化学鉴定[8]
深入研究这些支配肝脏的迷走神经感觉神经元的外周神经末梢。研究者将AvilCreERT2小鼠与Cre依赖性通道视紫红质(ChR2)-tdTomato小鼠进行杂交得到AvilCreERT2:ChR2-tdTomato,其中ChR2-tdTomato融合蛋白在神经末梢中表现出强表达(图三a)。免疫染色显示门静脉周围区域存在大量tdTomato阳性神经纤维(图三b) ,表明这些神经纤维源自Avil阳性感觉神经元。进一步通过顺行递送方式将AAV1-FLEX-GFPsm-Myc直接注入AvilCreERT2小鼠的左结状神经节(图三c和d),发现顺行标记的GFP和Myc阳性神经末梢主要分布在门静脉周围区域,而不在中央静脉周围区域(图三d)。通过向AvilCreERT2小鼠肝脏注射逆行AAVrg-FLEX-jGCamp7s进一步验证(图三e),发现门静脉周围区域的Avil阳性神经末梢与GFP共定位(图三f),与突触前标志物突触素1(Syn1)抗体的共染色显示,GFP阳性神经末梢同时表达Syn1,证实其为功能性神经末梢(图三g)。以上数据表明,肝脏接收来自Avil阳性迷走神经感觉神经元的突触输入信号。
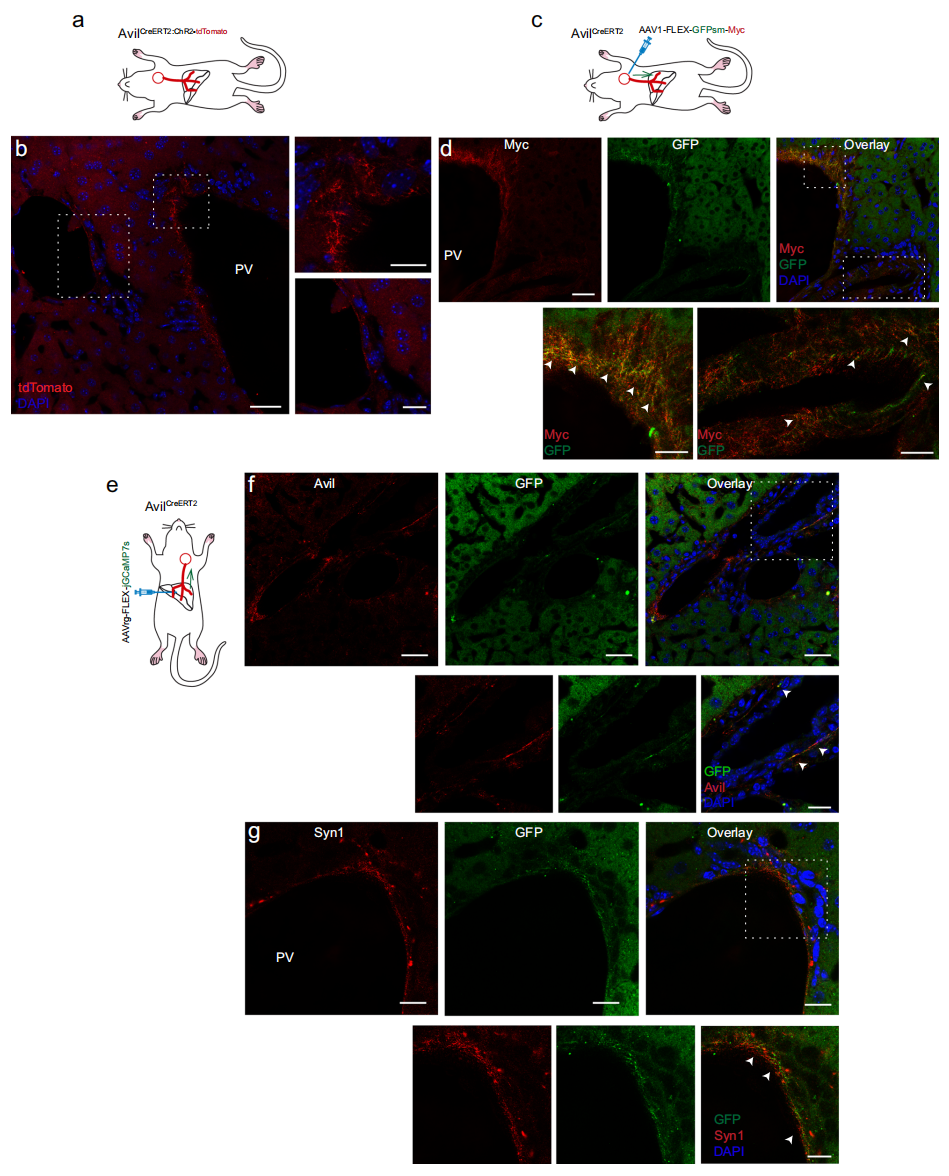
图三 Avil阳性迷走神经感觉神经元向门静脉周围区域投射[8]
由于迷走神经感觉神经元向肝脏门静脉周围区域投射并表达脂质感应型TRP受体(图一f),支配肝脏的迷走神经感觉神经元可能感知营养物质的变化[10]。因此,研究者探究在致肥胖条件下,肝-脑轴缺失对能量平衡的影响。向AvilCreERT2小鼠肝脏注射AAVrg-FLEX-taCasp3-TEVp, taCasp3特异性凋亡该神经元(图四a),使肝脏迷走神经感觉神经支配缺失。实验组雄性小鼠的体重增长明显少于对照组(图四b)。实验组小鼠的脂肪量和去脂体重较对照组均出现显著下降(图四c和d)。两组小鼠在昼夜节律期间的摄食量基本相当(图四e),但实验小鼠比对照组小鼠消耗了更多的氧气(VO2)并产生了更多的二氧化碳(VCO2)(图四f和g),24小时内总能量消耗(TEE)显著增加(图四h)。呼吸能量比(RER)和运动活动在各组之间没有差异(图四i-k)。消融支配肝脏的迷走神经感觉神经元也导致雌性小鼠体重下降(图四m)。这种下降主要与脂肪质量减少有关,而不是去脂体重(图四n和o)。与雄性小鼠类似,缺乏肝迷走神经感觉神经元的雌性小鼠与对照组相比,摄食量未表现出差异(图四p)。间接热量测定分析显示,实验组小鼠的VO2、VCO2和TEE显著高于对照组小鼠(图四q-s)。RER和运动活动也没有差异(图四t-v)。值得注意的是,协方差分析显示体重对TEE具有显著影响(图四w)。以上数据表明,肝脏支配迷走神经感觉神经元缺失导致能量消耗增加和体重下降。
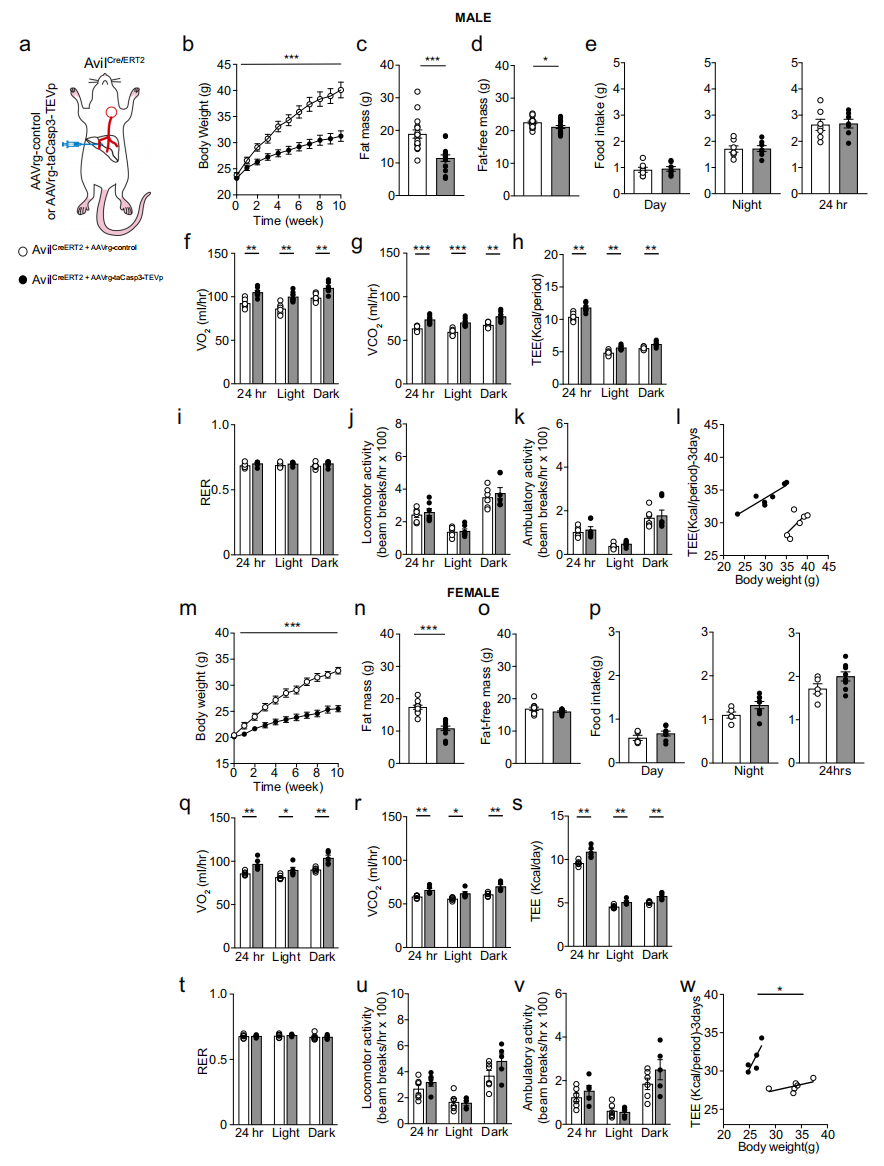
图四 肝-脑功能轴丧失使高脂饮食小鼠能量消耗增加、体重下降[8]
研究者进一步探究肝-脑轴功能缺失对肝脏脂质代谢的影响。与对照组相比,雄性实验组小鼠的肝脏呈现黄褐色,肝脏重量显著减轻(图五a-b)。苏木精-伊红(H&E)染色和油红O染色显示对照组小鼠可见大量大小不等的脂滴,特别是中央静脉周围区域,而实验组则较少(图五c-d和j-k)。雄性实验组小鼠肝脏甘油三酯(TG)水平显著降低(图五e),脂质生成相关基因Srebp-1c、Acaca、Fasn、Scd1和脂肪摄取转运基因Cd36、Fatp3、Fatp4表达下降(图五f和g)。雌性实验组小鼠肝脏颜色未见明显差异(图五h),肝脏重量较对照组略有降低(图五i),TG水平也显著降低(图五l)。与雄性实验组不同,雌性实验组小鼠的脂质生成相关基因表达未见显著差异(图五m),但Cd36和Fatp3表达水平显著降低(图五n)。以上数据表明,支配肝脏的迷走神经感觉神经元在肥胖发展过程中对小鼠肝脂肪变性形成具有关键作用。
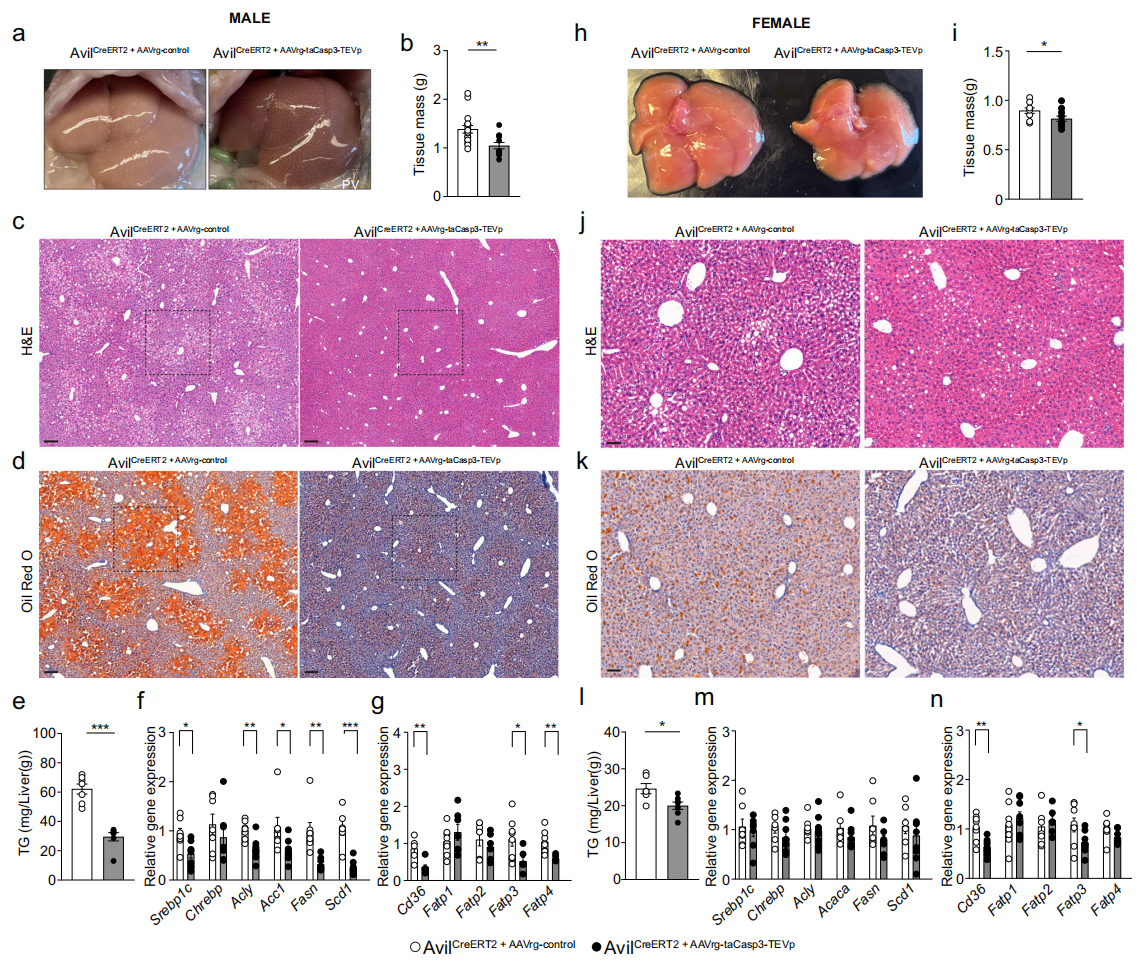
图五 肝-脑轴功能缺失可防止高脂饮食喂养小鼠的肝脂肪变性[8]
与实验组小鼠相比,雄性对照组小鼠的中央静脉周围区域显示出更密集的脂质沉积(图五c-d和j-k)。为确定两组肝脏分区中是否存在独特的基因表达模式,研究者通过空间转录组学技术进行深入分析。基于已知的分区标志物,识别出中央区(PC)、中叶区(Mid)和门静脉区(PP)三个基因簇(图六a)。结果显示,中央区和门静脉区约有500个差异表达基因(DEG),而中叶区则表现出约300个DEG(图六b)。使用Enrichr-KG对各分区的DEG进行GO分析,筛选出富集度最高的前5个GO项(图六c),包括“共翻译蛋白靶向膜”、“SRP依赖性共翻译蛋白靶向膜”、“蛋白质靶向内质网”、“细胞质翻译”以及“细胞蛋白代谢过程”。根据哺乳动物表型本体分析[11],各分区共有4个共同术语,包括“脂质稳态异常”、“肝脏生理功能异常”和“肝脂肪变性”。值得注意的是,每个分区都有一个独特的GO项,例如PP组的“肝脏重量增加”、Mid组的“肝细胞形态异常”和PC组的“异常循环氨基酸水平”。此外,Jensen疾病本体分析显示存在“脂肪肝疾病”相关术语(图六c)。这些结果进一步支持肝脏投射性迷走神经感觉神经元在高脂饮食喂养小鼠中对肝脂肪变性发展起重要作用。肝迷走神经感觉神经元缺失影响基因表达,对照组小鼠表现出Acacb、Fasn、Me1、Pcsk9、Srebf1和Srebf2基因表达增加。相反,实验组小鼠则显示Lpin1、Pnpla2和Ppargc1a基因表达增强(图六d),表明缺乏肝迷走神经感觉输入的小鼠表现出脂肪酸合成和胆固醇减少,以及β氧化和脂解增强。最后,研究者实验证实肝脏迷走神经感觉神经元的消融可显著改善雄性小鼠焦虑样行为。
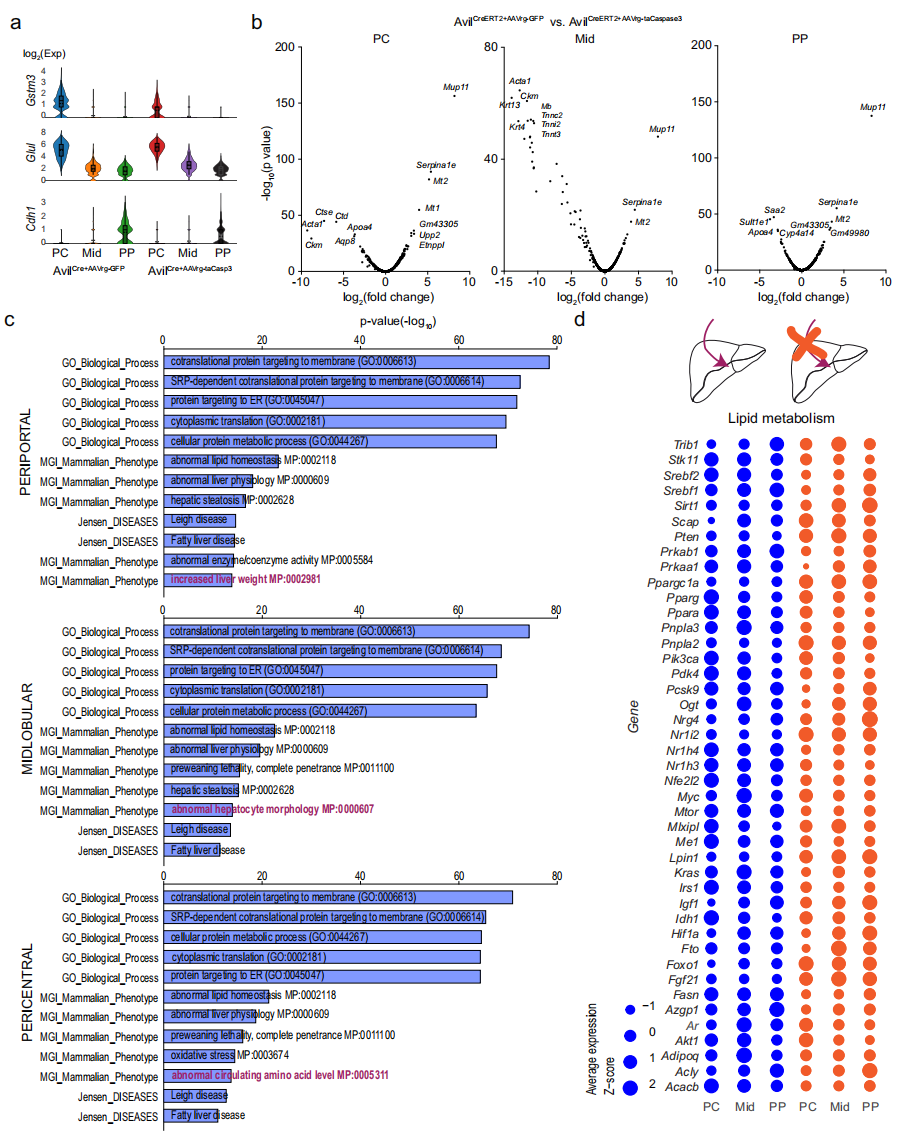
图六 缺乏迷走神经感觉神经元的肝脏表现出独特的基因表达模式[8]
综上所述,该研究探讨了在致肥胖条件下,投射至肝脏的迷走神经感觉神经元对小鼠能量平衡、脂肪肝及焦虑样行为的影响。发现一小部分迷走神经感觉神经元支配肝脏,具有多模式特征。这些神经元的缺失可预防饮食诱导的肥胖,且与能量消耗增加相关,还可以延缓脂肪肝进展,减少焦虑样行为。该研究提示通过调节迷走神经来调控肝脏-大脑轴,有望成为改善肥胖和糖尿病患者脂质代谢、葡萄糖稳态和情感障碍的有效治疗策略。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Waise TMZ, Dranse HJ, Lam TKT: The metabolic role of vagal afferent innervation. Nat Rev Gastroenterol Hepatol 2018, 15(10):625-636.
2. Zhao Q, Yu CD, Wang R, Xu QJ, Dai Pra R, Zhang L, Chang RB: A multidimensional coding architecture of the vagal interoceptive system. Nature 2022, 603(7903):878-884.
3. Bassi JK, Connelly AA, Butler AG, Liu Y, Ghanbari A, Farmer DGS, Jenkins MW, Melo MR, McDougall SJ, Allen AM: Analysis of the distribution of vagal afferent projections from different peripheral organs to the nucleus of the solitary tract in rats. J Comp Neurol 2022, 530(17):3072-3103.
4. Chang RB, Strochlic DE, Williams EK, Umans BD, Liberles SD: Vagal Sensory Neuron Subtypes that Differentially Control Breathing. Cell 2015, 161(3):622-633.
5. Carobi C, Magni F: The afferent innervation of the liver: a horseradish peroxidase study in the rat. Neurosci Lett 1981, 23(3):269-274.
6. Berthoud HR, Kressel M, Neuhuber WL: An anterograde tracing study of the vagal innervation of rat liver, portal vein and biliary system. Anat Embryol (Berl) 1992, 186(5):431-442.
7. Shang Y, Widman L, Hagström H: Nonalcoholic Fatty Liver Disease and Risk of Dementia: A Population-Based Cohort Study. Neurology 2022, 99(6):e574-e582.
8. Hwang J, Lee S, Okada J, Liu L, Pessin JE, Chua SC, Jr., Schwartz GJ, Jo YH: Liver-innervating vagal sensory neurons are indispensable for the development of hepatic steatosis and anxiety-like behavior in diet-induced obese mice. Nat Commun 2025, 16(1):991.
9. Teratani T, Mikami Y, Nakamoto N, Suzuki T, Harada Y, Okabayashi K, Hagihara Y, Taniki N, Kohno K, Shibata S et al: The liver-brain-gut neural arc maintains the T(reg) cell niche in the gut. Nature 2020, 585(7826):591-596.
10. Niijima A, Torii K, Uneyama H: Role played by vagal chemical sensors in the hepato-portal region and duodeno-intestinal canal: an electrophysiological study. Chem Senses 2005, 30 Suppl 1:i178-179.
11. Smith CL, Goldsmith CA, Eppig JT: The Mammalian Phenotype Ontology as a tool for annotating, analyzing and comparing phenotypic information. Genome Biol 2005, 6(1):R7.



